內鏡黏膜下剝離術輔助診治原發性胃淋巴瘤的效果研究
黃神安,錢霞,張麗華,尚紅衛,熊萍,方念
本研究意義:
消化系統腫瘤嚴重危害健康,原發性胃淋巴瘤(PGL)診斷較為困難,但治療、預后與結內非霍奇金淋巴瘤、胃癌不同。內鏡黏膜下剝離術(ESD)可以切到黏膜下層,得到所需要的完整大塊的標本行組織學和免疫病理學檢查,從而提高診斷正確率,目前關于使用微創技術ESD來輔助診斷及治療PGL的研究尚未見報道。應用ESD切除標本行病理檢查對PGL的準確診斷及衛生防治工作意義重大,對患者的健康及有限的醫療資源均有重要的意義。
原發性胃淋巴瘤(primary gastric lymphoma,PGL)是結外非霍奇金淋巴瘤最常發生的部位[1],在胃腫瘤中的發生率僅次于胃癌[2],其源于黏膜下層,發病率近年呈上升趨勢。PGL臨床表現及胃鏡下形態無特異性[3],早期及時診斷較困難,容易誤診,但其治療方法和疾病轉歸與一般胃癌完全不同。一般胃鏡下診斷正確率僅為23.8%,胃鏡聯合常規活組織檢查免疫組化(IHC)染色診斷正確率為64.3%[4]。因為PGL浸潤較深,常規活組織檢查難度較大,一般只能取到黏膜層,很難取到黏膜下層。但內鏡黏膜下剝離術(endoscopic submucosal dissection,ESD)切除深度可達到黏膜下層甚至固有肌層。為避免誤診,本研究使用ESD輔助診治PGL,以期為患者的精準治療提供依據。
1 資料與方法
1.1 一般資料 納入標準:(1)臨床及胃鏡檢查診斷為可疑PGL;(2)符合DAWSON等[5]提出的診斷標準,要求患者無淺表淋巴結腫大,血常規、胸部X線片、上腹部CT未見明顯異常。選取2014年10月—2017年7月在南昌大學第三附屬醫院診治的可疑PGL患者16例,其中,男11例,女5例;年齡28~75歲,平均年齡為49歲。研究對象均知情同意,本研究經南昌大學第三附屬醫院倫理委員會批準。
1.2 診療方法 采用奧林巴斯GIF-XQ260電子胃鏡對所有患者病灶進行觀察,并行多點深挖掘式活組織檢查,活組織檢查后行病理診斷。與患者及家屬溝通,告知多點深挖掘式活組織檢查陽性者追加行ESD挖除標本后行病理診斷PGL的重要性,告知陰性者PGL診斷明確的重要性以及ESD切除標本行病理檢查的先進性。
患者及家屬同意行ESD后,選擇易于行ESD的部位及病變部位行ESD,PGL病變分布具有多灶性,一般選擇易行ESD的部位—胃竇;術后標本進行病理診斷。ESD過程:(1)標記:用氬氣刀在病灶周圍進行電凝標記,距黏膜病灶邊緣0.5~1.0 cm;(2)黏膜下注射:將注射液(由5 ml靛胭脂、1 ml腎上腺素和100 ml 0.9%氯化鈉溶液配制而成)于病灶邊緣標記點外側進行多點黏膜下注射,2 ml/點,可重復注射直至病灶明顯抬起;(3)切開病變外側緣黏膜:用海博刀或勾刀沿病灶邊緣標記點外側緣切開病灶黏膜;(4)剝離病變:借助透明帽,應用海博刀或勾刀于病灶下方對黏膜下層進行剝離,剝離中反復黏膜下注射,始終保持剝離層次在黏膜下層,剝離中通過拉鏡或旋鏡沿病變基底切線方向進行剝離;(5)創面處理:包括創面血管處理與邊緣檢查,通常采用ERBE高頻電氬氣發生器氬離子血漿凝固術、熱活組織檢查鉗、微創金屬鈦夾等技術處理創面;(6)標本處理:切除病灶標本應用大頭針固定四周,測量病灶最大長徑和與之垂直的短徑,4%甲醛溶液固定后送病理檢查(見圖1)。ESD術后處理:一般禁食1~2 d,給予抑酸、補液等支持治療;如有遲發性出血,則行胃鏡下止血,必要時輸血治療;如有穿孔,則行胃鏡下夾閉創面及胃腸減壓。對ESD切除標本病理診斷排外PGL的患者追蹤隨訪,此類患者一般為胃癌或非腫瘤的良性疾病(一般為胃潰瘍或慢性胃炎)。
患者及家屬不同意行ESD后,對常規活組織檢查診斷為胃癌或非腫瘤的良性疾病患者進行隨訪,于治療后1、3、6個月行胃鏡隨訪。
1.3 病理診斷 PGL診斷依據2016版世界衛生組織(WHO)淋巴造血組織腫瘤分類標準[6],病理標本(包括常規多點深挖掘式活組織檢查標本、ESD切除標本、外科手術切除標本)采用組織形態學及IHC檢測輕鏈,觀察其形態學特點。將厚度為3~5 μm的石蠟切片裱于載玻片上,常規脫蠟后行IHC。組織經胰酶或高壓處理后,檢測抗體CD3、CD20、免疫球蛋白κ輕鏈和λ輕鏈。
1.4 幽門螺桿菌(helicobacterpylori,HP)檢測 患者均行HP檢測,包括13C或14C呼氣試驗、病理組織HE染色檢查,陽性結果即判定為HP感染。
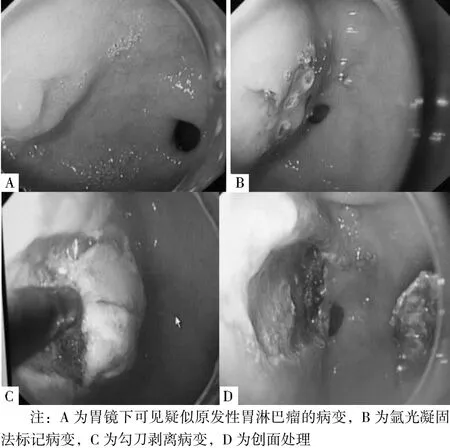
圖1 ESD過程Figure 1 The process of ESD resection
1.5 統計學方法 采用SPSS 17.0軟件進行統計學分析。診斷正確率的比較采用χ2檢驗。以p<0.05為差異有統計學意義。
2 結果
2.1 一般資料 16例患者中,14例行ESD,2例拒絕行ESD后失訪。14例行ESD患者中,11例診斷為PGL,1例診斷為胃癌(經外科手術病理確診為胃癌),2例診斷為胃潰瘍(按胃潰瘍治療8周,治療結束后1、4個月行胃鏡下隨訪,其中,1例因潰瘍長期不愈合經外科手術病理確診為PGL;1例半年后復查胃鏡,病變愈合)。12例PGL患者中,男8例,女4例;平均年齡為48歲。
2.2 胃鏡下病變部位及形態特點 12例確診為PGL患者中,病變部位≥2個者6例(6/12),僅局限于胃體者3例(3/12),僅局限于胃竇者2例(2/12),僅局限于胃底者1例(1/12)。胃鏡下胃體多發淺表糜爛者4例(4/12),多發潰瘍、表面附有白色薄苔、有時可見滲血者4例(4/12),胃皺襞增大、增粗者2例(2/12),黏膜蕈狀突出、多孤立存在、隆起表面有糜爛或潰瘍者2例(2/12,見圖2)。
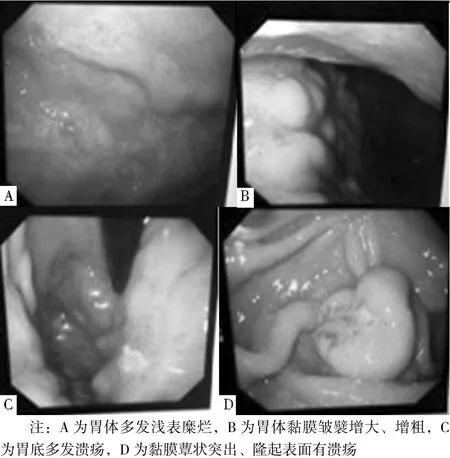
圖2 胃鏡下PGL表現分型Figure 2 The types of PGL during gastroscopy
2.3 病理診斷 16例患者的病理標本行組織形態學及IHC檢測,結果均顯示CD3為陰性,CD20為陽性,有免疫球蛋白κ或λ輕鏈限制性。
2.4 HP感染情況 12例確診PGL患者均行HP檢測,其中11例(11/12)結果為陽性。
2.5 胃鏡下獲取標本診斷正確率 12例確診PGL患者中,根據胃鏡下表現,2例確診為PGL,10例誤診為胃潰瘍、胃癌、胃息肉、胃炎等,診斷正確2例;行胃鏡聯合多點深挖掘式活組織檢查,5例確診為PGL,4例誤診為胃潰瘍,3例胃鏡下高度懷疑胃癌但活組織檢查報告未見癌細胞,診斷正確5例;行ESD切除后,11例確診為PGL,1例誤診為胃潰瘍,診斷正確11例。同時胃鏡聯合多點深挖掘式活組織檢查確診為PGL的5例患者行ESD切除后均診斷為PGL。ESD診斷正確率高于胃鏡聯合多點深挖掘式活組織檢查,差異有統計學意義(χ2=6.750,p<0.05)。
2.6 PGL治療 12例PGL患者均按照PGL正規治療。目前臨床上常用治療方法以化療或放療為主,而外科手術治療適應證為出現嚴重并發癥(如大出血、穿孔或梗阻等)。治療低度惡性PGL,先根除HP感染獲得緩解,若無效再考慮其他治療手段。
2.7 ESD情況 14例患者行ESD切除后病理檢查,ESD切除病變直徑為0.7~1.8 cm,平均直徑為1.1 cm;手術時間(指自病變周邊標記開始至創面處理完畢的時間)為25~45 min,平均手術時間為30 min。術中1例患者出血較多,行黏膜下注射腎上腺素及鈦夾夾閉,止血成功,未接受輸血治療;術后均未發生遲發性出血;術中及術后均未發生穿孔。
3 討論
PGL是原發于胃壁內淋巴小結的惡性腫瘤,沿黏膜下生長逐步浸潤到胃壁,臨床主要表現為腹痛、腹脹等消化道癥狀,與一般胃癌、消化性潰瘍等比較,缺乏特異性;胃鏡下表現多樣性,無特異性;病變部位部分患者局限在某一部位,部分患者可累及幾個部位,亦無特異性,均增加了胃鏡下識別及早期診斷的難度。晚期與癌極為相似,主要病理變化不位于胃黏膜表面,所以影響各種檢查的陽性率。本研究的12例確診為PGL的患者中,僅2例根據胃鏡形態表現診斷為PGL。PGL病程長,進展緩慢,可數年保持局限性,預后相對較好,但首次胃鏡診斷的正確率低。早期準確診斷是該病的重點及難點,也是臨床上造成該病易誤診、誤治的原因,所以需要找到一種提高PGL診斷正確率的方法。
PGL發病率近年逐漸增長,但術前誤診率高,常被認為是胃癌或胃潰瘍、胃息肉等。國內大部分醫院主要是依賴胃鏡活組織檢查病理和IHC技術來診斷該病,但常規胃鏡活組織病理檢查陽性率不高。目前PGL胃鏡下診斷正確率僅為23.8%,術前誤診率可達53%[4],術后經病理檢查才能明確診斷。PGL雖有惡性腫瘤的生物學特性,但其治療和預后明顯優于胃癌,主要表現在以下3個方面:(1)PGL患者對化療敏感,通過術前化療,可使腫塊明顯縮小,提高手術切除率,減少術中播散及術后殘留,進而提高生存率;(2)采取抗HP治療[7],部分PGL患者可以治愈,或化療聯合局部放療的保胃療法,避免了外科手術治療及并發癥的發生,節省了社會醫療資源,本研究12例確診PGL患者中,11例被證實伴有HP感染,說明PGL與HP感染有密切聯系,根除HP可改善PGL的治療效果;(3)多數PGL患者不需行手術治療,由于PGL可累及多個部位,手術效果欠佳,一般外科手術治療適應證為出現嚴重并發癥(如大出血、穿孔或梗阻等)。以上充分說明了PGL正確診斷的重要性,診斷明確才可以選擇合適的治療方案,避免不必要的手術以及提高患者的生存質量。
PGL浸潤較深,常規活組織檢查難度較大,很難取到黏膜下層。PGL易誤診的原因有3點:(1)PGL缺乏典型的臨床及胃鏡表現,與一般的胃癌、胃息肉及胃潰瘍等胃部疾病難以鑒別;(2)PGL病變主要來源于黏膜下層,一般胃鏡下活組織檢查只能取到黏膜層,無法取到黏膜下層,常規活組織檢查深度不夠;(3)PGL無特異性的腫瘤標志物篩查指標。以上3點原因決定了常規方法診斷PGL的正確率較低。
胃鏡結合病理組織學檢查是診斷胃內病變的確診手段。胃鏡可以觀察病變的形態及位置,還可以通過活組織檢查孔道鉗取病變檢測[8]。但一般活組織檢查只能取到黏膜層,深挖掘式活組織檢查亦難取到黏膜下層。本研究結果顯示,胃鏡聯合多點深挖掘式活組織檢查診斷正確率為41.7%(5/12),常規深挖掘式活組織檢查陽性率低的原因:(1)活組織檢查鉗達到的深度不夠,未能有效達到黏膜下層;(2)活組織檢查鉗夾取的組織一般較小,未取到有效病變組織;(3)活組織檢查鉗夾取的組織過少,淋巴瘤組織與其他胃癌組織無法有效區分。
PGL雖為胃部惡性腫瘤,但惡性程度低于胃癌,治療方法也與胃癌不同。已有學者研究報道,胃鏡下大塊切除病變可有效提高PGL診斷正確率[9]。因此,本研究對高度懷疑PGL而常規胃鏡活組織檢查不支持診斷者,采用ESD輔助診斷PGL。ESD技術在我國近10年來高速發展,具有可完整切除較大病灶、提供完整病理診斷材料等優點[10]。ESD可以切到黏膜下層甚至更深的層次,可以切除完整大塊的標本,從理論上可明顯提高診斷正確率,提高PGL的早期確診水平,可能為PGL的早期診療開辟新的途徑。
ESD技術已經廣泛應用,是我國消化科3大技術〔經內鏡逆行性胰膽管造影術(ERCP)、ESD、超聲內鏡(EUS)〕之一[11]。ESD切除病變的深度可以到黏膜下層甚至固有肌層,可提供準確的病理分期。ESD切除的病變部位可用來明確診斷巨大廣基息肉、消化道早癌及類癌等。ESD技術免除了患者外科手術之苦,節約了醫療成本及提高了患者的生存質量,為患者提供更多治療選擇,提高醫療資源的利用率。
ZHOU等[12]研究證實胃鏡超聲引導下內鏡下黏膜切除術(endoscopic mucosal resection,EMR)可提高PGL診斷正確率,但仍有一定的誤診率。筆者分析EMR誤診PGL可能的原因:(1)PGL可累及多個部位,選取行EMR的部位不恰當;(2)EMR切除病變不夠完整,可能有殘留及未切到有效組織;(3)EMR切除深度未有效達到黏膜下層。ESD是在EMR基礎上發展的一種胃鏡下微創治療新技術,可以切到更深的層次,而且可以完整切除病變,是PGL診斷的一種有效的新方法。
PGL進展較慢,部分PGL病灶僅局限在一個部位。有學者指出應用化療聯合ESD治療PGL合并胃癌已取得了滿意的效果,可替代傳統外科手術治療的方法[13]。KUDO等[14]研究結果表明,ESD對于原發性食管淋巴瘤是一種療效確切的方法。以上均說明ESD有可能成為治療PGL的一種新微創手段。
本研究結果顯示,ESD的診斷正確率為91.7%(11/12),明顯提高了PGL的診斷正確率,其中1例患者誤診的原因可能與取材部位不恰當有關。本研究14例行ESD患者中,只有1例患者術中出血,未發生術后遲發性出血、術中及術后穿孔,說明了ESD是一項安全的輔助診治手段。
綜上所述,采用ESD輔助診斷PGL,可提高診斷正確率,降低誤診率。ESD將成為診斷PGL的一種新微創手段,減少患者不必要的手術治療,給予患者行之有效的靶向治療。為了更好地選擇ESD切除部位及深度,可以術前使用EUS評估。ESD可以作為PGL的一種新的有效輔助診斷手段,值得進一步研究。
作者貢獻:黃神安進行文章的構思與設計,結果的分析與解釋,撰寫論文,論文的修訂;黃神安、錢霞進行研究的實施與可行性分析;張麗華、尚紅衛進行數據收集;熊萍進行數據整理;錢霞進行統計學處理;黃神安、方念負責文章的質量控制及審校,對文章整體負責,監督管理。
本文無利益沖突。

