優化課堂演示實驗 提升學生核心素養
——以乙烯與溴的四氯化碳溶液反應為例
屠飛杰
(浙江省紹興市華維外國語學校 312300)
化學是一門以實驗為基礎的自然科學,在日常教學中,實驗探究是化學科學研究物質及其變化的重要方式,是學生研習化學科學的必備品質和關鍵能力.教師的課堂演示實驗對于培養學生的發現和提出實驗問題的能力;猜想與假設能力;實驗設計能力;控制實驗條件的能力;收集證據的能力;得出結論能力;反思與評價能力起著積極的作用.但由于一線教師做演示實驗的時候急于達成教學目標,缺少給學生思考和質疑的時間,使演示實驗失去了提升學生核心素養的重要功能,僅僅成為吸引學生興趣類似于“魔術”的淺層次的觀賞.筆者以乙烯與溴的四氯化碳溶液反應這一個演示實驗為例,通過教師對實驗裝置的改進,師生共同探究加成反應的本質,共同提升師生的化學核心素養.
乙烯與溴的四氯化碳溶液反應是高中課本中的重要的演示實驗,通過該反應來引導學生對加成反應的學習.但蘇教版《必修二》第63頁中活動與探究的演示實驗只說明了乙烯與溴的四氯化碳溶液發生了反應,于是學生提出疑問:1.用濃硫酸和乙醇反應制取的乙烯中有沒有雜質也會與溴的四氯化碳溶液反應?2.為什么乙烯與溴的四氯化碳溶液發生了加成反應而不是像甲烷與氯氣發生取代反應呢?針對學生的兩個問題,筆者對乙烯制取的方法進行了調整,對該反應是加成反應還是取代反應設計了實驗裝置加以驗證.
一、改變乙烯制取的方法
傳統的制取乙烯的方法是通過濃硫酸和乙醇在加熱到170℃來獲取,由于濃硫酸有脫水性和氧化性,濃硫酸能將乙醇氧化,生成CO2、CO和C等,而它本身還原成SO2.而這些氣體在加熱時會隨著乙烯一起出來,SO2也能與溴反應而使溴的四氯化碳溶液褪色,從而干擾了實驗.
用NaOH固體與藥品乙烯利溶液反應,反應得到的產物為乙烯、氯化鈉、磷酸鈉和水,最終獲取只含少量水蒸氣的乙烯.
二、合理設計實驗,探究反應的本質
乙烯使溴的四氯化碳溶液褪色,只能說明發生了反應,不能說明是發生了加成反應還是取代反應?乙烯與溴發生加成反應的產物是1,2-二溴乙烷,假設發生了取代反應那么反應的產物為乙烯的溴代物和溴化氫.那么如何來設計實驗驗證這個反應是加成反應而不是取代反應就成為一個難點.
筆者在相關文獻中找到了驗證乙烯與溴反應為加成反應的方法.其方法如下:在充滿乙烯的礦泉水瓶中倒入適量的溴的四氯化碳溶液,迅速塞好瓶塞,充分振蕩.現象:橙紅色褪去,礦泉水瓶瓶身凹陷.該實驗利用了乙烯與溴的四氯化碳溶液反應生成1,2-二溴乙烷,使原來充滿乙烯氣體的礦泉水瓶壓強減小而凹陷來說明是加成反應.如果是取代反應就有溴化氫氣體生成,就不會使礦泉水瓶內壓強減小而使礦泉水瓶凹陷.對此個人覺得有以下幾個問題:1.用排水法進行收集乙烯,礦泉水瓶會有水殘留,如果說發生的是取代反應,生成的溴化氫氣體極易溶于水也可能會引起礦泉水瓶內壓強減小而使礦泉水瓶凹陷.2.如果用排空氣法收集乙烯,就會導致礦泉水瓶內乙烯不純,具體里面量有多少也不清楚.3.溴的四氯化碳溶液配置中,溴的量無法控制,為了提高實驗的成功率,溴的量應少一些.4.實驗的成功率不是很高,受到礦泉水瓶乙烯的量的多少和溴的四氯化碳溶液中溴的量的多少兩個影響因素,有幾次實驗礦泉水瓶凹陷,但是溶液顏色褪色不明顯.
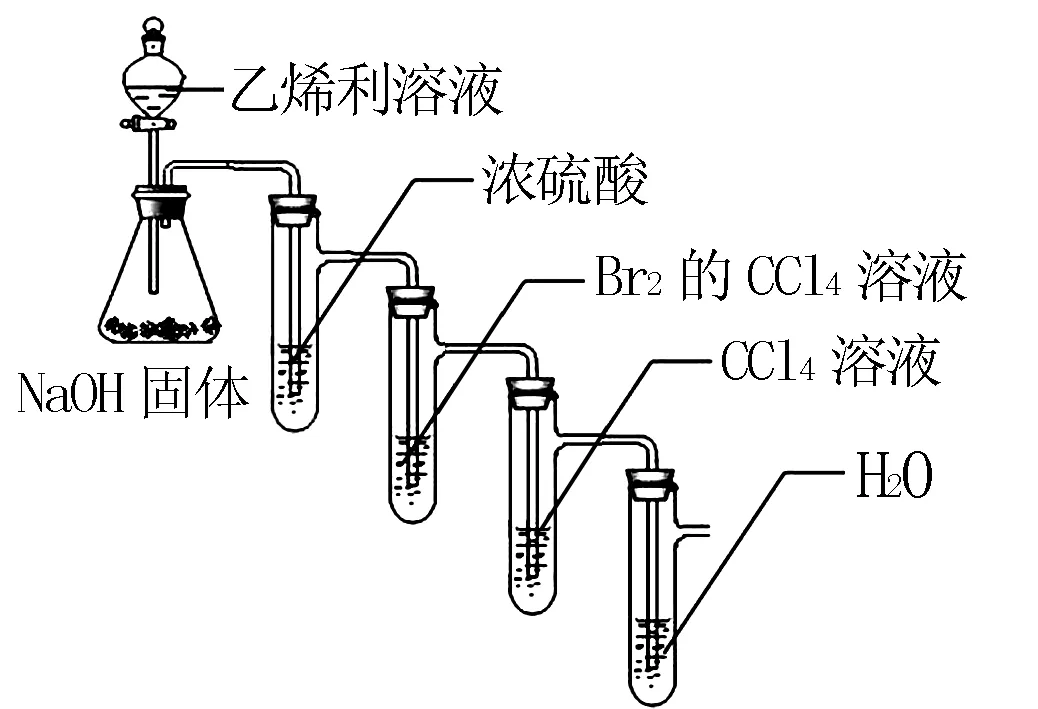
針對上述問題,筆者還是從加成反應和取代反應的最大區別是是否有溴化氫氣體生成入手,調整了思路,既然直接驗證溴化氫存在溴的干擾,那為什么不能換個角度去驗證溴化氫不存在,從而說明不是取代反應.于是筆者組裝了如圖所示的實驗裝置.
打開分液漏斗的旋塞,使乙烯利溶液滴到盛有NaOH固體的錐形瓶中,兩種物質快速反應獲得乙烯,乙烯氣體中會含有少量水蒸氣.將氣體通入盛有濃硫酸的具支試管中進行洗氣,除去水蒸氣,得到純凈的乙烯氣體.乙烯氣體能使溴的四氯化碳溶液褪色,說明乙烯能與溴發生反應.第三個盛有四氯化碳溶液的具支試管的作用是吸收少量可能從第二個具支試管中揮發出來的溴,防止對最后的結果進行干擾.筆者在課堂上等溴的四氯化碳溶液褪色后,取下最后一個試管,引導學生進行討論,假設有溴化氫氣體生成,利用溴化氫不溶于四氯化碳溶液的性質,那么最后的水溶液就會變成氫溴酸,可以用pH計測量溶液的pH或者取樣滴加硝酸銀溶液觀察有無沉淀的方法來判斷有無溴化氫,實驗結果可以證明無溴化氫,那么就可以證明沒有發生取代反應,發生的是加成反應.
通過如圖設計的實驗裝置,不僅保留了課本演示實驗中的使溴的四氯化碳溶液褪色的實驗現象,而且可以更好的說明該反應是加成反應而不是取代反應,有利于學生進一步掌握加成反應和取代反應的不同機理.
實驗探究和創新意識是化學核心素養的實踐基礎,是化學學科核心素養的核心內容.教師需要不斷學習,去借鑒和改進演示實驗,從而不斷的優化課堂演示實驗,并科學合理的設問,使演示演示真正成為激發學生的興趣,引導學生的思維,闡明化學反應的本質,提升學生化學核心素養的捷徑.

