連續性腎臟替代并聯體外膜肺氧合治療中抗凝技術的研究
盧劍海 林敬成 蘇用鵬 周柱江 劉長智 左六二(通訊作者)
(南方醫科大學順德醫院重癥醫學科 廣東 佛山 528300)
體外生命支持系統作為一種新的生命支持技術,部分替代衰竭器官,為搶救和治療急危重癥患者贏得時間和空間[1,2]。連續性腎臟替代治療(continuous renal replacement therapy,CRRT)部分替代腎臟功能;體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)部分替代心肺功能,兩者均是體外生命支持系統的重要組成部分[3]。將兩者有效并聯,不僅降低CRRT獨立置管帶來的風險,也為更高級、更復雜、多器官功能支持的生命支持技術發展奠定堅實的基礎[4]。在支持治療的過程中,由于血液與非生物成分物質接觸,在局部迅速產生凝血反應,同時機械擠壓力和剪切力加重凝血的反應[5],因而有效的抗凝成為兩者并聯運轉的重要前提。目前,國內外對于CRRT和ECMO各自抗凝要求均有明確的指導意見,而CRRT并聯ECMO后,其抗凝研究卻少有報道。本院近幾年來對此進行研究,現報告如下。
1.資料與方法
1.1 一般資料
2014年12月—2018年5月在南方醫科大學順德醫院重癥醫學科,納入需要同時行CRRT及ECMO治療的患者。納入標準:因難治性心源性休克、重度呼吸衰竭、難治性心跳驟停患者需要ECMO支持,同時合并急性腎功能衰竭,需要聯合CRRT。排除標準:(1)存在嚴重凝血功能障礙(ACT值大于230S)或存在抗凝禁忌;(2)對肝素過敏;(3)并發肝素誘導性血小板減少癥;(4)治療過程中并發嚴重出血或栓塞事件,需終止試驗;(5)ECMO支持時間小于24小時。
共納入40例,其中男性28例,女性12例,年齡12~81歲,急性心肌梗死14例,心臟驟停7例,急性暴發性心肌炎5例,急性肺栓塞3例,應激性心肌病3例,先天性心臟1例,急性呼吸窘迫綜合征7例。
本研究符合醫學倫理學標準,經院內倫理委員會批準,并獲得患者或家屬的知情同意。
1.2 CRRT與ECMO的連接
1.2.1 設備 CRRT使用貝朗公司的管道及濾器。ECMO使用Maquet公司的離心泵、氧合器、管道、導管及穿側附件,動脈導管為15~17Fr,靜脈導管為19~21Fr。
1.2.2血管通路的建立與連接 使用超聲引導下經皮穿刺或半切開直視下切開置管,動靜脈導管接入ECMO管道,實施V-A或V-V模式轉流。CRRT與ECMO的并聯方式為:CRRT引血端在ECMO回路的離心泵后、氧合器前,回血端在氧合器后。
1.3 抗凝管理
將入選病例隨機分成兩組,設定兩個不同的ACT目標值,A組180~200s,B組200~220s。采取普通肝素全身抗凝,從中心靜脈通道微量泵持續給予普通肝素。起始時肝素負荷劑量為25~100U/kg/h,定期監測ACT水平,抽血部位為CRRT管路靜脈端。在CRRT并聯ECMO前,以及并聯后前4小時每小時檢測ACT,根據ACT結果調整肝素劑量,肝素調整幅度為125~250u/次。ACT穩定后,每4小時檢測ACT。每次調整肝素1小時后復查ACT,直至ACT穩定。
1.4 數據的采集與統計學分析
收集納入患者一般資料,ECMO管道血栓開始形成時間(每小時觀察管道情況)、膜肺和CRRT管道的使用壽命(排除主動撤除CRRT的數據)、出現下肢血栓、出血并發癥情況,以探討CRRT并聯ECMO中的抗凝目標。計量參數用均數±標準差()表示。兩組間計量資料比較用t檢驗,兩組間計數資料比較用Fisher精確檢驗。P<0.05,差異有統計學意義。用STATA14.0軟件進行數據分析。
2.結果
2.1 兩組患者一般資料
A組患者19例,B組患者21例。B組有一例并發下肢及口鼻腔嚴重出血而終止研究。兩組間患者的ECMO運行模式、置管方式、ECMO支持時間、撤機成功率、生存出院率均未見統計學差異,見表1。

表1 兩組患者的一般資料
2.2 兩組間設備使用情況比較
A組的ECMO管道血栓形成時間較B組短(33.11±7.45h VS 46.67±12.30h,P<0.05),具有統計學差異。同樣,A組CRRT管道使用時間較B組短(24.13±10.09h VS 49.63±28.77h,P<0.05),具有統計學差異。兩組間均未因ECMO管道堵塞而更換ECMO管道,見表2。
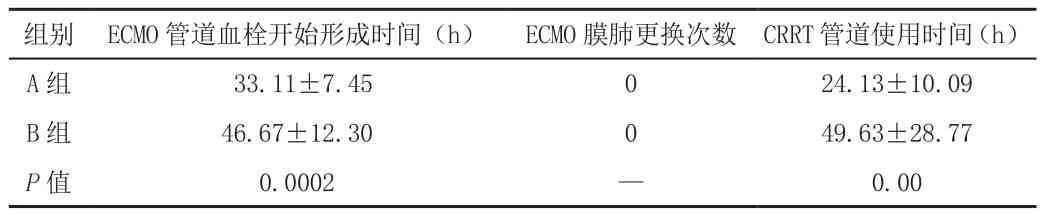
表2 兩組設備使用情況
2.3 兩組間患者并發癥比較
兩組均出現1例下肢血管栓塞。A組7例并發傷口出血,而B組10例傷口出血,兩組間差異無統計學意義,見表3。
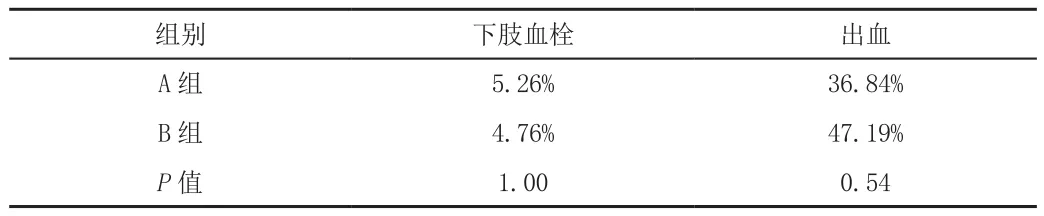
表3 兩組患者并發癥
3.討論
據報道,50%以上的ECMO患者合并急性腎功能衰竭[6],其中36~43%需要同時接受CRRT支持治療[7]。因此,將兩者能安全、有效的并聯在一起,具有重要意義。合并急性腎功能衰竭的接受ECMO支持患者,常合并容量超負荷,CRRT支持治療利用半透膜彌散與對流原理,不僅能為患者清除多余水分,強化容量管理,還可清除部分炎性介質。兩者聯合,快速優化血流動力學,穩定內環境狀態。在設備硬件方面,CRRT管道與ECMO接口可直接相連,具備并聯的條件。如把兩者并聯相接,將有利于減少CRRT獨立置管所增加的風險,如感染、出血、損傷組織、深靜脈血栓等。研究證明,當同一部位反復穿刺置管三次時,置管相關并發癥發生率將增加6倍[8]。Han等的薈萃分析顯示,CRRT與ECMO并聯支持治療安全、有效[9]。在兩者連接后,雖然在CRRT導管中紅細胞的擠壓力和剪切力將增加,溶血發生率輕度增加,游離血紅蛋白濃度上升,但是并不影響腎功能恢復和預后[10]。在連接方式上,與串聯相接比較,并聯有助于精確液體管理[11],同時降低護理工作量[12]。
ECMO與CRRT的抗凝要求各異。最新的國際體外生命組織操作指南(2014版)指出,ECMO患者使用普通肝素抗凝,使ACT維持在180~220s。根據《連續性腎臟替代治療標準操作規程(2010版)》指示,CRRT的抗凝目標為,ACT維持于治療前的1.5~2.5倍。然而,在兩者并聯后,對抗凝的安全性和有效性的相關研究,國內外均少有報道。
本研究顯示,CRRT與ECMO并聯支持治療,ACT目標維持于180~220秒,安全、有效。在設備方面,B組的ECMO導管血栓形成時間較A組長,而CRRT管道壽命也更長,具有統計學意義。可見,ACT維持于相對較高水平,能有效延長設備壽命。ECMO為密封的高流速系統,管道內壁均有肝素涂層,自身具有一定抗凝效果。一旦并發ECMO管道堵塞,對患者可能是災難性,危及生命。而CRRT為非肝素涂層管道,血流流速相對較慢,相比之下,抗凝要求可能較高。在兩組患者中,ECMO支持時間為38.92~443.17小時,雖然ECMO體外循環管道并發血栓形成,但均未影響膜肺功能及壽命,也未因管道堵塞而引起患者循環狀態波動。然而,對于CRRT管道壽命來說,ACT適當延長,更為有利。對于患者來說,ACT延長,可能增加出血風險。相反,ACT偏短,將可能增加下肢栓塞風險。從研究數據顯示,B組并發出血的發生率較A組高,但未見統計學差異,考慮與樣本量相對較少相關。另外,兩組并發一例下肢血栓形成,可能與抗凝不足以及多次穿刺,損傷血管有關,但并沒有造成嚴重下肢并發癥。本研究納入的樣本量相對較小,在后續的研究中需要擴大樣本量,以進一步明確不同抗凝目標的臨床意義。
綜上所述,CRRT與ECMO并聯支持治療患者,ACT在180~220秒間,ECMO均能順利進行。在權衡患者出血風險,適當延長ACT時間,有利于延長CRRT壽命。

