黃芩苷對肺癌細胞A549增殖、遷移能力及蛋白Cx43表達的影響
郭愛萍,黨 源 ,彭 軍
(1.福建中醫藥大學中西醫結合研究院,福建 福州 350122;2.南京軍區福州總醫院,福建 福州 350025)
黃芩苷是從植物黃芩的干燥根中提取的一種黃酮類化合物,化學式C21H18O11,分子量446.35,為一個帶有葡萄糖醛酸結構的黃酮衍生物,是黃芩主要的有效成分之一。它具有多種的藥理作用,包括抗菌、抗病毒、抗腫瘤、清除氧自由基抗氧化、抗血管增殖等[1-2]。本文通過研究黃芩苷對人肺癌細胞A549增殖、遷移的影響,探討黃芩苷是否通過調控Cx43蛋白來抑制A549細胞的作用及其可能的作用機制,為黃芩苷在腫瘤治療中的應用提供進一步實驗依據。
1 實驗材料
1.1 實驗細胞 人非小細胞肺癌A549細胞購自中國科學院細胞庫。
1.2 實驗試劑與儀器 黃芩苷(純度:99.1%,福州沃森生物技術有限公司);DMEM培養基、胰酶消化液(美國GIBCO公司);超級胎牛血清(四季青微生物材料工程公司);辣根過氧化酶標記的抗兔二抗、兔抗β-actin多克隆抗體(美國 Santa Cruz公司);兔抗Cx43多克隆抗體(美國Abcam公司);CKX41型倒置顯微鏡(日本Olympus公司);Powerwave XS型酶標儀(中國基因有限公司);ChemiDoc MP成像系統(Bio-Rad,Hercules,CA)。
2 實驗方法
2.1 黃芩苷溶液配制 采用二甲亞砜(DMSO)將黃芩苷配制成 100 mmol/L的貯存液,-20℃保存備用,臨用時以DMEM培養基稀釋。
2.2 細胞培養及干預 將A549細胞培養于含有10%FBS的高糖DMEM細胞培養液中,置于37℃、5%CO2的恒溫培養箱中常規培養傳代。實驗分組:對照組(0 μmol/L 組)、50 μmol/L 組、100 μmol/L組、200 μmol/L 組。
2.3 CCK8檢測細胞增殖 取96孔板,將生長對數期A549細胞按104個/孔濃度接種,每孔約100μL細胞懸液,每組設置6個復孔,邊緣孔用無菌PBS填充,輕輕搖晃細胞板使細胞均勻分散后置于37℃、5%CO2恒溫培養箱中培養;加藥組加入不同濃度的藥物,對照組均加入等體積溶劑,其中黃芩苷對照組加入與最高濃度組等量的二甲亞砜,分別培養24、48、72、96 h。 用酶標儀檢測在 450 m 處的吸光度A值,實驗重復3次。
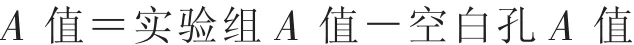
2.4 細胞劃痕損傷實驗 首先將實驗分組:對照組(0 μmol/L 組 )、50 μmol/L 組 、100 μmol/L 組 、200μmol/L組;用 marker筆在 6孔板背后,用直尺均勻地劃橫線,大約每隔0.5~1 cm一道,橫穿過孔,每孔至少穿過5條線。接種約5×105個/孔的上述不同分組的細胞,使細胞過夜后能鋪滿整孔。第2天用200μL格的槍頭比著直尺,盡量垂至于背后的橫線劃痕,槍頭要垂直,不能傾斜。用PBS洗細胞3次,去除劃下的細胞,加入含10%的胎牛血清的細胞培養基2 mL,置于37℃、5%CO2培養箱培養。分別于 0、24、48、72、96 h 觀察細胞遷移距離,拍照并測量其遷移距離。

2.5 Western blot法檢測Cx43蛋白表達 每單個組織樣本經PBS洗后,加入300μL RIPA緩沖液裂解30 min,17 000 r/min離心15 min后取上清作為蛋白提取物,進行BCA蛋白定量。取20μg蛋白樣品進行SDS-PAGE實驗。通過SDS-PAGE分離,并轉移到PVDF膜上。將含有分離出的蛋白質的膜用含5%BSA的TBST緩沖液(25 mM Tris,190 mM NaCl,0.05%Tween 20,pH 7.5)在室溫下封閉 2 h。隨后用所述的 Cx43 一抗(1∶1 000)和 β-actin(1∶2 000),4℃孵育過夜。TBST緩沖液洗膜3次,每次10 min。將膜用相應的結合辣根過氧化物酶(HRP)的二抗(1∶5 000)在室溫下孵育 1 h。TBST 緩沖液再次洗膜3次,每次10 min。采用增強的化學發光法檢測,并由ChemiDoc MP成像系統進行成像。靶蛋白的定量通過光密度分析,并用β-actin進行標準化。
2.6 統計學方法 采用SPSS 21.0統計軟件進行數據處理。計量資料符合正態分布以(±s)表示,采用t檢驗。
3 結 果
3.1 黃芩苷對肺癌細胞A549增殖能力的影響 見表1。
表1 黃芩苷對肺癌細胞A549增殖能力的影響(A值,±s)

表1 黃芩苷對肺癌細胞A549增殖能力的影響(A值,±s)
注:與對照組比較,1) P<0.01,2) P<0.05。
組別對照組50 μmol/L 組100 μmol/L 組200 μmol/L 組0 h 0.45±0.05 0.48±0.04 0.46±0.05 0.47±0.04 24 h 0.74±0.02 0.66±0.031)2)0.51±0.051)2)0.51±0.161)2)48 h 1.14±0.02 0.97±0.031)2)0.74±0.011)2)0.58±0.061)2)72 h 1.59±0.06 1.48±0.012)0.90±0.041)2)0.70±0.031)2)96 h 1.59±0.06 1.77±0.031)2)1.06±0.041)2)0.84±0.041)2)
3.2 黃芩苷對肺癌細胞A549遷移能力的影響見圖1、表2。

圖1 黃芩苷對A549細胞遷移能力的影響(×200)
表2 黃芩苷對肺癌細胞A549遷移能力的影響(n=6,±s) μm

表2 黃芩苷對肺癌細胞A549遷移能力的影響(n=6,±s) μm
注:與對照組比較,1) P<0.01,2) P<0.05。
組別對照組50 μmol/L 組100 μmol/L 組200 μmol/L 組0 h 0 0 0 0 24 h 2.88±0.24 2.33±0.232)1.59±0.181)0.86±0.121)48 h 5.24±0.16 4.26±0.111)3.37±0.081)2.18±0.171)72 h 5.31±0.29 4.69±0.142)4.28±0.151)3.06±0.441)96 h 6.00±0.22 5.40±0.172)4.71±0.171)4.19±0.181)
3.3 黃芩苷對肺癌細胞A549蛋白Cx43表達的影響 見圖 2、圖 3。
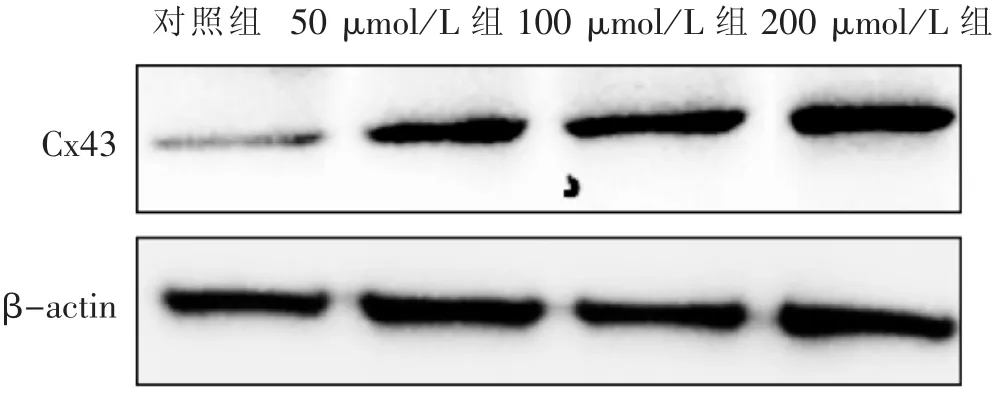
圖2 黃芩苷干預A549細胞Cx43蛋白表達電泳圖

圖3 黃芩苷對肺癌細胞A549蛋白Cx43表達的影響
4 討論
藥理學研究發現:黃芩具有抗腫瘤作用,包括誘導細胞凋亡、控制細胞周期、抗氧化、抗炎、誘導細胞分化、降低細胞的轉移和侵襲能力[3]。黃芩苷是黃芩主要的有效成分之一,近年來,隨著對黃芩苷抗腫瘤作用的深入研究,發現其還能抑制黏液表皮樣癌腫瘤細胞增殖,促進腫瘤細胞凋亡[4]。目前研究發現,對黃芩苷抗腫瘤作用的實驗研究主要集中在人前列腺癌、膀胱癌、肝細胞癌、乳腺癌、結腸癌、宮頸癌等惡性腫瘤[5-7]。但關于黃芩苷對肺癌細胞增殖、遷移、侵襲能力的作用的報道較少。本研究通過CKK-8法和細胞劃痕實驗證實:不同濃度的黃芩苷對肺癌細胞A549增殖和遷移能力具有顯著的抑制作用,且這種抑制呈現劑量依賴性。
為了探討黃芩苷對肺癌細胞A549抑制作用的機制,我們進一步檢測連接蛋白Cx43的表達水平。相關研究已證明:Cx43與腫瘤的生長呈負相關,并主要與Cx43調節細胞凋亡密切相關,Cx43可能是腫瘤的重要抑制因素[8]。Cx43蛋白在肺癌組織中表達下降,且表達下降程度與臨床病理參數相關,Cx43可通過細胞周期調節抑制細胞生長速度[9]。Cx43蛋白在正常組織中表達陽性率均比在原發性肺癌組織中表達陽性率高,在進展的非小細胞肺癌中陽性表達率下降,它的mRNA表達的水平與組織類型、臨床分期、腫瘤分化程度及淋巴結轉移情況密切相關[10]。
本研究顯示:肺癌細胞A549中連接蛋白Cx43的表達水平在黃芩苷作用后明顯上升,提示黃芩苷可通過上調連接蛋白Cx43表達來抑制腫瘤細胞的增殖和遷移能力。

