強直性脊柱炎患者血清TNF-α、RANKL、OPG和IL-34水平與附著點病變的相關性研究
黃嫻倩 陳勇 應銀燕 彭勇 干敏芝 耿保慶 朱夢雅 應穎
強直性脊柱炎(ankylosing spondylitis,AS)是一種病因及發病機制尚不明確的慢性炎性關節炎,以骶髂關節炎、附著點炎及脊柱融合為特征[1]。炎癥、骨破壞、新骨形成是AS發展過程中3個典型病理改變[2]。附著點炎是AS病理改變過程的特征性改變。近年有研究表明,在AS炎性骨破壞過程中,某些炎性細胞因子并非直接參與破骨細胞的分化和激活,而是通過調節TNF-α、細胞核因子-κB受體活化因子配體(RANKL)、骨保護素(OPG)等分子間接發揮作用[3-4]。新近研究表明IL-34也參與了破骨細胞的誘導和分化[5]。
近年來,肌肉骨骼超聲廣泛應用于患者肌腱、關節病變的評估。由于附著點部位表淺,同時高頻灰階超聲具有分辨率高的優點,操作者可觀察到附著點部位肌腱、軟骨及骨表面的細微改變。與MRI相比,肌肉骨骼超聲在觀察附著點肌腱結構、滑囊炎及骨侵蝕等方面同樣敏感,且超聲對疾病早期附著點鈣化的發現優于MRI[6-7]。目前超聲檢查聯合 TNF-α、RANKL、OPG 和IL-34血清學相關性分析的研究較少。本研究旨在通過檢測血清TNF-α、RANKL、OPG和 IL-34水平聯合超聲評估AS患者外周關節附著點病變,探討上述細胞因子與超聲評估附著點病變、實驗室指標和臨床指標的相關性,初步了解TNF-α、RANKL、OPG和 IL-34在AS患者骨破壞中的作用。
1 對象和方法
1.1 對象 選取2017年1月1日至2018年1月1日在本院風濕科住院或門診的AS患者21例作為AS組,所有患者均符合美國風濕病學會(ACR)1984年修訂的紐約AS診斷標準[8],Bath強直性脊柱炎病情活動指數(BASDAI)≥4分,患者3個月內均未進行生物制劑、關節內糖皮質激素及其他免疫抑制劑治療,并排除感染、腫瘤及其他自身免疫性疾病。其中男6例,女15例;年齡14~78(44.48±19.77)歲。選取同期在本院風濕科住院或門診的類風濕關節炎(rheumatoid arthritis,RA)患者21例作為RA組,所有患者均符合ACR 1987年修訂的RA分類標準[9],28個關節的疾病活動度評分(DAS28)≥2.6 分。其中男 3 例,女 18 例;年齡 31~72(47.62±9.17)歲。選取同期在本院體檢中心體檢的健康者41例作為健康對照組,其中男15例,女26例;年齡23~80歲(46.24±17.79)歲。3組性別和年齡比較差異均無統計學意義(均P>0.05)。本研究經醫院倫理委員會批準和患者知情同意。
1.2 血清TNF-α、RANKL、OPG和 IL-34水平檢測 收集所有研究對象清晨空腹靜脈血,以3 000r/min離心5min,取上清液分裝至試管后立即放入-80℃低溫冰箱保存備測。嚴格按照 TNF-α、RANKL、OPG和 IL-34 ELISA試劑盒(上海橋杜生物科技有限公司,201803,96T)說明書進行操作,采用ELISA法檢測血清TNF-α、RANKL、OPG和 IL-34水平。
1.3 超聲評估AS患者外周關節附著點病變情況 采用意大利百盛MyLabTMOne超聲診斷儀,線陣探頭,由一位經過肌肉骨骼超聲正規培訓的風濕科醫師進行超聲檢查。檢查部位參照臨床常見的外周附著點炎部位和格拉斯超聲附著點評分(GUESS)系統設定,包括跖底筋膜、跟腱止點、股四頭肌肌腱止點、股骨和脛骨內外髁肌腱附著點、髕韌帶起點和止點。檢查跖底筋膜及跟腱止點,要求患者俯臥位,雙足屈曲 90°懸空置床邊緣;檢查股四頭肌肌腱止點、股骨和脛骨內外髁肌腱附著點、髕韌帶起點和止點,要求患者仰臥位或坐位,膝關節屈曲30°、下肢伸展。對跖底筋膜、跟腱止點、股四頭肌肌腱止點、髕韌帶起點和止點采用GUESS進行判讀,股骨和脛骨內外髁韌帶附著點主要記錄附著部位骨侵蝕、骨贅、韌帶厚度改變、韌帶內鈣化情況。每個部位分別行縱向及橫向掃查。然后采用能量多普勒觀察所有受檢附著點處血流分布情況。
1.4 實驗室指標和臨床指標 收集患者ESR、C反應蛋白(CRP)等實驗室指標及BASDAI、Bath強直性脊柱炎功能指數(BASFI)、Bath強直性脊柱炎計量指數(BASMI)、Maastricht強直性脊柱炎附著點炎評分(MASES)、強直性脊柱炎疾病活動度評分(ASDAS)、夜間疼痛視覺模擬評分等臨床指標。
1.5 統計學處理 采用SPSS 17.0統計軟件。計量資料以表示,組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗;計數資料組間比較采用χ2檢驗;相關分析采用Spearman秩相關。采用ROC曲線分析RANKL和IL-34對AS的診斷效能。P<0.05為差異有統計學意義。
2 結果
2.1 3組血清 TNF-α、RANKL、OPG 和 IL-34水平比較 AS組患者血清TNF-α、RANKL和 IL-34水平均高于RA組患者及健康對照組,血清OPG均低于RA組患者及健康對照組,差異均有統計學意義(均P<0.05),見表 1。
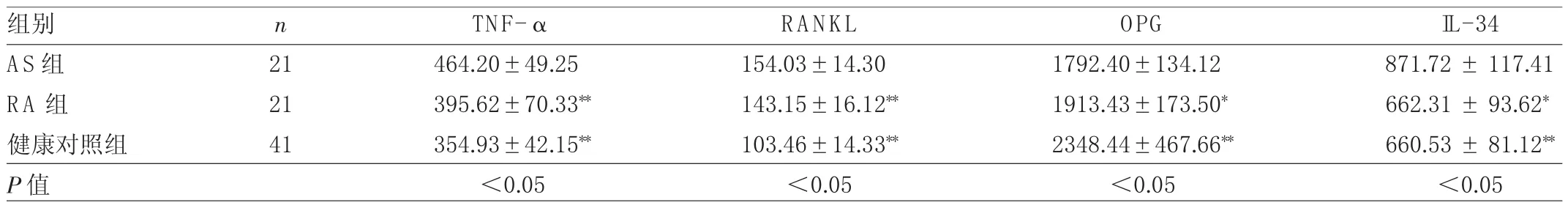
表1 3組血清TNF-α、RANKL、OPG和IL-34水平比較(pg/m l)
2.2 超聲檢查AS患者外周附著點病變情況 21例AS患者均發現肌腱端異常。GUESS評分中位數2(1~3)分,關節積液個數30個,骨侵蝕關節數29個,骨贅關節數15個,采集到能量多普勒信號關節個數1個,存在附著點炎關節數30個。
2.3 AS患者血清 TNF-α、RANKL、OPG 和 IL-34水平與超聲評估AS患者外周關節炎附著點病變指標相關性分析 AS患者血清RANKL和IL-34水平與超聲評估附著點骨侵蝕關節個數(r=0.564和0.482,均P<0.05)及附著點炎關節個數(r=0.634和0.545,均P<0.05)均呈正相關,與GUESS評分、關節積液個數、骨贅關節個數、采集到能量多普勒關節個數均無相關性(均P>0.05)。AS患者血清TNF-α和OPG水平與超聲評估附著點GUESS評分、關節積液個數、骨侵蝕關節個數、骨贅關節個數、采集到能量多普勒關節個數、附著點炎關節個數均無相關性(均P>0.05),見表2。
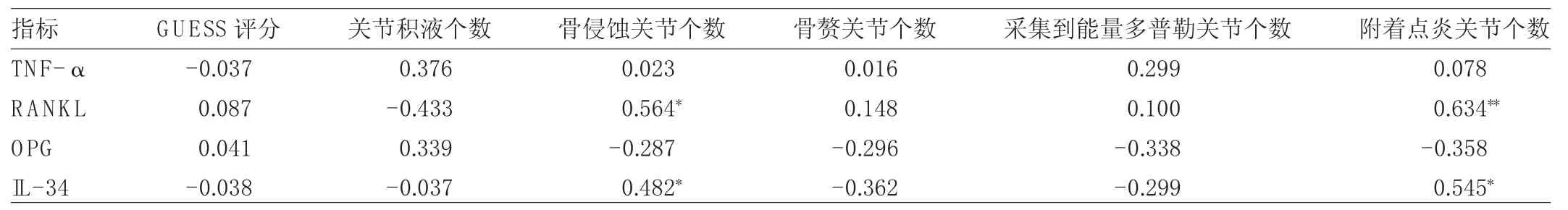
表2 AS患者血清TNF-α、RANKL、OPG和IL-34水平與超聲評估附著點病變的相關性(r值)
2.4 AS患者血清 TNF-α、RANKL、OPG 和 IL-34水平與實驗室指標及臨床指標相關性分析 AS患者血清IL-34水平與 BASDAI呈負相關(r=-0.454,P<0.05),而與 ESR、CRP、BASFI、BASMI、MASES、ASDAS、夜間疼痛視覺模擬評分均無相關性(均P>0.05)。AS患者血清 TNF-α、RANKL 和 OPG 水平與 ESR、CRP、BASDAI、BASFI、BASMI、MASES、ASDAS、夜間疼痛視覺模擬評分均無相關性(均P>0.05),見表3。
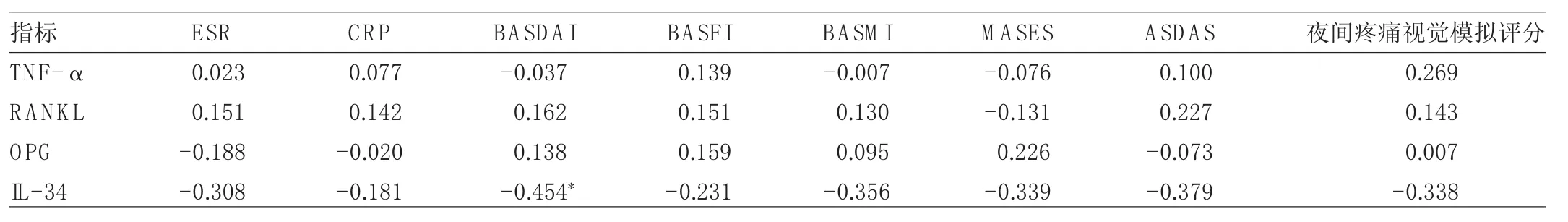
表3 AS患者血清TNF-α、RANKL、OPG和IL-34水平與實驗室指標及臨床指標的相關性(r值)
2.5 AS患者血清 TNF-α、RANKL、OPG 和 IL-34水平之間相關性分析 血清RANKL水平與血清OPG水平呈負相關(r=-0.461,P<0.05),而兩者與血清 TNF-α、IL-34水平及血清TNF-α水平與血清IL-34水平均無相關性(均P>0.05),見表 4。
2.6 ROC曲線分析 ROC曲線顯示血清RANKL和IL-34水平對診斷AS有較高的準確性,AUC分別為0.994和0.941,均P<0.05。當血清RANKL水平≥125.85pg/ml,靈敏度為0.95,特異度為0.95;當血清IL-34水平≥728.15pg/ml,靈敏度為0.95,特異度為0.73,見圖1。
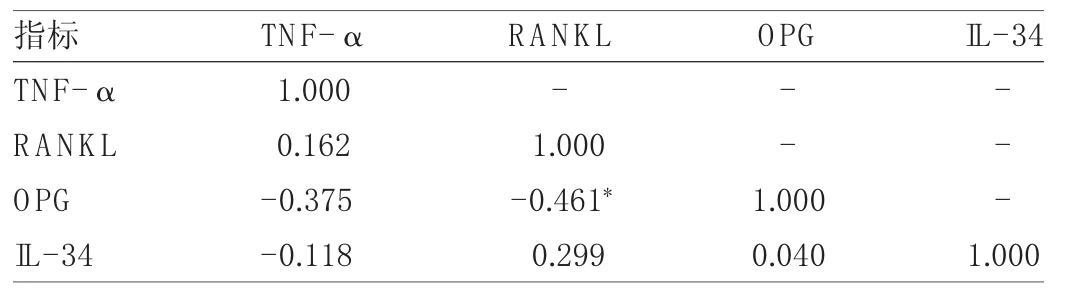
表4 AS患者血清TNF-α、RANKL、OPG和IL-34水平之間的相關性(r值)
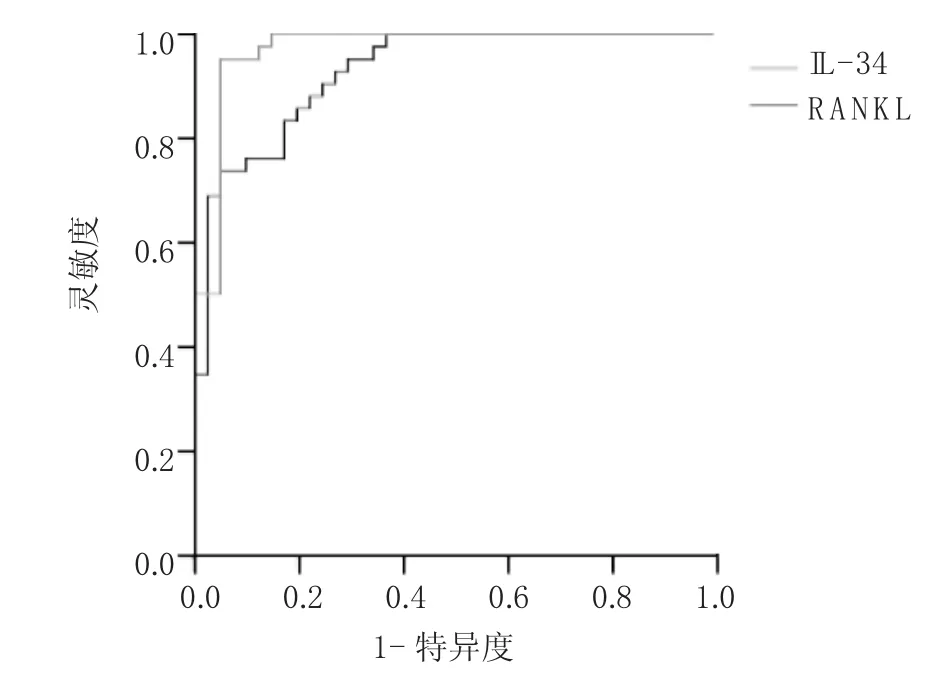
圖1 血清RANKL和IL-34水平診斷AS的ROC曲線
3 討論
AS是一種可嚴重影響骨平衡過程的炎癥性關節疾病。在AS早期,患者主要表現為炎性骨破壞,但隨著疾病進展,患者可同時出現炎性骨破壞和異位骨形成。近年來,研究發現多種細胞因子在AS骨破壞的發生、發展中發揮關鍵作用。
TNF-α是炎癥過程中最早產生的細胞因子之一,研究發現其參與AS骨破壞過程。本研究中AS組患者血清TNF-α高于RA組患者及健康對照組,其血清水平與 ESR、CRP、BASDAI、BASFI、BASMI、MASES、ASDAS、夜間疼痛視覺模擬評分均無相關性,與Gratacos等[10]報道一致。其血清水平與超聲評估附著點GUESS評分、關節積液個數、骨侵蝕關節個數、骨贅關節個數、采集到能量多普勒關節個數、附著點炎關節個數均無相關性,提示其水平高低可能不能直接反映AS患者外周附著點病變的情況。
RANKL、OPG為調節破骨細胞活性所必需,是造成炎性關節骨質破壞最重要的影響因素。在RA患者和RA動物模型中,許多證據表明RANKL/細胞核因子-κB受體活化因子(RANK)/OPG系統參與了局部的骨質侵蝕。研究發現AS滑膜中活化的T細胞及滑膜成纖維細胞能夠產生RANKL,并與局部的骨質侵蝕有關[11]。Mori等[12]在Ⅱ型膠原誘導關節炎小鼠的局部關節通過原位雜交方法檢測RANKL、RANK及OPG的表達,也得到了類似的結論。本研究中AS組患者血清RANKL水平高于RA組患者及健康對照組,其水平與超聲評估附著點病變骨侵蝕關節個數及附著點炎關節個數均呈正相關,同時ROC曲線顯示其AUC為0.994,進一步驗證了上述理論,當血清RANKL水平≥125.85pg/ml,靈敏度為0.95,特異度為0.95;這些提示血清RANKL水平升高可能可以作為反映AS患者存在附著點病變尤其是存在骨侵蝕的有用指標。另外本研究中AS患者血清OPG水平低于RA組患者及健康對照組,而血清水平與超聲評估附著點GUESS評分、關節積液個數、骨侵蝕關節個數、存在骨贅關節個數、采集到能量多普勒關節個數、附著點炎關節個數均無相關性,提示其水平高低可能不能直接反映AS患者外周附著點病變的情況。而血清 RANKL 和 OPG 水平與 ESR、CRP、BASDAI、BASFI、BASMI、MASES、ASDAS、夜間疼痛視覺模擬評分均無相關性義,提示兩者血清水平高低可能不能反映AS疾病的活動。
IL-34發現于2008年,屬于IL家族,其功能類似于巨噬細胞集落刺激因子(M-CSF),IL-34可與M-CSF受體結合,是破骨細胞主要的功能性細胞因子,與破骨細胞的活化增殖密切相關。研究表明IL-34參與破骨細胞的誘導和分化,具體表現為在RANKL存在的情況下,IL-34可誘導破骨前體細胞的體外增殖和黏附;同時,IL-34能發揮促炎作用,進一步導致RA的骨破壞[13]。本研究中AS患者組血清IL-34水平高于RA組患者及健康對照組,其水平與超聲評估附著點病變骨侵蝕關節個數及附著點炎關節個數均呈正相關,同時ROC曲線顯示其AUC為0.941,當血清IL-34水平≥728.15pg/ml,靈敏度為0.95,特異度為0.73,提示血清IL-34水平可作為預測AS患者存在骨侵蝕的可靠指標。其血清水平與 ESR、CRP、BASFI、BASMI、MASES、ASDAS、夜間疼痛視覺模擬評分均無相關性,雖然其與BASDAI呈負相關,但因BASDAI主觀因素較多,因此筆者仍認為其水平高低可能不能直接反映AS疾病的活動。鄔秀娣等[14]研究發現AS患者血清IL-34水平明顯升高,與本研究結果一致;他們的研究還發現血清IL-34水平與ESR、CRP均呈正相關,但本研究樣本量較小,該結論需進一步擴大樣本量來證實。本研究對AS患者血清TNF-α、RANKL、OPG和IL-34水平之間的相關性進行分析,發現血清RANKL水平與OPG水平呈負相關,而兩者與TNF-α、IL-34水平及血清TNF-α水平與IL-34水平均無相關性,提示RANKL、OPG與TNF-α、IL-34在AS骨質破壞的病理過程中可能各自獨立發揮作用。筆者推測IL-34可能直接參與了AS患者破骨細胞的增殖和分化,其可能存在獨立于TNF-α的骨破壞機制,同時IL-34能在附著點部位發揮促炎作用,進而促進AS骨侵蝕的發生,尤其在局部的骨質侵蝕中發揮重要作用。
綜上所述,AS患者血清中存在較高水平的IL-34和RANKL,兩者血清水平可能可以作為反映AS患者存在附著點病變的有用指標,尤其是預測AS患者骨侵蝕的可靠指標,推測IL-34與RANKL參與了AS骨破壞的過程,是AS發生骨破壞病理改變過程中的重要因子,且兩者在AS骨質破壞的病理過程中可能存在獨立的骨破壞機制,進一步研究IL-34在AS骨破壞中的具體機制,可為AS治療提供新靶點。抑制IL-34有望成為TNF-α抑制劑治療無效的AS患者的新選擇。

