腹腔鏡脾切除治療脾亢術后并發門靜脈系統血栓形成危險因素分析
尉 鵬,夏清華,唐學虎,朱黎明
(1. 湖北省丹江口市第一人民醫院,湖北 丹江口 442700;2. 華中科技大學同濟醫學院附屬協和醫院,湖北 武漢 430000)
肝硬化門靜脈高壓癥為消化系統的常見病和多發病,隨病情進展可出現脾功能亢進(脾亢)、脾腫大以及消化道出血等并發癥,是引起患者死亡的主要原因[1]。對于肝硬化門脈高壓繼發脾腫大伴脾亢,肝臟移植手術為根治性治療方案,但由于醫療費用較高以及肝源有限等原因,僅少數患者可得到肝移植治療,大多數患者仍然需要行脾切除術治療。早期肝硬化門脈高壓癥為腹腔鏡下脾切除術的禁忌證,近年來隨著腔鏡器械發展及手術技巧不斷進步,腹腔鏡下脾切除術取得突破性進展,在肝硬化門脈高壓繼發脾亢治療中得到了廣泛應用[2]。門靜脈系統血栓形成(PVST)為肝硬化門脈高壓繼發脾亢患者腹腔鏡脾切除術后常見并發癥,導致患者肝功能受損,部分嚴重患者可出現腸壞死、肝衰竭等,危及患者生命安全[3-4]。本研究通過回顧近年來收治的行腹腔鏡脾切除治療的門脈高壓繼發脾亢患者的臨床資料,分析其術后并發PVST的危險因素。現報道如下。
1 臨床資料
1.1一般資料 采取回顧性分析的方法,收集丹江口市第一人民醫院2014年8月—2017年8月收治的行腹腔鏡脾切除治療的門脈高壓繼發脾亢患者72例,均經肝穿刺活檢、影像學檢查、血液學檢驗以及臨床表現確診,肝硬化門脈高壓癥均符合《病毒性肝炎防治方案》中的相關診斷標準[5];無手術治療禁忌證;B超檢查顯示存在脾腫大,直徑為15~30 cm;無消化道出血史;靜脈曲張程度為重度曲張;肝功能Child-Pugh分級為A級或者B級。排除標準:①合并惡性腫瘤者;②心、腎等重要臟器功能或者凝血功能嚴重障礙者;③伴有全身性感染者;④腹部手術史者;⑤肝功能Child-Pugh分級為C級者;⑥病例資料不全者;⑦手術失敗者。72例患者中,男44例,女28例;年齡33~78(53.08±7.29)歲;肝功能Child-Pugh分級A級41例,B級31例;發病原因為病毒性肝硬化51例,酒精性肝硬化14例,其他7例。
1.2方法 所有患者行腹腔鏡脾切除術,術后給予常規抗凝治療。患者術前均給予MRI、彩色多普勒超聲等影像學檢查,均證實無血栓形成;術后1周通過MRI、CT以及彩色多普勒超聲等影像學檢查,明確有無PVST以及發生部位。詳細記錄所有患者的臨床資料,包括肝硬化病因、性別、年齡、肝功能Child-Pugh分級、體質量指數、血小板計數、手術時間、術中出血量等,于手術前后通過彩色多普勒超聲測定門靜脈直徑、門靜脈流速、門靜脈壓力,并計算門靜脈流速差值及門靜脈壓力差值,測定患者術后1 d凝血酶原時間以及白蛋白、總膽紅素、D-二聚體水平。根據術后有無PVST分為PVST組和無PVST組。對2組上述臨床資料進行統計學分析。
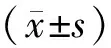
2 結 果
2.12組一般資料比較 PVST組29例,無PVST組43例,PVST組術后D-二聚體、術前門靜脈直徑以及手術前后門靜脈流速差值均明顯高于無PVST組(P均<0.05);2組患者性別、年齡、體質量指數、肝功能Child-Pugh分級、病因、血小板計數、手術時間、術中出血量以及術前凝血原酶時間、白蛋白水平等指標比較差異均無統計學意義(P均>0.05)。見表1。
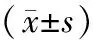
表1 2組一般資料比較
注:1 cmH2O=0.098 kPa。
2.2肝硬化門脈高壓繼發脾亢患者腹腔鏡脾切除術后并發PVST的多因素Logistic回歸分析 將PVST作為因變量,將一般資料比較中有差異指標作為自變量,納入多因素Logistic回歸分析模型進行多因素分析,結果顯示,D-二聚體水平、門靜脈直徑以及手術前后門靜脈血流速度差值為門脈高壓繼發脾亢患者腹腔鏡脾切除術后并發PVST的危險因素(P均<0.05)。見表2。

表2 術后并發PVST的多因素Logistic回歸分析
2.3ROC曲線對術后并發PVST的預測價值 通過ROC曲線對術后并發PVST的預測價值進行分析,確定各危險因素的臨界值,并計算敏感度與特異度,結果顯示,手術前后門靜脈血流速度差值、D-二聚體水平、門靜脈直徑的臨界值分別為4.06 cm/s、12.96 mg/L和12.89 mm,ROC曲線下面積(AUC)分別為0.768,0.706和0.742。見表3。

表3 ROC曲線對術后并發PVST的預測價值
3 討 論
脾切除術是治療門脈高壓繼發脾亢的主要術式,既能夠糾正脾亢,還可以降低門靜脈壓。近幾年,隨著我國腹腔鏡技術以及腹腔鏡器械的發展,完全腹腔鏡下脾切除在臨床中的應用越來越多。相較于傳統開腹術式,完全腹腔鏡術式減少了術中出血及術后并發癥的發生,并縮短了住院時間,有利于患者盡快康復。PVST是門脈高壓繼發脾亢患者脾切除術后常見的一種并發癥,雖然給予常規抗凝治療,但發生率依然較高[5-6]。有文獻報道,腹腔鏡脾切術后PVST發生率要明顯高于開腹術式[7]。其原因可能為:建立二氧化碳氣腹可能會造成機體處于高凝狀態;在使用超聲刀或者Ligasure離斷組織時,其高頻振蕩或者熱能對血管內皮造成一定影響,誘發PVST發生;線型切割閉合器將脾蒂離斷[8-9]。
肝硬化門脈高壓繼發脾亢患者體內存在著原發性凝血活化,且纖溶蛋白抑制劑的合成與釋放減少,而且在肝硬化失代償期患者多伴有門靜脈系統血管炎癥以及血管內皮損傷,因而門靜脈系統成為血栓多發部位[10]。相關研究指出,肝硬化門靜脈高壓脾亢患者脾切除術后血小板數計數、血漿黏度、全血黏度以及紅細胞聚集指數較術前有所升高,而且持續時間較長,這些變化均能夠促進患者術后PVST的形成[11-12]。何念軍[13]發現,有無PVST患者的血小板計數并無統計學差異,本研究結果與之一致。因此,PVST形成可能與血小板數量增加無明顯關系,可能和患者術后血小板功能異常相關。
D-二聚體是交聯纖維蛋白經纖溶酶作用后所形成的終末產物的一種,在臨床中主要是用于對機體高凝狀態或者纖溶亢進進行評估的標志物。國內研究指出,門脈高壓患者經脾切除術治療后,并發門靜脈血栓形成患者的血清D-二聚體水平明顯高于無門靜脈血栓形成者,在早期預測門靜脈血栓形成中具有一定臨床價值[14]。本研究中,PVST組術后D-二聚體水平明顯高于無PVST組,且經多因素Logistic回歸分析顯示,D-二聚體水平為門脈高壓繼發脾亢患者腹腔鏡脾切除術后并發PVST的主要危險因素。這與李大偉[15]的研究結果相近。進一步分析發現,當患者術后1 d血清D-二聚體為12.96 mg/L時對PVST具有較好的預測價值,當血清D-二聚體>12.96 mg/L時,PVST發生風險明顯增加。
門靜脈直徑往往被認為是反映機體門靜脈壓力高低的一個重要指標,當門靜脈直徑越大時,門靜脈壓力則越高,而隨著門靜脈直徑增加,患者機體血流動力學會出現明顯改變,主要是血流速度減慢,導致血液瘀滯,因而增加了血栓形成風險[16]。文獻報道,門靜脈直徑越大,門脈高壓繼發脾亢患者脾切除術后越易形成門靜脈血栓[17-18]。本研究結果與上述研究相近,PVST組術前門靜脈直徑明顯大于無PVST組,而且流速減緩程度更加顯著,門靜脈直徑以及手術前后門靜脈血流速度差值為門脈高壓繼發脾亢患者腹腔鏡脾切除術后并發PVST的重要危險因素。ROC曲線分析結果顯示,手術前后門靜脈血流速度差值、門靜脈直徑分別為4.06 cm/s、12.89 mm時對PVST具有較好的預測價值,即手術前后門靜脈血流速度差值>4.06 cm/s或者門靜脈直徑>12.89 mm時患者術后更容易并發PVST。因此,術后D-二聚體水平、術前門靜脈直徑以及手術前后門靜脈血流速度差值對PVST早期預測具有一定臨床應用價值,在臨床中應當根據患者上述危險因素給予針對性、個性化的處理,以減少PVST的發生。
綜上所述,D-二聚體、門靜脈直徑以及手術前后門靜脈血流速度差值為門脈高壓繼發脾亢患者腹腔鏡脾切除術后并發PVST的危險因素。不過本研究為回顧性研究,且樣本量較少,在隨后的研究中需要擴大樣本量以進一步證實。

