TW37對食管癌TE-1細胞遷移的影響
秦甜甜,張雪燕,李蕾蕾,霍峻鋒,石曉麗,王希雅,葉小萍,楊程宇,王 淙
鄭州大學藥物研究院 鄭州 450001
食管癌是常見的消化道惡性腫瘤,在世界上最常見的惡性腫瘤中居第8位[1]。食管癌的發病具有明顯的地區差異性,如我國在河南等地高發[2]。發生侵襲轉移是食管癌患者病情惡化或死亡的原因,亦是困擾臨床醫生的一大難題[3]。因此,開發抑制食管癌轉移的藥物對于食管癌的防治具有重要意義。TW37屬于基于結構設計開發的一類新型靶向藥物。TW37與Bcl-2同源結構域3結合溝相結合,并與促凋亡蛋白(如Bid、Bim和Bad)競爭,阻止它們與Bcl-2的異源二聚化[4]。研究[5-7]表明,TW37具有促進細胞凋亡、抗腫瘤血管生成、抗遷移等作用。本研究觀察了TW37對食管癌TE-1細胞遷移的影響,并探討其可能機制,為食管癌的治療和藥物開發提供新的思路。
1 材料與方法
1.1細胞和主要試劑食管癌細胞株TE-1由鄭州大學藥物研究院保存,TW37購于美國MCE公司。細胞培養基RPMI 1640、標準胎牛血清(以色列BI公司),胰蛋白酶消化液和BCA定量試劑盒(北京索萊寶公司),Vimentin、E-Cadherin以及N-Cadherin一抗(美國CST公司),β-actin和二抗(南京恩京生物公司),ECL發光液(美國Therom公司)。
1.2細胞培養TE-1細胞用含體積分數10%胎牛血清的RPMI 1640培養基,在CO2恒溫加濕培養箱中培養(37 ℃,體積分數5%CO2)。2~3 d傳代一次,每2 d更換培養基一次,收集對數生長期的細胞用于后續實驗。
1.3細胞增殖能力檢測收集TE-1細胞,以4×103個/孔接種于96孔板,放入培養箱中培養過夜。待細胞貼壁后,加入200 μL含TW37的培養基,設置9個濃度梯度,分別為0.25、0.50、1.00、2.00、4.00、8.00、16.00、32.00和64.00 μmol/L,每個濃度設3個復孔,并設置陰性對照。24、48、72 h后,每孔加入20 μL MTT(5 g/L),在37 ℃、體積分數5%CO2培養箱中繼續孵育4 h,棄去培養基,每孔加入150 μL DMSO,置于搖床上使其充分溶解混勻,在酶標儀上測定570 nm處吸光度(A)值。細胞活力=實驗孔A值/對照孔A值×100%。計算24、48、72 h的半數抑制濃度(IC50)。
1.4細胞形態學變化觀察收集TE-1細胞,以5×105個/孔接種于6孔板,于培養箱中孵育過夜。次日分別加入濃度為0、2、4 μmol/L的TW37,24 h后收集細胞,在倒置顯微鏡下拍照,記錄細胞形態的變化。
1.5細胞遷移能力檢測收集TE-1細胞,以3×105個/孔接種于6孔板,于培養箱中孵育過夜。待細胞達到80%的匯合度時,用200 μL的槍頭在中間區域劃痕,棄去培養基并用PBS洗去劃掉的細胞,于倒置顯微鏡下拍照。配制TW37濃度為0(對照)、2、4 μmol/L的培養基加入細胞中,繼續培養24或48 h,拍照記錄細胞遷移情況。細胞遷移率=(0 h劃痕寬度-24/48 h劃痕寬度)/0 h劃痕寬度×100%。實驗重復3次。
1.6上皮間質轉化(epithelial-mesenchymaltransition,EMT)相關蛋白表達的檢測收集TE-1細胞,分別用0(對照)、2、4 μmol/L的TW37處理24 h,使用胰蛋白酶消化后,收集細胞,用PBS清洗2遍,加入適量裂解液于冰上裂解30 min,低溫高速離心機收集上清液,BCA試劑盒進行蛋白定量。將蛋白樣品中加入6×Loading buffer,100 ℃變性10 min。通過SDS-PAGE分離蛋白并轉移至硝酸纖維素膜。用TBST(含Tween 20的Tris緩沖鹽,pH 7.8)配制50 g/L脫脂牛奶溶液,在室溫下封閉2 h后,加一抗(Vimentin抗體按1∶800稀釋,E-Cadherin、N-Cadherin抗體均按1∶500稀釋),4 ℃孵育過夜。洗膜后室溫下加二抗(按1∶5 000)繼續孵育2 h。ECL發光液孵育NC膜,暗室曝光。用Image J軟件分析條帶灰度值,以目的蛋白和β-actin灰度值的比值為目的蛋白的相對表達水平。實驗重復3次。
1.7統計學處理使用SPSS 17.0處理數據。采用2×3析因設計的方差分析比較不同濃度的TW37作用24、48 h對TE-1細胞遷移率的影響,采用單因素方差分析比較不同濃度的TW37對TE-1細胞EMT相關蛋白表達水平的影響,兩兩比較采用SNK-q檢驗,檢驗水準α=0.05。
2 結果
2.1TW37對TE-1細胞活力的影響TW37對TE-1細胞活力有明顯的抑制作用,隨TW37作用濃度和時間的增加,TE-1細胞活力呈降低的趨勢(圖1)。作用24、48、72 h,TW37對TE-1的IC50分別為(9.77±0.99)、(3.47±0.54)和(2.03±0.31) μmol/L。

圖1 TW37對TE-1細胞活力的影響
2.2TW37對TE-1細胞形態的影響2、4 μmol/L TW37作用24 h后,食管癌TE-1細胞由梭形變成了卵圓形,并出現了偽足;4 μmol/L TW37處理的TE-1細胞變形更加顯著(圖2)。

A、B、C:分別為0、2、4 μmol/L TW37組
2.3TW37對TE-1細胞遷移能力的影響2、4 μmol/L的TW37作用于TE-1細胞24 h及48 h后,細胞遷移受抑,4 μmol/L TW37抑制作用更強。結果見表1。
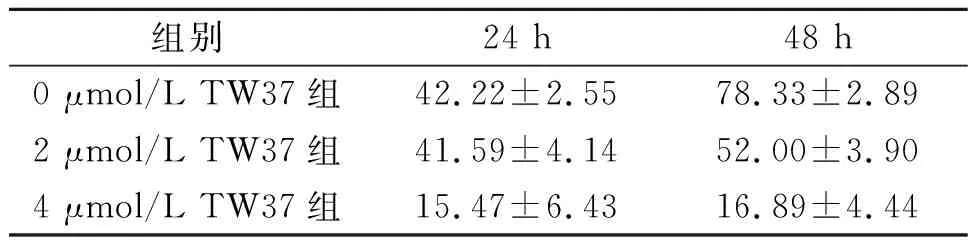
表1 TW37對TE-1細胞遷移率的影響(n=3) %
F濃度=170.260,F時間=63.900,F交互=26.980,P均<0.001
2.4TW37對TE-1細胞EMT相關蛋白表達的影響2、4 μmol/L的TW37作用于TE-1細胞24 h后,間質分子Vimentin的表達量下降,N-Cadherin表達下調,上皮分子E-Cadherin的表達上調,見圖3、表2。

1、2、3:分別為0、2、4 μmol/L TW37組

表2 TW37對TE-1細胞EMT相關蛋白表達的影響(n=3) %
*:與0 μmol/L TW37組比較,P<0.05;#:與2 μmol/L TW37組比較,P<0.05
3 討論
TW37是Bcl-2家族的新型非肽抑制劑,對多種腫瘤均具有抑制作用[8-10]。文獻[8]報道,TW37能誘導結直腸癌細胞中的Caspase-3/9激活并誘導細胞凋亡,且能抑制裸鼠HCT-116細胞移植瘤的生長;TW37單用或與順鉑聯用均能夠抑制多種卵巢癌細胞的增殖并誘導其凋亡[9];TW37通過誘導細胞凋亡、下調NF-κB下游基因(如MMP-9和VEGF),從而抑制胰腺癌細胞體外遷移[10]。因此,我們考慮用Bcl-2的抑制劑TW37來抑制食管癌TE-1的遷移,為臨床治療食管癌提供新的策略。結果表明,TW37可以抑制TE-1細胞遷移。
腫瘤細胞侵襲轉移能力的變化常常伴隨著EMT過程的發生[11-12]。EMT是指具有極性的上皮細胞轉換成具有活動能力、能在細胞基質間自由移動的間質細胞的過程。其標志是上皮樣細胞極性的喪失及間質樣細胞特性的獲得,即典型的上皮樣細胞標志物(如E-Cadherin等)表達減少,間質樣細胞分子標志物(如N-Cadherin)增加[13]。這種表型的轉換使腫瘤細胞擺脫細胞間連接,使沒有侵襲性的腫瘤細胞獲得侵襲能力,促進腫瘤局部浸潤和遠端轉移[14]。
近年來的研究[15-16]表明,抑制細胞程序性死亡的原癌基因Bcl-2也參與EMT過程。An等[15]發現,將Bcl-2表達載體轉染到人乳腺上皮細胞MCF10ATG3B后,上皮細胞的標志物E-Cadherin下調,間質標志物E-Cadherin和Vimentin上調,細胞遷移和侵入增加。Bcl-2在鱗狀細胞癌細胞中的過度表達通過N-Cadherin/成纖維細胞生長因子受體/細胞外信號調節激酶途徑促進癌細胞存活,且誘導了EMT過程[16]。本研究的實驗結果顯示,Bcl-2抑制劑TW37可以抑制TE-1細胞遷移,并能使TE-1細胞的形態由梭形(活動能力強)變成了緊密連接的卵圓形(活動能力弱);Western blot實驗結果顯示,TW37下調間質分子Vimentin、N-Cadherin的表達,上調上皮分子E-Cadherin的表達,提示TW37可能通過抑制EMT進程進而抑制細胞遷移。
綜上所述,TW37可抑制食管癌TE-1細胞遷移,其機制可能與抑制TE-1細胞的EMT進程有關,這為臨床治療食管癌提供了新的策略。

