多發性骨髓瘤患者Treg細胞、Th17細胞及相關轉錄因子mRNA的表達及臨床意義
鄒 健, 孫麗華, 范小紅, 孟亞紅, 王雪蓮, 化范例, 程韻楓
復旦大學附屬中山醫院青浦分院血液科,上海 201700
多發性骨髓瘤(multiple myeloma, MM)是一種惡性漿細胞病,多見于中老年人群。近年來,隨著人口老齡化,每年新增病例呈逐年上升趨勢[1]。MM患者存在免疫系統的多種缺陷,且患者的免疫功能缺陷是該病的一個重要特征并影響其疾病進展。MM患者T細胞的數量和功能都存在異常[2]。較早期的研究[3-4]已顯示,MM患者CD4/CD8細胞比值降低,與疾病進展相關。
調節性T細胞(Treg)和輔助性T細胞(Thl7)是重要CD4+T細胞亞群,在多種疾病中發揮重要作用[5]。其中,Treg細胞可抑制抗腫瘤的免疫反應,特異性的轉錄因子為Foxp3;Th17細胞在腫瘤免疫中的作用仍有爭議[2,6],特異性轉錄因子為維甲酸相關孤兒核受體γt (retinoic acid-related orphan receptor γt,RORγt )。這兩種細胞在分化發育中相互制衡,兩者平衡在維持免疫穩定及抗腫瘤免疫中發揮重要的作用。本研究通過檢測MM患者不同時期外周血及骨髓中Treg細胞和Thl7細胞的比例及其特異性轉錄因子mRNA的表達水平,分析Treg細胞、Thl7細胞在MM各期的變化,及其與C反應蛋白(CRP)、白細胞介素-6(IL-6)的關系,進而進一步分析Treg、Th17平衡在MM發展中的作用。
1 資料與方法
1.1 一般資料 選取本院2015年6月至2017年11月收治的MM患者46例,診斷均符合2011年中華醫學會制定的《中國多發性骨髓瘤診治指南》[7]中的標準。46例患者中,男性26例、女性20例,年齡45~78歲,中位年齡59歲。初發20例、平臺期16例、復發10例;ISS分期Ⅰ期10例、Ⅱ期16例、Ⅲ期20例;免疫分型IgG型23例、IgA型11 例、輕鏈型7例、其他5例。本研究經醫院倫理委員會審核批準,患者知情同意并簽署知情同意書。
按照《中國多發性骨髓瘤診治指南》[7],20例初發患者接受硼替佐米為基礎的化療方案;10例復發患者中,復發前接受硼替佐米(n=8)或沙利度胺(n=2)為基礎的方案,復發后接受硼替佐米(n=7)或來那度胺為基礎的方案(n=3)。另選擇行骨髓檢查的健康者20例為對照組,其中男性11例、女性9例,年齡40~70歲,中位年齡55歲,均排除近期感染、腫瘤、自身免疫性疾病或傳染性疾病。
1.2 外周血單個核細胞(PBMCs)采集 每例對象無菌抽取靜脈血5 mL,置于EDTA抗凝管中,用Ficoll-Hypaque密度梯度離心法獲取PBMCs:取MM患者或健康志愿者外周靜脈血5 mL,乙二胺四乙酸二鉀(EDTA-K2)抗凝;15 mL離心管中加入3 mL Ficoll液,同時將外周血以2倍HBSS稀釋,加至Ficoll液面之上,1 000×g離心15 min;吸取PBMCs層,以10 mL HBSS洗滌2次(300×g離心10 min)后,置于1 mL含有10%DMSO的新生牛血清中-80℃過夜,液氮中保存,待測。骨髓血(2 mL)單個核細胞采集法同上。
1.3 流式細胞術檢測Treg細胞及Th17細胞數
1.3.1 Treg細胞 調整上述采集的細胞濃度為1×106/100 μL,加入20 μL CD4 PE-Cy5/CD25 PE抗體(BD Biosciences, 批號:555348/562525),混勻后室溫、暗室孵育20 min,細胞染色緩沖液洗滌1次后以250×g離心5 min,棄上清;加入1 mL Foxp3破膜固定緩沖液,混勻后室溫、暗室孵育20 min,以250×g離心5 min,棄上清;細胞染色緩沖液洗1次,1 mL FOXP3破膜緩沖液洗滌2次,250×g離心5 min,棄上清;100 μL FOXP3破膜緩沖液重懸細胞,加入5 μL Alexa Fluor○R488 FOXP3抗體(BD Biosciences, 批號:560047)或5μL Alexa Fluor○R488小鼠IgG1 k同型對照(BD Biosciences, 批號:557721),室溫、暗室孵育30 min;細胞染色緩沖液洗滌2次,以0.5 mL細胞染色緩沖液重懸,上流式細胞儀檢測。
1.3.2 Th17細胞 調整上述采集的細胞濃度為(0.5~1)×106/100 μL,加入0.5 mL固定緩沖液,混勻后室溫、暗室孵育20 min,以350×g離心5 min,棄上清;加入2 mL破膜緩沖液,混勻后室溫、暗室孵育20 min,以350×g離心5 min,棄上清,重復1次。100 μL破膜緩沖液重懸細胞,加入20 μL Alexa Fluor○R647小鼠IgG1 k同型對照/CD3-FITC/CD4-PE抗體(BD Biosciences, 批號:555339/562281)或IL-17 Alexa Fluor○R647/CD3-FITC/CD4-PE抗體,室溫、暗室孵育30 min,2 mL破膜緩沖液洗滌2次,0.5 mL細胞染色緩沖液重懸,上流式細胞儀檢測。
1.4 RT-PCR檢測轉錄因子Foxp3及RORγt mRNA
的表達水平 PBMCs于37℃水浴復蘇后,HBSS洗滌,取(1~2)×106個細胞,加入1 mL Trizol,按照說明書提取總RNA。檢測RNA純度及濃度,取1 μg RNA的液體量,配制反轉錄反應液,37℃ 15 min、85℃ 5 s,逆轉錄cDNA。取cDNA 1 μL,配制qRT-PCR反應液,反應體系為20 μL。反應條件:95℃預變性30 s,95℃擴增5s,60℃延伸30 s;共40個循環。以GAPDH作為內參,記錄Ct值,計算相對RNA含量。
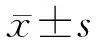
2 結 果
2.1 各組外周血Treg細胞、Th17細胞比率及Treg/Th17比值比較 結果(表1)表明:初發組及復發/難治組Treg細胞比率較正常對照組及平臺期組升高(P<0.05),Th17細胞比率無明顯改變;初發組與復發/難治組間Treg細胞、Th17細胞比率差異均無統計學意義。初發組及復發/難治組Treg/Thl7比值較正常對照組及平臺期組升高(P<0.05)。
2.2 各組骨髓Treg細胞、Th17細胞比率及Treg/Th17比值比較 結果(表2)表明:初發組及復發/難治組Treg細胞比率較正常對照組及平臺期組升高(P<0.05),Th17細胞比率無明顯改變;初發組與復發/難治組間Treg細胞、Th17細胞比率差異均無統計學意義。初發組及復發/難治組Treg/Th17比值較平臺期組及正常對照組Treg/Th17比值升高(P<0.05)。

表1 各組外周血Treg細胞、Th17細胞比率及Treg/Thl7比值比較
*P<0.05與正常對照組相比;△P<0.05與平臺期組相比
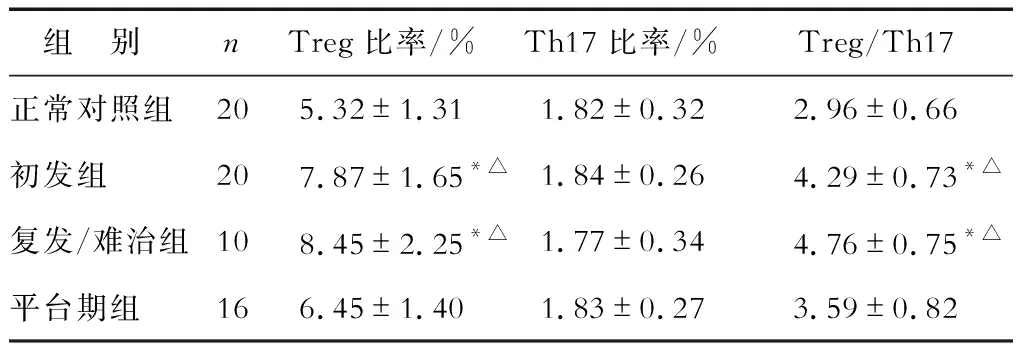
表2 各組骨髓Treg細胞、Th17細胞比率及Treg/Thl7比值比較
*P<0.05與正常對照組相比;△P<0.05與平臺期組相比
2.3 各組外周血及骨髓中轉錄因子Foxp3 mRNA、RORγt mRNA表達水平 結果(表3)表明:外周血及骨髓中,初發組及復發/難治組患者Foxp3較平臺期組和正常對照組升高(P<0.05);初發組及復發/難治組RORγt mRNA略高于平臺期組及正常對照組,但差異無統計學意義。
2.4 血清IL-6、CRP水平與Treg/Th17比值的相關性 結果(表4)表明:初發組及復發/難治組血清IL-6、CRP水平較平臺期組和正常對照組升高(P<0.05),與外周血及骨髓Treg/Th17比值變化趨勢一致。

表3 各組外周血及骨髓中Foxp3 mRNA、RORγt mRNA表達水平的比較
*P<0.05與正常對照組相比;△P<0.05與平臺期組相比

表4 各組血清IL-6、CRP水平比較
*P<0.05與正常對照組相比;△P<0.05與平臺期組相比
3 討 論
MM是高度異質性疾病,存在復雜的免疫系統缺陷。骨髓瘤細胞來源于B細胞發育終端的漿細胞,患者免疫系統存在多種異常,其中細胞免疫異常(如B細胞減少、CD4/CD8細胞減少)與患者生存時間負相關,提示細胞免疫在疾病控制中發揮重要作用[2]。
Treg細胞與Th17細胞在細胞分化和功能上存在相互制衡、互相轉化的關系;在腫瘤患者體內,Treg/Th17細胞平衡向Treg傾斜。在MM患者中,Treg細胞增多,其一方面由惡性漿細胞釋放的多種細胞因子誘導產生[8],一方面來自于細胞間抗原傳遞(Trogocytosis現象)[9]。在MM患者中,Trogocytosis現象較為常見,即惡性漿細胞將細胞表面抗原傳遞給T細胞,產生新的T細胞表面免疫表型,由此誘導新的Treg細胞產生[10-11]。本研究發現,初發MM和難治復發患者的外周血和骨髓中,Treg細胞比率均升高,與顏斌等[12]的結果相似。但也有研究[13]報道,Treg細胞比率在MM初發、復發時明顯降低,原因可能與患者接受的治療方案相關[14]。
關于MM患者中Th17細胞比率的研究結論并不一致。研究[15]報道,MM患者骨髓中Th17細胞增多;也有研究[16]發現,MM患者中Th17細胞較正常對照無明顯改變,本研究結果與之相似。
Foxp3是Treg細胞的轉錄因子。本研究MM患者中,Foxp3呈現與Treg細胞數量相同的變化趨勢,從轉錄水平證實Treg細胞在MM患者初發、復發時增加,治療有效后恢復正常水平;Th17細胞關鍵性轉錄因子RORγt在各期MM患者中無顯著變化,與Th17細胞數量水平變化趨勢一致,從轉錄水平證實Th17細胞在MM患者中無明顯變化。
Treg與Th17在自身免疫中發揮相反的作用,但分化密切相關:CD4+T幼稚細胞在轉化生長因子-β(TGF-β)誘導下表達Foxp3或RORγt,分別誘導CD4+T向Treg和Th17細胞雙向分化。CD4+T細胞由所在環境中的細胞因子決定其分化方向,例如:在前炎癥因子和低濃度TGF-β存在時,RORγt表達上調、Foxp3表達受到抑制,使細胞具有Th17特性;高濃度TGF-β則有助于Foxp3表達,使細胞具有Treg特性。因此,Treg/Th17比值可以反映細胞免疫異常情況。本研究發現,Treg/Th17細胞比值與MM病情相關,新診斷、病情復發時升高,有效控制病情后恢復正常水平, 提示Treg/Th17比值與MM預后相關。研究證實,Treg/Th17比值升高的患者預后不良[17];長期存活患者的Treg/Th17比值正常甚至低于正常[18]。因此,Treg/Th17比值較Treg和Th17細胞比率更具有MM預后價值[9]。
IL-6是MM細胞重要的生長因子,其相關信號通路可調控MM細胞的增殖、程序性死亡[19]。MM患者IL-6升高與預后不良、生存時間短密切相關[20]。本研究發現,初發組、復發/難治組IL-6水平高于平臺期組和正常對照組,與既往文獻[20]報道符合。IL-6是Th17細胞分化中重要的誘導炎癥因子,即在IL-6存在下,Treg/Th17平衡向Th17傾斜。但本研究中,Th17細胞數量沒有明顯改變,且Treg/Th17平衡向Treg傾斜。出現這種結果的原因可能為:首先,本研究檢測的是外周血血清IL-6水平,不能準確反映MM腫瘤微環境的情況,骨髓中可能存在其他影響Th17分化的因素;其次,MM患者Treg細胞升高更為明顯。
CRP是急性相蛋白,在IL-6刺激下由肝細胞合成。研究[21-22]表明,CRP水平能反映IL-6相關信號通路的活性。本課題組前期研究[21]發現,CRP升高水平與MM患者療效差相關;本研究顯示,CRP水平與Treg/Th17比值變化趨勢一致,進一步說明CRP可用于預測MM預后。
綜上所述,本研究通過對MM各期患者外周血及骨髓中Treg、Th17細胞比率,以及患者外周血血清IL-6和CRP水平的分析,證實Treg/Th17平衡在MM活動期向Treg細胞傾斜,有效治療后恢復,提示Treg/Th17比值具有MM預后判斷作用。此外,本研究中,經過治療后,部分患者Treg/Th17比值仍較高,可能與治療效果不佳相關。在MM患者中,Treg/Th17平衡是否受到其他細胞亞群或因子的影響,有待于更深入的研究來明確。

