小檗堿通過Toll樣受體減輕高脂誘導的大鼠腎損害
吳躍躍, 黃新梅, 陳灶萍, 徐 炯, 盛 勵, 劉 軍
復旦大學附屬上海市第五人民醫院內分泌代謝科,上海 200240
糖尿病已經成為我國慢性腎病首要誘因[1],給我國慢病防治提出了巨大挑戰。以往研究[2-3]報道,Toll樣受體(TLR)與腎損害相關。本課題組前期研究[4]顯示,小檗堿能通過改善胰島素抵抗及增加脂聯素水平來減輕高脂喂養大鼠的腎損害。然而,小檗堿的腎臟保護作用與TLR的關系目前鮮見報道。因此,本研究用小檗堿干預高脂喂養大鼠,觀察腎臟損害情況及相關的分子代謝指標的改變,以期探討小檗堿改善高脂誘導腎臟損害與TLR的關系。
1 材料與方法
1.1 動物來源及分組 50只8周齡清潔級雄性Wistar大鼠購自中國科學院實驗動物中心。大鼠體質量(220±20)g,自由進食、進水,環境溫度為(25±1)℃,晝夜周期為12/12 h。適應性喂養1周后,將其隨機分為:正常喂養組(NF組)、正常喂養小檗堿組(NF+LBBR組)、高脂喂養安慰劑組(HF組)、高脂喂養低劑量小檗堿組(HF+LBBR組)和高脂喂養高劑量小檗堿組(HF+HBBR組),每組各30只。該研究通過復旦大學實驗動物科學部動物福利和倫理小組審查(20160878A019)。
1.2 喂養方法 正常喂養組給予正常標準飼料,高脂喂養組給予高脂飼料(脂肪供能45%);飼料均由上海斯萊克實驗動物有限責任公司飼料部提供。每天記錄體質量和進食量,共喂養8周。喂養4周后, NF+LBBR組、HF+LBBR組及HF+HBBR組分別予低濃度小檗堿(150 mg·kg-1·d-1)、低濃度小檗堿(150 mg·kg-1·d-1)及高濃度小檗堿(380 mg·kg-1·d-1)灌胃4周;小檗堿以0.5%羧甲基纖維素鈉[生工生物工程(上海)股份有限公司]配至所須濃度。HF組予0.5%羧甲基纖維素鈉干預4周。
1.3 生化指標的測定 喂養8周時,在代謝籠中收集大鼠尿液,測定尿微量白蛋白(MAU)及肌酐(Cr)。尿MAU及Cr測定采用相應大鼠ELISA試劑盒(美國GTX公司),計算兩者比值(ACR)。
干預結束時,麻醉解剖,主動脈采血,取腎臟組織。空腹血糖(GLU)、血肌酐(SCr)、血尿素氮(BUN)等指標在全自動生化分析儀 (Hitachi Boehringer Mannheim, 德國)上測定。空腹血清胰島素(FINS)ELISA試劑盒購自美國Crystal Chem公司。血清游離脂肪酸(FFA)采用的非酯化脂肪酸C檢驗法試劑盒購自日本Wako Pure Chemical公司。大鼠白細胞介素-1(IL-1)ELISA試劑盒購自北京百奧萊博科技有限公司。大鼠白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)采用的ELISA試劑盒購自上海廣銳生物科技有限公司。
1.4 組織病理檢查 腎臟組織取材后置于甲醛中固定48 h,石蠟包埋,按8 μm厚度切片。Masson染色:腎臟組織切片脫蠟、水化,加入Bouin處理液過夜,用自來水沖洗;分別予蘇木精染色液及堿性品紅染色5~10 min,再予磷鎢酸溶液反應5~10 min,最后予苯胺藍染色。染色后在顯微鏡下(200倍)觀察腎組織病理改變。
1.5 Western印跡測定炎性因子的表達 腎臟組織勻漿后上樣20 uL,80 V電泳 30 min后再120 V電泳100 min;100 V轉膜2 h后,麗春紅染色5~10 min;5%脫脂奶粉室溫下封閉1 h;加入按推薦的稀釋比配制的TLR2、TLR4、核轉錄因子-κB(NF-κB)、轉化生長因子-β(TGF-β)的相應一抗,室溫下孵育2 h;洗膜后,加入按1∶5 000配制的二抗,室溫孵育1 h。ECL顯影曝光后,分析條帶。
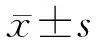
2 結 果
2.1 大鼠體質量變化 結果(圖1)表明:第3周時,高脂飲食組大鼠的體質量大于正常飲食組(P<0.05);第5周時,HF組及HF+LBBR組大鼠的體質量明顯大于其余3組(P<0.05);第6周開始,HF組大鼠的體質量大于其余4組(P<0.05)。

圖1 大鼠體質量變化m/g
*P<0.05為HF組與NF組相比;△P<0.5為HF+LBBR組與NF組相比;▲P<0.05為HF+HBBR組與NF組相比
2.2 糖脂代謝情況 結果(表1)表明:HF組大鼠
GLU、FINS、FFA水平較NF組升高(P<0.05)。HF+LBBR組和HF+HBBR組GLU、FINS、FFA較HF組明顯下降(P<0.05);高脂喂養時,隨著小檗堿劑量增加,FINS水平進一步下降(P<0.05)。
2.3 腎功能變化 結果(表1)表明:HF組及HF+LBBR組MUC、ACR水平均明顯高于NF組(P<0.05);HF+HBBR組MUC、ACR水平低于HF+LBBR組(P<0.05)。 各組SCr、BUN水平差異無統計學意義。 Masson染色結果(圖2)表明:高脂喂養時,隨著小檗堿劑量增加,腎小球基底膜的厚度變薄,腎小球區域的藍色沉淀物減少。

表1 大鼠尿蛋白、糖脂代謝及炎癥因子情況
MAU:尿微量白蛋白;Cr:肌酐; ACR:尿白蛋白/肌酐;SCr:血肌酐;BUN:尿素氮;GLU:空腹血糖;FINS:空腹胰島素;IL-1:白介素-1;TNF-α:腫瘤壞死因子-α;IL-6:白介素-6.*P<0.05與NF組相比;△P<0.05與HF組相比;▲P<0.05與HF+LBBR組相比

圖2 腎臟組織Masson染色
2.4 炎癥因子變化 結果(表1)表明:HF組大鼠IL-1、TNF-α、IL-6水平均較NF水平升高(P<0.05)。HF+LBBR組和HF+HBBR組大鼠IL-1、TNF-α、IL-6的水平較HF組明顯降低(P<0.05)。
2.5 ACR影響因素分析 Pearson分析結果(表2)表明:ACR與GLU、FINS、FFA、IL-1、TNF-α、IL-6正相關(P<0.05)。以ACR為因變量,GLU、FINS、FFA、IL-1、TNF-α、IL-6為自變量,進行logistic多元逐步回歸分析,結果顯示:IL-6與ACR獨立正相關[OR=1.18,95%CI 1.03~1.35,P=0.014]。

表2 ACR影響因素的Pearson相關分析
GLU:空腹血糖;FINS:空腹胰島素;FFA:游離脂肪酸;IL-1:白介素-1;TNF-α:腫瘤壞死因子-α;IL-6:白介素-6
2.6 腎臟組織TLR4、TLR2、NF-κB、TGF-β的表達水平 結果(圖3)顯示:HF組大鼠腎臟組織TLR4、TLR2表達較NF組減少(P<0.05);高脂喂養時,小檗堿干預后,大鼠腎臟組織TLR4、TLR2表達增加(P<0.05)。HF組大鼠腎臟組織NF-κB、TGF-β表達較NF組增加(P<0.05);高脂喂養時,小檗堿干預后,NF-κB、TGF-β表達減少(P<0.05)。

圖3 高脂喂養與小檗堿對大鼠腎臟組織TLR2、TLR4、NF-κB、TGF-β的表達的影響
3 討 論
腎臟脂毒性與糖尿病腎病密切相關。糖尿病患者及糖尿病動物模型的腎臟脂質合成代謝增加、脂質分解代謝抑制,導致脂質堆積,進而引起炎癥反應,損傷腎臟細胞[5-7]。研究腎臟脂毒性對于糖尿病腎病的早期防治具有重要意義。研究[8]提示,肥胖相關腎損害除腎小球肥大外,還有腎小球基膜增厚、系膜基質增多及腎內炎癥因子增多。這些病理改變導致腎小球硬化及腎小管基質硬化,進而導致終末期腎病[4]。本研究采用高脂喂養誘導大鼠腎臟脂毒性,發現HF組大鼠體質量、FFA水平明顯升高,MAU、ACR升高,同時造成腎臟損害;小檗堿使上述改變明顯改善。
小檗堿是從黃連或黃柏皮中提煉出來的一種異喹啉生物堿,臨床上主要用于治療腹瀉。近年來的研究[9]發現,小檗堿具有降糖、改善胰島素敏感性、降血脂、減小體質量、減輕炎癥、抗氧化應激的作用。本研究得出相似結論,提示小檗堿有望成為治療腎病的藥物。目前認為,小檗堿對糖尿病腎病患者的腎功能有保護作用,主要分子機制如下:(1)小檗堿通過AMPK途徑、EP4-Gαs-cAMP信號通路等[10-11]減輕炎癥反應及抗氧化應激,進而保護腎功能;(2)小檗堿通過調控β-抑制素、細胞間黏附分子-1(ICAM-1)/血管細胞黏附分子-1(VCAM-1)、 基質金屬蛋白酶(MMPs)及組織抑制因子(TIMPs)等[12-13]保護腎功能。本課題組前期研究[4,14]顯示,小檗堿通過AMPK途徑改善胰島素抵抗及提高脂聯素水平,進而減輕高脂喂養大鼠的腎損害。本研究顯示,小檗堿可以降低高脂喂養大鼠的IL-1、TNF-α、IL-6的水平;Pearson相關分析顯示,ACR與GLU、IL-1、TNF-α、IL-6正相關;進一步logistic多因素回歸分析顯示,IL-6與ACR獨立相關。上述研究提示,小檗堿減輕高脂喂養大鼠腎臟損傷可能與其改善腎臟炎癥狀態有關。
在腎臟缺血灌注損傷中,TLR4/NF-κB通路起主要作用,通過激活TNF-α、IL-1β、IL-6、ICAM-1、單核細胞趨化蛋白-1(MCP-1)等炎癥因子,損害腎臟細胞,誘導其凋亡[2]。炎癥和纖維化是糖尿病腎病的主要特征。研究[3]顯示,TLR2通過TGF-β促進糖尿病腎病炎癥和纖維化的發生及發展。本研究顯示,高脂喂養可以減少大鼠腎臟組織TLR4、TLR2的表達,增加NF-κB、TGF-β的表達,而小檗堿可以逆轉這一趨勢。本研究中高脂喂養減少TLR的結果與以往文獻[2]相悖,原因可能與腎臟損害狀態不同有關:本研究中高脂誘導腎毒性,引起腎臟慢性炎癥反應;而文獻[2]采用缺血再灌注損傷或鏈脲霉素(STZ)誘導腎臟發生急性炎癥應激反應。這兩種狀態對TLR的影響可能不同,但有待進一步研究證實。
綜上所述,本研究初步顯示,小檗堿能減輕高脂喂養大鼠的腎臟損傷,這可能與小檗堿減輕腎臟炎癥反應有關。小檗堿能促進大鼠腎臟組織TLR4、TLR2的表達,抑制NF-κB及TGF-β的表達,抑制炎癥因子的釋放及組織纖維化,進而改善高脂腎臟損害。

