15-脫氧-Δ12,14-前列腺素J2對大鼠酸性胃內容物吸入性肺損傷的保護作用
施勁東, 隆 玄, 符翠萍, 李建楠, 謝 娟, 施天昀, 梅周芳, 揭志軍, 李善群*
1. 復旦大學附屬上海市第五人民醫院呼吸科,上海 2002402. 復旦大學附屬中山醫院呼吸與危重癥醫學科,上海 200032
吸入性肺損傷是危重病患者的常見并發癥之一,可迅速進展為急性呼吸窘迫綜合征(acute respiratory distress syndrome, ARDS)。臨床上常見的吸入性肺損傷主要由胃酸、食物顆粒等胃內容物反流誤吸所致,目前尚缺少有效的治療方法,導致其發病率和死亡率居高不下。胃酸及胃內顆粒物是胃內容物的主要成分,吸入后導致雙相肺損傷,早期主要為由酸介導的化學損傷,后期主要為由炎癥細胞、炎癥因子介導的炎癥級聯反應[1-2]。因此,降低或阻斷酸性胃內容物吸入性肺損傷時的炎癥級聯反應可能是提高該病搶救成功率的關鍵。
研究[3]表明,前列腺素類化合物15-脫氧-Δ12,14-前列腺素J2(15 -deoxy-Δ12,14-prostaglandin J2,15d-PGJ2)能抑制機體的炎癥及氧化應激損傷。在內毒素和博來霉素誘導的ARDS和感染性休克動物模型中,15d-PGJ2能夠通過激活過氧化物酶體增殖物激活受體-γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)或抑制核轉錄因子-κB(NF-κB)、轉錄因子-1(AP-1)等途徑,發揮肺保護作用[4-7]。本研通過建立酸性胃內容物所致大鼠肺損傷模型,進一步探討15d-PGJ2能否減輕肺損傷程度。
1 材料與方法
1.1 實驗動物 雄性SPF級Sprague-Dawley(SD)大鼠25只,體質量200~250 g,購自復旦大學上海醫學院動物房。動物由復旦大學附屬中山醫院實驗動物中心于SPF級條件下飼養,自由攝水、飲食。
1.2 酸性胃內容物懸液制備 酸性胃內容物顆粒懸液(combined acid and gastric particles,CAGP)的制備方法參照文獻[8]:將用于提取胃內容物的5只SPF級雄性SD大鼠經腹腔注射20%烏拉坦麻醉(7.5 mL/kg),待大鼠安靜后將其仰臥置于手術臺板上,固定頭部與四肢;腹部備皮消毒,切開腹部皮膚,暴露大鼠胃并用手術剪切開,收集胃內容物;用0.9%氯化鈉液沖洗胃內容物3次,然后外科紗布過濾,以去除胃內大分子顆粒、膽鹽等;過濾液在高壓蒸汽下消毒滅菌25 min,以800×g在室溫下離心2 min;棄去上清液,進一步去除胃內膽鹽等物質,收集離心所得沉淀物,稱重,用pH 為1.25的鹽酸溶液(經0.2 μm無菌一次性針頭濾器過濾)重懸,制成濃度為20 mg/mL的酸性胃內容物懸液。
1.3 吸入性肺損傷模型的建立及干預治療 將20只SPF級雄性SD大鼠隨機分為對照組和治療組,每組10只。所有大鼠經腹腔注射10%水合氯醛按4 mL/kg進行麻醉,待大鼠安靜后將其仰臥置于無菌手術臺板上,固定頭部與四肢,使臺板傾斜30°。頸部備皮消毒,于中線做約8 mm小切口,分開筋膜后,游離甲狀腺并用血管鉗分開頸前肌,暴露氣管。將14G靜脈套管針插入氣管至隆突上0.5~1 cm,拔出針心,套管針連接于1 mL注射器,向氣管內緩慢滴注制備好的CAGP (1.5 mL/kg)。滴注后取下套管針,保持臺板傾斜的同時輕輕轉動大鼠,使注射的酸性胃內容物懸液均勻分布至大鼠雙側肺。滴注CAGP后即刻,治療組腹腔注射15d-PGJ2(1 mg/kg),對照組腹腔注射相同體積的PBS。用縫線分別縫合氣管與頸部切口,使大鼠正常呼吸,并在室溫下自行蘇醒。分別于滴注CAGP后4 h和12 h,每組各取5只大鼠終止實驗,并采集標本。
1.4 標本采集和檢測方法
1.4.1 血氣分析 損傷后4 h和12 h,經腹腔注射20%烏拉坦麻醉大鼠。消毒后打開腹腔,將腹腔內腸管翻至一側,暴露出腹主動脈。用事先肝素化的1 mL注射器抽取腹主動脈血0.5 mL后,立即用止血鉗夾閉腹主動脈,以避免動脈血噴射。抽出的動脈血即刻用血氣分析儀進行動脈血氧分壓(arterial partial pressure of oxygen, PaO2)檢測。
1.4.2 血清采集和肺濕重/干重比值(wet-to-dry weight ratios, W/D)測定 大鼠行血氣分析后,剪開腹主動脈放血處死,采集腹腔內積血,分離血清凍存待檢。放血后迅速打開胸腔,結扎右側主支氣管,取出右肺上葉,用吸水紙吸干其表面液體后,于電子天平秤上稱其質量,記錄為濕重。將稱量好的右肺上葉置于60℃鼓風干燥箱內72 h以上,至其質量不再發生變化后,再次稱重,記錄為干重。計算前后兩次的比,即W/D。
1.4.3 支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)的收集、蛋白測定、細胞計數 對大鼠左肺進行支氣管肺泡灌洗。用16G插管針氣管插管,用注射器取1.5 mL無菌冷PBS行支氣管肺泡灌洗術3次。收集的BALF于4 ℃離心機250×g離心10 min,留取上清液于-20 ℃凍存。用BCA法(試劑盒購自碧云天公司)測定大鼠BALF上清液中總蛋白濃度,以觀察大鼠肺泡內蛋白滲出情況。操作方法嚴格按照說明書進行。
細胞沉淀用0.5 mL PBS重懸,吸取20 μL用細胞計數板計數細胞總數。余懸液在TXT3細胞涂片上于離心機中250×g離心10 min,使細胞均勻平鋪于載玻片上,晾干后,用瑞-姬氏染液進行快速染色,在高倍鏡下計數200個細胞,進行中性粒細胞計數。
1.4.4 肺組織病理學檢測 將大鼠左肺用4 % 多聚甲醛充盈,結扎左側主支氣管后放入4 ℃的4 % 多聚甲醛中固定,3 d后進行包埋、切片和蘇木精-伊紅(H-E)染色,在200倍視野下觀察、拍照。由未參與實驗的病理科醫師分別在低倍和高倍視野下進行觀察和炎癥程度評分,參考文獻[9-10]。
1.4.5 BALF和血清腫瘤壞死因子-α(tumor necrosis factor -α, TNF-α)濃度測定 采用ELISA法檢測BALF上清液和血清中的TNF-α濃度,試劑盒購自上海森雄科技實業有限公司。
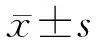
2 結 果
2.1 肺部H-E染色和PaO2結果(圖1、表1)表明:與對照組相比,損傷后4 h和12 h,治療組炎癥程度明顯下降,PaO2明顯改善,差異均有統計學意義(P<0.05)。

圖1 兩組大鼠肺組織H-E染色結果比較

表1 兩組大鼠炎癥和肺功能相關指標比較n=5,
PaO2:動脈血氧分壓;W/D:肺組織濕重/干重比值;BALF:支氣管肺泡灌洗液;TNF-α:腫瘤壞死因子-α.*P<0.05與對照組同時間點相比
2.2 肺損傷程度 結果(表1)表明:損傷后4 h、12 h,治療組肺部滲出(W/D)與蛋白滲漏(總蛋白)均較對照組減少,差異均有統計學意義(P<0.05)。
2.3 BALF中白細胞總數和中性粒細胞數 結果(表1)表明:損傷后4 h、12 h,治療組BALF中白細胞總數和中性粒細胞數均較對照組減少,差異均有統計學意義(P<0.05)。
2.4 BALF和血清中TNF-α濃度 結果(表1)表明:損傷后4 h、12 h,治療組BALF和血清中TNF-α濃度均較對照組下降,差異均有統計學意義(P<0.05)。
3 討 論
胃內容物誤吸是ARDS的主要病因之一。在年老體弱、酗酒、顱腦創傷、神經系統疾病、腫瘤等危重患者中,吸入性肺損傷發生率更高[11-12]。與其他因素所致的ARDS不同,酸性胃內容物吸入性肺損傷是一個雙相過程:早期主要為酸液介導的化學性損傷,一般發生于損傷后3 h之內;后期為吸入的胃內容物引發由炎癥細胞和炎癥因子介導的炎癥級聯反應,此階段的損傷程度更為劇烈,損傷后4~6 h達高峰,15 h后逐漸出現修復反應[13]。目前,臨床對于酸性胃內容物吸入性肺損傷的治療僅限于對癥及支持治療,如氣管插管或氣管鏡下清除吸入物質、機械通氣、抗生素治療、糖皮質激素抗炎治療等。然而,這些治療方法均未能取得令人滿意的效果。因此,尋找有效控制吸入性肺損傷的治療方法成為了該領域的研究熱點之一。
近年研究[14]表明,15d-PGJ2是組織炎癥及氧化應激損傷時釋放的內源性物質,對機體的炎癥及氧化應激損傷起著重要的抑制作用。15d-PGJ2由前列腺素D2(prost aglandin D2, PGD2)自發脫水形成,是PPAR-γ的天然配體及強激動劑之一。Genovese等[6]在博來霉素誘導肺損傷小鼠模型中發現,給予PPAR-γ的兩個激動劑,即羅格列酮和15d-PGJ2,能夠減輕肺水腫,減輕炎癥細胞浸潤和肺部炎癥程度,降低小鼠死亡率。Wang等[7]研究表明,在內毒素誘導的急性肺損傷小鼠模型中,PPAR-γ激活后能通過抑制高遷移率族蛋白B1(high mobility group box 1,HMGB1)-晚期糖基化終產物受體(receptor for advanced glycation endproducts,RAGE)水平發揮肺保護作用。因此,本研究在大鼠發生酸性胃內容物吸入性肺損傷后,給予外源性15d-PGJ2,觀察其能否發揮抗炎、免疫調節及抗氧化應激的作用,從而產生肺保護作用。
本研究結果顯示,大鼠發生吸入性肺損傷后,與對照組比較,治療組損傷后4 h和12 h肺組織炎癥評分、BALF中的白細胞總數和中性粒細胞數均下降(P<0.05),提示15d-PGJ2能減輕吸入性肺損傷大鼠肺部炎癥;治療組BALF中總蛋白減少、W/D比值下降(P<0.05),提示給予15d-PGJ2治療能減少急性肺損傷過程中肺泡內富含蛋白液體的滲出,進而保護肺功能。Lu 等[5]的研究也發現,在內毒素誘發的急性肺損傷大鼠模型中,通過靜脈注射15d-PGJ2能減輕肺部炎癥和蛋白滲漏。 Zingarelli等[15]發現,15d-PGJ2能改善膿毒血癥大鼠的血流動力學,降低其血漿TNF-α等細胞因子的濃度,減輕肺組織中性粒細胞浸潤,并抑制肺組織中NF-κB和AP-1的活性。此外,本研究還發現,15d-PGJ2能降低BALF和血清中TNF-α的濃度,且能改善PaO2(P<0.05),糾正急性肺損傷所誘發的低氧血癥。
綜上所述,在酸性胃內容物吸入性肺損傷大鼠模型中,腹腔注射15d-PGJ2能減輕其肺部損傷和肺部炎癥水平,改善PaO2。本研究的局限性在于:(1)未設置吸入0.9%氯化鈉液的正常對照組,因此不利于評估15d-PGJ2是否對其他吸入性肺損傷發揮作用;(2)觀察時間較短,難以明確15d-PGJ2治療對大鼠預后的影響;(3)沒有闡明15d-PGJ2通過PPAR-γ調控肺臟炎癥的具體分子機制。今后將補充上述實驗,進一步驗證15d-PGJ2對肺損傷的保護作用。隨著對急性肺損傷發病機制研究的不斷深入,15d-PGJ2有望取代糖皮質激素成為吸入性肺損傷的有效治療藥物。

