利用大孔吸附樹脂與高速逆流色譜聯用技術大量制備脫氧雪腐鐮刀菌烯醇的方法
王 剛, 胡俊強, 史建榮, 徐劍宏
[江蘇省食品質量安全重點實驗室-省部共建國家重點實驗室培育基地/農業農村部農產品質量安全風險評估實驗室(南京)/江蘇省現代糧食流通與安全協同創新中心/江蘇省農業科學院農產品質量安全與營養研究所,江蘇南京 210014]
脫氧雪腐鐮刀菌烯醇(deoxynivalenol,簡稱DON)又稱嘔吐毒素,是一種危害巨大的真菌毒素,主要由鐮刀菌產生,常見于受赤霉病侵害的谷物籽粒中。針對DON的毒理學研究表明,DON可以阻滯細胞周期并引發細胞凋亡,進而對哺乳動物的腸道上皮細胞產生毒害,阻礙腸道上皮細胞增殖與分化,同時DON也會引發腸道炎癥反應,造成嘔吐、腹瀉等病癥[1]。相關研究表明,DON還具有血液毒性、骨髓毒性以及致癌性[2-3],因此DON毒素對于食品安全存在重大威脅。根據最新的GB 2761—2017《食品安全國家標準 食品中真菌毒素限量》,我國對谷物及其制品中DON的限量標準為 1 000 μg/kg。
江蘇省近年來谷物中DON毒素污染情況嚴重,根據筆者調研結果,2015、2016年江蘇省小麥中DON毒素平均含量分別為(2 087±112) μg/kg、(2 601±126) μg/kg,其平均含量已超過限量標準2倍,超標率均在70%以上[4]。由于DON毒素污染,農戶近年來蒙受了重大經濟損失。因此,DON的脫毒處理手段對于保障谷物食品安全、維護農戶經濟利益具有重大意義。
針對DON毒素的毒理學研究與脫毒研究需要大量DON純品,但目前DON純品價格極高,嚴重限制了相關研究的開展。由于DON毒素立體結構復雜,手性中心眾多,因此針對DON的全合成工藝至今仍未開發成功。國內外均有關于從鐮刀菌發酵物中提取并分離DON毒素的報道,其分離手段包括硅膠柱色譜、制備型液相以及高速逆流色譜等,其產量最高達每批次100 mg左右[5-8]。
大孔吸附樹脂是一類內部具有孔洞結構的交聯高分子材料,由于其具有高吸附容量以及可再生的優點,因此被廣泛應用于天然產物的分離純化中,其純化原材料來源包括細菌發酵液[9]、真菌發酵液[10-11]、植物組織[12-13]甚至動物組織[14]。然而單一運用大孔吸附樹脂難以獲得高純度化合物[15],往往還需要后續精制純化手段。高速逆流色譜是一類基于液液分配原理的液相色譜系統[16],尤其適合天然產物的純化。大孔吸附樹脂與高速逆流色譜均具有成本低、適用范圍廣的優勢,因此,關于二者聯用分離純化天然產物的研究時常見諸報道[17-18]。
本研究介紹了1種大孔吸附樹脂層析與高速逆流色譜聯用的技術;首先接種禾谷鐮刀菌菌株PH-1至大米培養基中進行固體發酵,之后以甲醇水溶液(體積分數為85%)提取發酵物中的DON,提取物經大孔吸附樹脂初步純化后,用高速逆流色譜進行精制,最終獲得純度達96.78%的DON化合物,每批次可以獲得500 mg以上的毒素純品,為后續毒素降解研究提供了基礎。
1 材料與方法
1.1 材料與儀器
1.1.1 試劑 DON毒素標準品,購自上海Romer Labs公司;色譜純甲醇,購自德國Merck公司;CDCl3,購自美國Cambridge Isotope Laboratories公司;其他試劑均為國產分析純。
大孔吸附樹脂XAD-2、XAD-4、XAD-7HP、XAD-11180、XAD-1180N與陰離子交換樹脂FPA91-OH、IRA67均購自美國Sigma-Aldrich公司。大孔吸附樹脂在使用之前均用甲醇浸泡24 h,再用去離子水徹底沖洗至流出液不含甲醇,陰離子交換樹脂在使用之前以飽和NaCl溶液浸泡24 h,再用去離子水徹底沖洗。
大米培養基成分為350 g大米與120 mL去離子水,混合均勻后進行高壓蒸汽滅菌處理。
1.1.2 儀器 主要儀器包括OptiChrome-300 PLUS(高速逆流色譜儀),江陰逆流科技公司;Waters e2695高效液相色譜儀(HPLC),美國Waters公司;AB Sciex 5600(高分辨質譜儀),美國AB Sciex公司;DRX-600(核磁共振波譜儀),德國Bruker公司。
1.2 DON的分析定量方法
利用Waters e2695高效液相色譜儀檢測樣品中的DON含量,采用外標法對DON進行定量。色譜柱為ACE C18柱[十八烷基硅烷(ODS),4.6 μm×150 mm,5 μm,Phenomenex],柱溫為35 ℃,流動相為33%甲醇水溶液,流速為0.6 mL/min,檢測波長為218 nm。該色譜條件下DON的保留時間為6.8 min。
每組試驗均設置3組平行試驗,最終檢測結果以3組試驗的平均值表示。
DON在樹脂上的吸附率用如下公式表示:
式中:Qe表示樹脂吸附容量(μg/g);C0、Ce分別表示樣品溶液初始DON濃度以及吸附后殘留DON濃度(μg/mL);V0表示初始樣品溶液體積(mL);m表示樹脂質量(g,干質量)。
1.3 固體發酵與樣品制備
將禾谷鐮刀菌(Fusariumgraminearum)接種至PDA培養基上,于25 ℃培養7 d,將菌絲體接種至大米培養基上,于 25 ℃ 培養21 d。
發酵結束后將大米烘干,粉碎;用1 L 85%甲醇溶液提取DON毒素,共提取2次,合并提取液,減壓蒸餾至干,殘余油狀物即為供試樣品。
1.4 大孔吸附樹脂柱色譜參數優化
1.4.1 不同樹脂對DON的吸附容量測定 用10%乙醇溶液重懸供試樣品,至DON終濃度約為500 μg/mL。取50 mL溶液加入250 mL三角燒瓶中,加入1 g預處理樹脂,室溫下振蕩吸附12 h。取上清溶液,以甲醇稀釋10倍后用HPLC法檢測DON含量。
1.4.2 XAD-4樹脂吸附條件的優化 取1 g預處理的 XAD-4樹脂,加至50 mL供試溶液中,分別調節供試溶液pH值(5.0、6.0、7.0、8.0、9.0)以及吸附溫度(25、30、35、40 ℃),振蕩吸附12 h。取上清溶液,以甲醇稀釋10倍后用HPLC法檢測DON含量。
1.4.3 吸附等溫線方程 分別取1 g預處理的XAD-4樹脂,加入含有不同濃度DON的供試溶液,以最佳吸附條件靜態吸附2 h,取上清用HPLC法檢測殘余DON含量,計算不同濃度下樹脂吸附容量,并作出吸附等溫線。
采用Langmuir吸附模型與Freundlich吸附模型擬合吸附行為。
Langmuir吸附方程:
Freundlich吸附方程:
式中:Qe為吸附容量;Ce為吸附達到平衡時溶液中DON濃度;Qm為Langmuir模型中的理論最大吸附量;KL、KF、1/n為經驗常數。
1.4.4 洗脫條件的優化 稱取9份已吸附飽和的XAD-4樹脂各1 g,分別用不同質量濃度的乙醇溶液進行解吸附,檢測洗脫溶液中的DON濃度。
確定最優洗脫濃度后,取20 g吸附飽和的XAD-4樹脂裝入玻璃層析柱,以乙醇溶液進行洗脫,洗脫流速為2 BV/h,分部收集流出液,檢測DON濃度。流出液經減壓蒸餾至干,供高速逆流色譜分離純化。
1.5 高速逆流色譜純化DON毒素
將去離子水與等體積乙酸乙酯混合,充分混勻后靜置過夜分層,分離上下相,即為高速逆流色譜溶劑系統。將上相以20 mL/min流速泵入高速逆流色譜,隨后以1.5 mL/min流速泵入下相,同時開啟旋轉,轉速設置為1 040 r/min,待系統平衡。
將經大孔吸附樹脂處理后的樣品用少量下相溶解,通過進樣閥泵入高速逆流色譜儀,以1.5 mL/min流速洗脫,檢測波長為220 nm。
分部收集流出液,合并富含DON的餾分,通過N2吹掃去除部分溶劑,剩余溶液置于冷藏室進行結晶,將得到的晶體分別以色譜純甲醇或CDCl3溶解,用LC-MS(液相色譜-質譜聯用)與NMR(核磁共振)法測定其分子量及分子結構。
2 結果與分析
2.1 大孔吸附樹脂的篩選
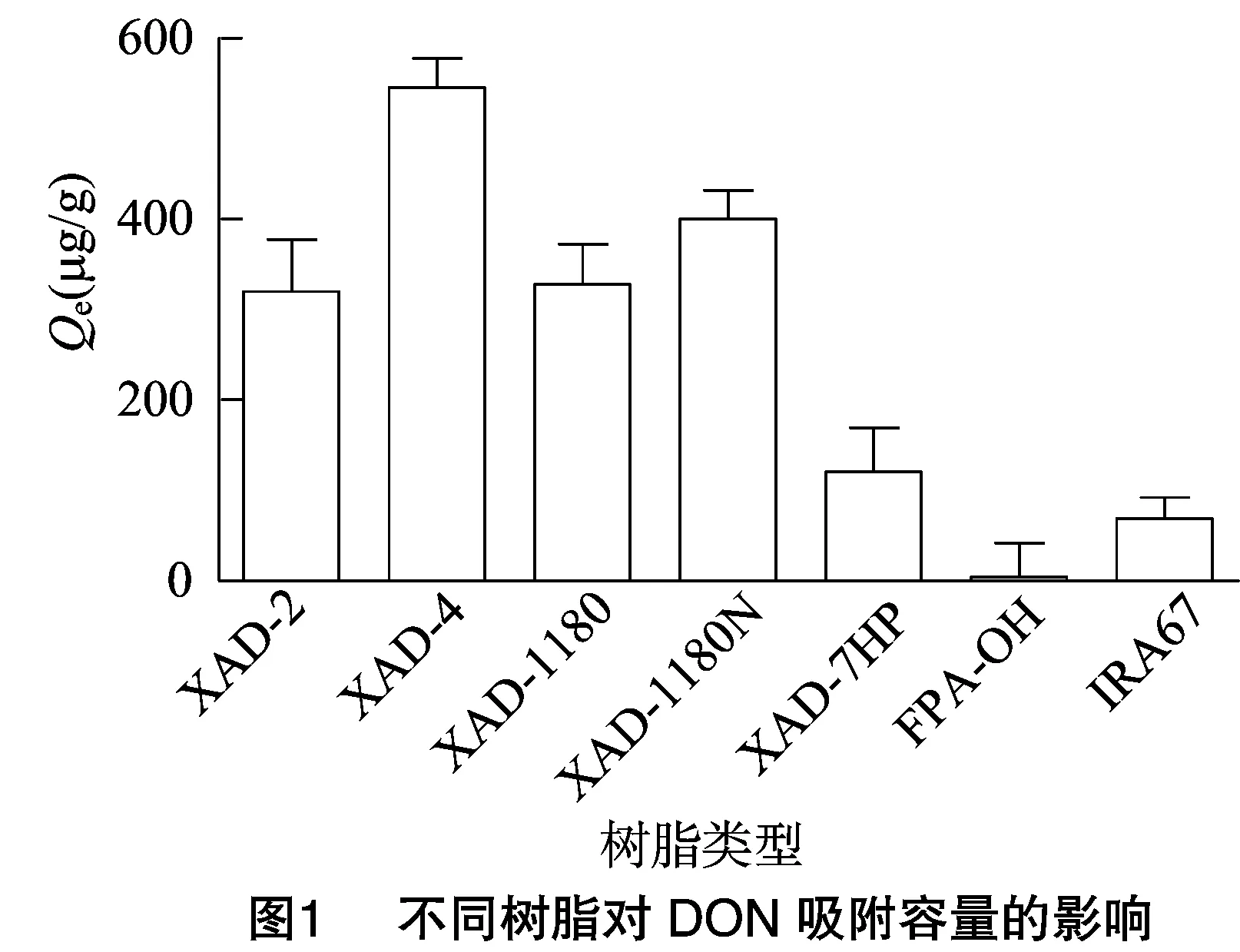
本研究選取了5種大孔吸附樹脂與2種陰離子交換樹脂(表1),分別檢測其對發酵提取物中DON的吸附能力。靜態吸附試驗結果表明,XAD-4樹脂對于DON的吸附容量最高,達545.76 μg/g(圖1),因此選用XAD-4樹脂作為吸附劑進行DON毒素的純化。
從表1可以看出,陰離子交換樹脂對于DON的吸附能力明顯低于大孔吸附樹脂,考慮到陰離子交換樹脂的吸附取決于被吸附物質的解離狀態,因此,筆者推測在中性pH值條件下DON主要以分子形式存在。
2.2 吸附參數的優化
由于環境因素如溫度、pH值等均會對大孔吸附樹脂的吸附容量產生影響,因此對吸附時的溫度、pH值均進行了初步優化。從圖2-A可以看出,隨著溫度的上升,DON的吸附容量逐漸降低。由于吸附過程在通常情況下是放熱行為,因此該現象符合勒夏忒列原理。從圖2-B可以看出,當吸附溶液pH值在7~8范圍內時,DON的吸附容量最高,但在一個較廣泛的pH值5~9范圍內,DON的吸附容量沒有明顯變化,說明DON在此pH值范圍內并無明顯解離現象。

表1 選用的樹脂及其理化性質
注:ND表示無可靠數據。
2.3 吸附行為熱力學研究
在描述吸附行為時,Langmuir吸附模型與Freundlich吸附模型是最為常用的2種熱力學模型。通常來說,Langmuir吸附模型更適合用于描述單分子層吸附行為。2種吸附模型的具體參數見表2。可以看出,在溫度為25 ℃條件下,XAD-4對DON的吸附行為更符合Langmuir吸附模型,其線性方程的相關系數達到0.999 7,而Freundlich吸附模型中線性方程的相關系數只有0.790 4。表明XAD-4樹脂對DON的吸附行為更符合單分子層吸附模式,XAD-4樹脂在25 ℃條件下對DON的理論最大吸附量為769.23 μg/g(圖3)。
2.4 洗脫條件的優化
由于乙醇溶液具有廉價易得、低毒環保的優點,因此通常情況下均采用乙醇溶液作為大孔吸附樹脂的洗脫溶液。本試驗中篩選了質量濃度范圍在10%~100%的乙醇溶液,分別考察其對XAD-4樹脂吸附DON的洗脫能力。從圖4-A可以看出,當乙醇濃度達30%時,其對DON的洗脫率已超過80%,因此,選擇30%乙醇溶液作為洗脫溶劑。

表2 XAD-4樹脂對DON吸附行為的Langmuir與Freundlich等溫吸附模型參數

之后又采用20 mL大孔吸附樹脂柱進行動態洗脫,洗脫溶劑為30%乙醇溶液,洗脫曲線見圖4-B,可見DON在 3 BV 范圍內即可基本洗脫完畢。
2.5 高速逆流色譜的最終純化
采用高速逆流色譜作為最終純化手段,選用相關文獻報道的溶劑體系[7],以乙酸乙酯-水(體積比=1 ∶1)作為雙相體系,采用有機相作為固定相,以水相作為流動相,對經過大孔吸附樹脂初步純化的樣品進行精制。從圖5可以看出,DON組分在150 min開始流出,至180 min基本結束。收集相關組分,經過N2吹掃出去部分溶劑后,采用低溫結晶的方法獲得DON晶體,通過HPLC及NMR檢測其純度,得到的DON晶體純度達 96.78%(圖6),最終回收率為76.20%。

3 結論與討論
本研究介紹了1種通過大孔吸附樹脂柱層析與高速逆流色譜聯用技術分離純化真菌毒素DON的方法,通過該方法可以獲得純度達96.78%的DON純品,并且一個批次可以制備超過500 mg毒素純品。該方法較為簡便,并且步驟較少,易于放大,因此有助于快速獲得大量毒素純品以供后續相關研究。
目前,大孔吸附樹脂純化技術常用于液體樣品的凈化處理,但限于DON毒素在液體培養基中產量較低,因此本研究采用大米發酵物作為毒素來源,導致雜質較多,前處理步驟較為繁瑣。在后續研究中,筆者計劃對液體發酵條件進行優化,同時擬對高產毒菌株進行基因操作,以期獲得能夠在液體培養基中大量產生毒素的菌株,便于進一步放大毒素生產規模。

