能量耦合存在于產(chǎn)甲烷菌甲基輔酶M還原酶MCR活化過程
周玉珍, 汪 偉, 金 皓, 姚 萍, 徐建明
(淮陰師范學(xué)院/江蘇省環(huán)洪澤湖生態(tài)農(nóng)業(yè)技術(shù)重點實驗室,江蘇淮安 223300)
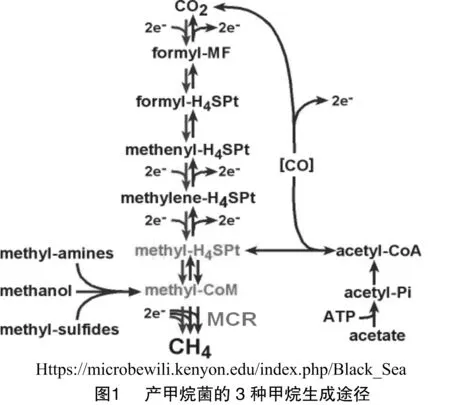
產(chǎn)甲烷菌轉(zhuǎn)化厭氧發(fā)酵的產(chǎn)品(如氫氣、二氧化碳、甲醇、甲酸和乙酸)為甲烷[1-2],同時除去生物氧化代謝過程中形成的氫氣(H2),從而促進(jìn)復(fù)雜的有機(jī)化合物(如木質(zhì)素,纖維素等)的降解。因此產(chǎn)甲烷菌在碳循環(huán)中發(fā)揮著關(guān)鍵的作用[3]。甲烷生成途徑非常復(fù)雜,大多數(shù)的步驟涉及很多產(chǎn)甲烷菌新穎獨特的輔因子[4-6]。產(chǎn)甲烷菌可以轉(zhuǎn)化各種一碳化合物為甲烷,底物不同,所用的甲烷生成途徑也不同(圖1) 。這3種途徑只有最后一步催化反應(yīng)共享,該反應(yīng)由甲基輔酶R還原酶(MCR)催化。由于MCR在產(chǎn)甲烷菌Methanothermobactermarburgensis細(xì)胞內(nèi)表達(dá)量很高(約占細(xì)胞總蛋白量的10%),MCR是第1個被純化的明確顯示參與甲烷生產(chǎn)途徑的酶[7-9]。它催化甲烷生成途徑中的最后一步,同時也是甲烷生成途徑中速率限制的一步。因此研究MCR的機(jī)理是研究產(chǎn)甲烷菌來人為抑制或加快其甲烷生成途徑的最有效方法。
MCR是一種含鎳的酶,它的催化作用需要產(chǎn)甲烷菌獨有的輔酶F430(鎳四吡咯)。MCR將甲基輔酶M(CH3-SCoM)、輔酶B(CoBSH)轉(zhuǎn)化為甲烷(CH4)和輔酶M與輔酶B的雜二硫(CoBS-SCoM),如公式(1)所示[10-11]。
CH3-SCoM+CoBSH→CH4+CoBS-SCoM;ΔG′=-30 kJ/mol。
(1)
MCR的輔酶F430有很低的氧化還原電勢(<-600 mV),而其活性狀態(tài)是還原狀態(tài)(鎳為+1價),細(xì)胞的培養(yǎng)液中只能加入氧化態(tài)的鎳(+2價),因此在體內(nèi)肯定存在二價鎳還原的過程,即MCR的活化過程。如果沒有添加強(qiáng)還原劑和輔酶HSCoM,以及對細(xì)胞進(jìn)行特殊的處理,裂解細(xì)胞將導(dǎo)致99%以上的MCR失去活性[12]。由于不能得到活性蛋白將無法研究其催化機(jī)理,因此研究MCR活化機(jī)理是研究其催化機(jī)理的首要條件。
研究顯示在細(xì)胞懸浮液中加入MCR的一個底物CH3—SCOM(或HSCoM)和檸檬酸鈦(Ⅲ)(Ti(Ⅲ)citrate,氧化還原電勢約-700 mV),并在破碎細(xì)胞前對懸浮細(xì)胞進(jìn)行通H2處理可以活化MCR[13]。H2/H+的氧化還原電勢(Eθ)約為 -420 mV,這個電勢遠(yuǎn)遠(yuǎn)高于MCR輔助因子的氧化還原電勢(<-600 mV)[9]。氫氣是如何活化MCR的,至今還是一個謎。由于CO/CO2的氧化還原電勢(-520 mV)比H2/H+低,CO能更快、更有效地還原MCR,而且其重復(fù)性好[9]。一般來說,由于H2/H+(-420 mV)和CO/CO2的氧化還原電勢(-520 mV)均高于MCR的輔酶F430的氧化還原電勢(<-600 mV),CO和H2是不可能還原MCR的。
2H++2e-→H2;Eθ=-0.42 V;
(2)
CO2+2H++2e-→CO;Eθ=-0.52 V;
(3)
CO2+2H++2e-→HCOOH;Eθ=-0.43 V。
(4)
在1988年,Bobik和Wolfe發(fā)現(xiàn)甲烷菌可以利用CO2和H2合成甲烷,細(xì)胞破碎液不能利用CO2和H2合成甲烷,然而在細(xì)胞破碎液里添加CoMS-SCoB就可以利用CO2和H2合成甲烷,并稱這種現(xiàn)象為RPG效應(yīng)[14]。后來他們發(fā)現(xiàn)在細(xì)胞破碎液里添加CH3-SCoM、富馬酸鹽(fumarate)、絲氨酸也可以使細(xì)胞破碎液利用CO2和H2合成甲烷[15-17]。在2008年,Thauer等首次提出用生物體內(nèi)生物能量耦合現(xiàn)象來解釋這個謎[18]。這種能量耦合利用放能過程來推動吸能過程。隨后Kaster等和Costa等先后證實了這種能量耦合存在于這種遠(yuǎn)古的產(chǎn)甲烷菌中,并推測生命的起源可能就是利用能量耦合而出現(xiàn)的[19-20]。Kaster等發(fā)現(xiàn)了在產(chǎn)甲烷菌中MvhADG/HdrABC復(fù)合物能耦合H2還原鐵氧化還原蛋白Fd(氧化還原電勢為-450~-500 mV)的吸能反應(yīng)和H2還原CoBS-SCoM的放能反應(yīng)[19]。
由于MCR的輔酶F430氧化還原電勢極低(<-600 mV),H2和CO是如何還原MCR的,這里筆者猜測H2和CO還原MCR的過程中也存在上述能量耦合反應(yīng)。本研究從幾個方面證實了這一猜想。
1 材料與方法
1.1 生化試劑、混合氣體和產(chǎn)甲烷菌的生長
所有的緩沖溶液、培養(yǎng)基和試劑都訂購于阿拉丁試劑(上海)有限公司,除非額外說明,均買分析純及以上的純度。溶液都采用超純水配制。液氮、N2(99.98%)、CO(99.99%)、H2/CO2(80%和20%)和超高純H2(99.999%)購于江蘇淮安瑞豐氣體有限公司。還原劑檸檬酸鈦(Ⅲ)是通過在30%(質(zhì)量百分比)的TiCl3溶液里添加檸檬酸鈉,并將pH值調(diào)至7.0配制而成[8]。檸檬酸鈦(Ⅲ)的濃度通過甲基紫精滴定測量[8]。產(chǎn)甲烷菌Methanothermobactermarburgensis(原稱M.thermoautophicumstrain Marburg)來自美國密西根大學(xué)Stephen W. Ragsdale實驗室。產(chǎn)甲烷菌M.marburgenesis的培養(yǎng)基按照以前的配方配制[8],需要時在培養(yǎng)基中添加不同濃度的鎢酸鈉和硒酸鈉來調(diào)節(jié)培養(yǎng)基中鎢和硒的濃度。產(chǎn)甲烷菌培養(yǎng)于65 ℃、10 L 發(fā)酵罐中,并用 H2/CO2(80%/20%)作為還原劑和碳源。
1.2 體內(nèi)活化MCR
所有溶液都是在嚴(yán)格厭氧條件下(氧氣<1 mg/L)的無氧操作臺里配制,并在無氧操作臺內(nèi)保存7 d以上才使用。厭氧操作臺的厭氧通過維持約9.0 kPa的氮氣來實現(xiàn)。M.thermautotrophics按照之前發(fā)表文章的方法用H2/CO2培養(yǎng)[7]。在回收細(xì)胞之前,在發(fā)酵罐通H230 min以活化MCR。然后,在無氧條件下離心回收細(xì)胞,并將細(xì)胞轉(zhuǎn)移到無氧操作臺。在無氧操作臺內(nèi)將細(xì)胞重懸于50 mmol/L Tris,pH值為7.6,加入10 mmol/L HSCoM、0.1 mmol/L 檸檬酸鈦(Ⅲ),并分裝到150 mL的無氧血清瓶中[7,21]。用CO或H2體內(nèi)活化MCR時,在重懸細(xì)胞分裝好后,立即在其頂部橡皮封口上通過針頭給血清瓶頂部空間通氣(CO或H2)10 min。為了使溶液中的氣體平衡,通氣過程中每2 min搖動血清瓶幾下。通氣結(jié)束后保存血清瓶內(nèi)約10.3 kPa的氣壓。隨后每次取樣之前也進(jìn)行同樣的通氣操作。每次通氣結(jié)束后,血清瓶倒置于無氧操作臺內(nèi)的25 ℃的水浴鍋內(nèi)以減少氣體流失[8]。通H2是在無氧操作臺內(nèi)完成的;出于安全考慮,通CO是在無氧操作臺外的通風(fēng)櫥里完成的。為了監(jiān)測MCR是否被活化及其活化的程度,于不同時間在無氧操作臺內(nèi)從血清瓶內(nèi)取 200 μL 樣品于EPR試管中,并在無氧操作臺內(nèi)用液氮迅速冷凍樣品后才移到無氧操作臺外的液氮罐中保存以備后續(xù)電子順磁共振光譜(EPR譜分析,EPR spectroscopy)檢測。
用甲酸鹽(formate)體內(nèi)活化MCR時,采用上述相同的步驟,只是在細(xì)胞重懸液中添加不同濃度的formate(formate的添加并沒有改變緩沖液的pH值)來取代上述通氣。
1.3 體外活化MCR
在體外活化MCR時,使用上述方法培養(yǎng)、回收和在無氧操作臺內(nèi)重懸細(xì)胞,并用JY92-2D超聲波細(xì)胞破碎機(jī)冰浴破碎細(xì)胞。設(shè)置超聲功率為220 W,超聲總時間為10 min,每次輻射時間為10 s,間隔時間為30 s。細(xì)胞破碎完畢的混合液用作細(xì)胞破碎液。細(xì)胞破碎液在無氧操作臺內(nèi)用離心機(jī)在4 ℃、35 000g離心30 min后,取上清液。用H2或CO在體外(細(xì)胞破碎液或上清液)活化MCR的操作步驟和上述體內(nèi)活化MCR相同。在檢測fumarate和CH3-SCoM對H2和CO體外活化MCR的作用時,在細(xì)胞破碎液或上清中直接加入fumarate和CH3-SCoM到所需濃度。
1.4 甲酸脫氫酶的酶活性測定和MCR的EPR波譜分析
甲酸脫氫酶的酶活性測定和MCR的EPR波譜分析是嚴(yán)格按照參考文獻(xiàn)[9]完成。
2 結(jié)果與分析
2.1 金屬離子鎢和硒能提高氫氣活化MCR的效果
MCR的活化最初是通過在細(xì)胞重懸液中通H2而實現(xiàn)的[22]。2013年,筆者研究發(fā)現(xiàn),CO由于具有更低的氧化還原電勢,能夠更有效地活化MCR;然而CO2/COOH有著與2H+/H2相似的氧化還原電勢卻不能活化MCR[9]。在甲烷2種形式的甲酸脫氫酶中,一種以鉬為活性中心,一種以鎢為活性中心,2種甲酸脫氫酶都有硒代半胱氨酸作為金屬活性中的一個配體。然而2013年筆者在甲酸鈉活化MCR時,培養(yǎng)甲烷菌的培養(yǎng)基里沒有添加鎢和硒[9],本研究檢測發(fā)現(xiàn)添加鎢和硒能使甲酸活化MCR。
為了檢測在培養(yǎng)基中添加鎢和硒能否提高甲酸脫氫酶的活性,從而使甲酸能夠活化MCR,在培養(yǎng)基中分別添加0.1、0.3、0.6、0.9、1.1、1.5、2.0、4.0、6.0 μmol/L的鎢和硒,回收細(xì)胞之后,通過在細(xì)胞重懸液中添加0.1 mol/L或 0.5 mol/L 的甲酸鈉來活化MCR。試驗結(jié)果顯示30 h內(nèi) 0.1 mol/L 或0.5 mol/L的甲酸鹽并不能活化MCR(添加 0.6 μmol/L 鎢和1.1 μmol/L硒的試驗數(shù)據(jù))(圖2)。本研究檢測添加鎢和硒后甲酸還原酶的活性發(fā)現(xiàn),在培養(yǎng)基中添加不同濃度的鎢和硒并沒有提高甲酸還原酶的活性[9]。當(dāng)用NADP+和甲基紫精(MV)作為電子受體時,甲酸還原酶的活性還是分別為3~4 、2~3 mU/mg。CO2/COOH與2H+/H2雖然有相似的氧化還原電勢,但是M.marburgenesis體內(nèi)氫化酶的活性是甲酸還原酶的20 000倍[9]。因此甲酸不能活化MCR很有可能是由于M.marburgenesis體內(nèi)甲酸還原酶的活性太低。
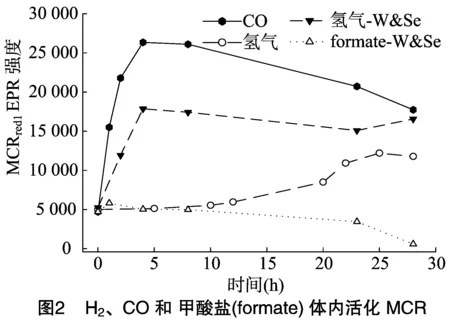
研究發(fā)現(xiàn),添加鎢和硒雖然不能使甲酸鹽活化MCR,卻能提高H2活化MCR的效果約65%,加快H2活化MCR的速度8倍(72 min和8 min),并且使得H2活化MCR沒有了滯后期。鎢和硒能如此有效地提高H2活化MCR的效果確實令人驚訝。然而Thauer等發(fā)現(xiàn),甲烷合成途徑中由甲酰基甲基呋喃脫氫酶催化的CO2和H2合成甲酰基甲基呋喃的吸能反應(yīng)和由異二硫還原酶催化的異二硫CoMS-SCoB和H2合成SHCoM和CoBSH的放能反應(yīng)通過能量耦合完成(圖3)[18]。由于甲酰基甲基呋喃脫氫酶在甲烷菌種也有2種形式的酶,分別以鉬和硒或鎢和硒為活化中心(圖4)。因此添加鎢和硒很有可能大大提高了甲酰基甲基呋喃脫氫酶(催化甲烷合成途徑的第1步反應(yīng))的活性,從而加快了以氫化酶為媒介的由甲酰基甲基呋喃脫氫酶催化的吸能反應(yīng)和由異二硫還原酶催化的放能反應(yīng)之間的能量耦合反應(yīng),證實了能量耦合反應(yīng)存在于H2活化MCR的吸能過程中。


在M.marburgenesis的細(xì)胞破碎液中添加CH3-SCoM、CoBS-SCoM使得其細(xì)胞可緩慢利用CO2合成甲烷[15,17]。這一現(xiàn)象被稱為RPG效應(yīng),其實質(zhì)是CH3-SCoM、CoBS-SCoM的加入使得甲酰基甲基呋喃脫氫酶催化的吸能反應(yīng)和由異二硫還原酶催化的放能反應(yīng)之間的能量耦合反應(yīng)成為可能[14]。后來發(fā)現(xiàn)在M.marburgenesis的細(xì)胞破碎液中添加fumarate和絲氨酸(serine)也可以使細(xì)胞緩慢地利用CO2合成甲烷,而且證實這也是能量耦合反應(yīng)的結(jié)果[15]。Kaster等發(fā)現(xiàn)甲烷合成途徑中由甲酰基甲基呋喃脫氫酶催化的CO2和H2合成甲基呋喃和水的吸能反應(yīng)和由異二硫還原酶催化的異二硫CoMS-SCoB和H2合成CoMSH和CoBSH的放能反應(yīng)通過能量耦合完成[19]。而且只有CoBS-SCoM存在的條件下H2才能還原鐵氧化還原蛋白。因此推測類似于RPG效應(yīng)的能量耦合反應(yīng)存在于H2活化MCR的吸能過程中。
圖3引自文獻(xiàn)[19]。短橫線部分顯示氫化酶(MvhADG)通過鐵氧化還原蛋白(Fd)能量耦合由甲酰基甲基呋喃脫氫酶催化的甲烷合成途徑的第1步。
2.2 CH3-SCoM,fumarate使H2能在體外活化MCR
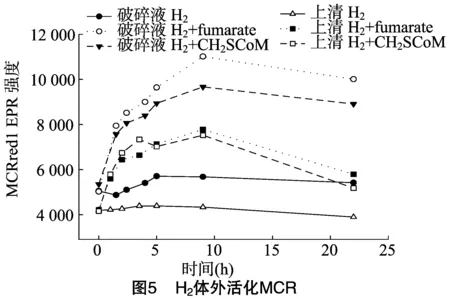
就像細(xì)胞破碎液在沒有添加可以進(jìn)行能量耦合反應(yīng)的小分子時不能利用CO2合成甲烷一樣,H2也不能在細(xì)胞破碎液或上清中活化MCR。為了證實類似于RPG效應(yīng)的能量耦合反應(yīng)是否存在于H2活化MCR的吸能過程中,在細(xì)胞破碎液或上清中添加fumarate或CH3-SCoM。由于金屬離子鎢和硒能提高氫氣活化MCR的效果,在此試驗過程中,細(xì)胞培養(yǎng)時其培養(yǎng)基中添加了0.6 μmol/L鎢和 1.1 μmol/L 硒。本研究發(fā)現(xiàn),在細(xì)胞破碎液中添加10 mmol/L fumarate和 10 mmol/L CH3-SCoM時,能使H2在細(xì)胞破碎液中活化MCR,其MCR的活化程度分別為體內(nèi)活化的48%、34%;在上清中添加10 mmol/L fumarate和10 mmol/L CH3-SCoM時,也能使H2在上清中活化MCR,其MCR的活化程度分別為體內(nèi)活化的29%、27%(圖5)。
2.3 CH3-SCoM、fumarate使CO體外活化的MCRred1更穩(wěn)定
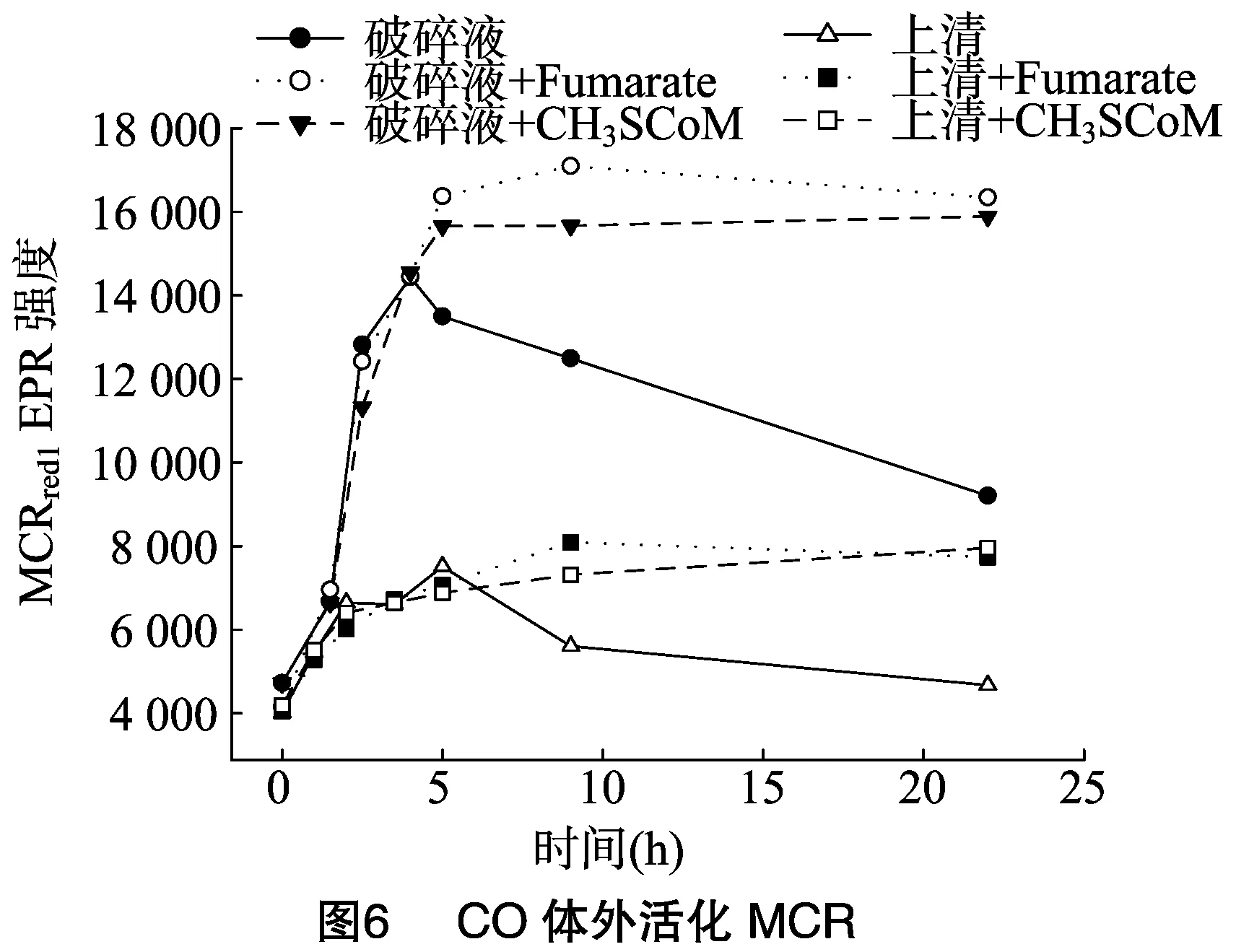
不像H2、CO能在體外活化MCR。CO在細(xì)胞破碎液和上清中活化MCR的程度分別為體內(nèi)活化的41%、16%,然而CO體外活化的MCR不穩(wěn)定,4 h后活化的MCR開始失活,但是細(xì)胞破碎液或上清中添加10 mmol/L fumarate和 10 mmol/L CH3-SCoM可以使得體外CO活化的MCR更穩(wěn)定,20小時左右未見MCR失活(圖6)。
3 結(jié)論與討論
建立一種有效活化MCR的方法對研究甲烷天然合成機(jī)理相當(dāng)關(guān)鍵,因為MCR催化甲烷是天然合成途徑中速率限制的一步[8]。目前為止,MCR的活化只能通過體內(nèi)H2或CO活化完成,因為CO/CO2有著更低的氧化還原電勢,其活化效果優(yōu)于H2。然而理論上來說,H2和CO都不能活化MCR,因為兩者的標(biāo)準(zhǔn)氧化還原電勢都高于MCR輔酶F430中心的 Ni(Ⅰ) 的標(biāo)準(zhǔn)氧化還原電勢。
本研究發(fā)現(xiàn),在培養(yǎng)基添加鎢和硒可以加快H2活化MCR的速度8倍,提高H2活化MCR的效率約65%。經(jīng)過分析發(fā)現(xiàn),鎢和硒的加入很有可能提高了甲酰基甲基呋喃脫氫酶酶活性,因而提高了以氫化酶為媒介的由甲酰基甲基呋喃脫氫酶催化的吸能反應(yīng)和由異二硫還原酶催化的放能反應(yīng)之間的能量耦合反應(yīng),證實了能量耦合反應(yīng)存在于H2活化MCR的吸能過程中。
產(chǎn)甲烷菌可以還原CO2合成甲烷,然而人們發(fā)現(xiàn)其細(xì)胞破碎液只有在添加CH3-SCoM、CoBS-SCoM、fumarate等小分子時才能還原CO2合成甲烷,這一現(xiàn)象在當(dāng)?shù)乇环Q為RPG效應(yīng)[23-24]。后來人們發(fā)現(xiàn)這種RPG效應(yīng)是因為CH3—SCoM、CoBS-SCoM、fumarate等小分子的加入使得甲酰基甲基呋喃脫氫酶催化的吸能反應(yīng)和由異二硫還原酶催化的放能反應(yīng)之間的能量耦合反應(yīng)成為可能,才使得甲烷合成途徑得以進(jìn)行[19,25-26]。這種RPG效應(yīng)與H2活化MCR非常相似,H2可以在體內(nèi)活化MCR,而不能再體外活化MCR。為了證實RPG效應(yīng)的這種能量耦合是否也存在于H2或CO活化MCR的過程中,本研究在體外活化MCR時添加了CH3—SoM或fumarate,結(jié)果發(fā)現(xiàn)體外活化MCR時添加了CH3—SoM或fumarate使H2能夠在體外活化MCR(為體內(nèi)活化MCR的30%~40%),讓CO體外活化的MCR更穩(wěn)定。這都說明H2和CO活化MCR的過程中存在能量耦合反應(yīng),正是這種能量耦合反應(yīng)使得氧化還原電勢較高的H2(-420 mV)和CO(-520 mV)能還原氧化還原電勢較低的MCR的活性中心F430(<-600 mV)。
- 江蘇農(nóng)業(yè)科學(xué)的其它文章
- 區(qū)域形象、區(qū)域文化認(rèn)同與農(nóng)產(chǎn)品區(qū)域品牌購買行為
——情景因素的調(diào)節(jié)作用 - 農(nóng)業(yè)供給側(cè)結(jié)構(gòu)性調(diào)整內(nèi)生動能培育研究:基于共享農(nóng)業(yè)的視角
- 省部共建國家重點實驗室建設(shè)與運(yùn)行思考
- 不同收入水平新型職業(yè)農(nóng)民培訓(xùn)需求差異
——以河北省為例 - 城鎮(zhèn)化建設(shè)質(zhì)量提升的科技訴求及供應(yīng)不足的成因與對策
- 超富集植物紫蘇活性炭的磷酸法制備與性能表征

