代謝綜合征合并心肌梗死大鼠模型的建立及氧化應激相關機制的探討
張毅,任夢萌,方濤,邸研博,崔曉旭,劉勇,賀晶,國欣濤,田鳳石△
代謝綜合征(metabolic syndrome,MS)是以中心性肥胖、動脈粥樣硬化、血脂異常、高血壓、高血糖或糖調節受損等多種癥狀聚集于同一個體的臨床癥候群[1]。心肌梗死(MI)作為冠心病死亡的主要原因,具有較高的致死率[2]。MS各組分作為冠心病的危險因素,可增加MI等缺血事件的發生風險,且MS合并MI較單純MI患者的預后更差,MS患者并發心血管疾病的死亡率是非MS患者的2~3倍[3]。目前,國內對有關MS合并MI模型的建立及其心肌損傷機制相關報道較少。本研究旨在建立一種符合臨床實際、效果理想的MS合并MI模型,并分析MS合并心肌梗死后心肌組織氧化應激水平及左室功能的變化,以期為臨床研究MS合并MI后左室功能損傷的病理生理機制及防治提供必要的動物實驗依據。
1 材料與方法
1.1 實驗動物及分組 4周齡無特定病原體(SPF)級雄性OLETF(otsuka long-evans tokushima fatty,為自發性2型糖尿病鼠種)大鼠18只(MS組),同品系、同周齡的正常非糖尿病雄性 LETO(long-evans tokushima otsuka)大鼠18只(對照組),體質量170~185 g,由日本大冢制藥株式會社德島研究所提供,于中國醫學科學院放射醫學研究所屏障環境內飼養,24 h內自由飲食水。
1.2 MS大鼠模型制備 以標準飼料適應性飼養2周后,對照組LETO大鼠飼以普通飼料,MS組OLETF大鼠飼以高脂飼料。每周記錄大鼠體質量,繪制其生長曲線;每周取大鼠尾靜脈血,利用拜安康血糖儀(拜耳公司)測定空腹血糖(大鼠饑餓16 h后)及餐后血糖水平;每周行口服葡萄糖耐量試驗[4](oral glucose tolerance test,OGTT),分別于0、30、60、90及120 min測定尾靜脈血糖值。根據OLETF大鼠團隊制定標準[5]:OGTT血糖峰值>16.7 mmol/L和糖負荷2 h后血糖>11.1 mmol/L,二者同時具備診斷為2型糖尿病(type 2 diabetes mellitus,T2DM),達到其中一項為糖耐量減低(impaired glucose tolerance,IGT)。每2周內眥靜脈取血,分離血清,全自動生化分析儀檢測總膽固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)水平;應用ALC-NIBP型無創血壓測量儀(上海奧爾科特生物科技有限公司)測定收縮壓和舒張壓。MS模型成功建立標準[6]為:在IGT的基礎上,MS組大鼠尤其是24周時體質量、TG、TC、血壓升高明顯高于對照組,差異有統計學意義。待MS組大鼠飼養至24周成模后,進行下一步分組及相關實驗。
1.3 MS合并MI大鼠模型制備 對Gao等[7]心臟冠狀動脈左前降支結扎模型制作方法進行改良,整個操作過程控制在2 min內完成,盡可能減少對大鼠的創傷,具體操作方法:大鼠以10%水合氯醛麻醉后,Sham組及MS-sham組只開胸穿線不結扎左前降支;MI組及MS-MI組左側胸部備皮,嚴格無菌消毒,鋪無菌洞巾,備高壓滅菌手術器械。大鼠采取右側臥位,將其舌拉伸至口外,防止麻醉后舌后墜。沿左4~5肋間距胸骨0.3 cm處行橫切口,鈍性剝離暴露心臟,局部利多卡因浸潤并輕柔擠出于切口外。以5-0 mersilk針帶線于左心耳下緣繞前降支穿過并結扎,深度約1 mm、寬度1.5 mm。術畢予保溫措施待其麻醉蘇醒,并行青霉素肌內注射預防感染。MI模型成功建立標準為心電圖示Ⅰ、Ⅱ導聯持續ST段抬高。
1.4 超聲心動圖 大鼠在心肌梗死模型制備后24 h行超聲心動圖檢查。在麻醉狀態下使用VEVO2100型超高分辨率小動物超聲實時分子影像系統(Visual Sonics公司)測量左心室舒張末期內徑(left ventricular end-diastolic dimension,LVEDD)、左心室收縮末期內徑(left ventricular end-systolic dimension,LVESD)、左心室短軸縮短率(left ventricular fraction shortening,LVFS)、左心室射血分數(left ventricular ejection fractions,LVEF)。
1.5 標本采集 各組大鼠在心肌梗死模型制備后72 h,每組取4只經10%水合氯醛麻醉后,取股動脈血5 mL,4℃、3 000 r/min離心15 min取上清液置于-80℃冰箱保存待測;取左心室心肌組織300 mg,預冷的PBS漂洗2遍后均分為三等分迅速置于-80℃冰箱保存待測。
1.6 心肌組織氧化應激指標的檢測 取大鼠左心室心肌組織100 mg,冰上勻漿,于4℃、12 000 r/min離心15 min取上清液,根據試劑盒說明書采用分光光度法檢測心肌組織中氧化應激指標谷胱甘肽過氧化物酶(glutathione peroxidase,GSHPx)、總抗氧化能力(total antioxidant capacity,T-AOC)、髓過氧化物酶(myeloperoxidase,MPO)、丙二醛(malondialdehyde,MDA)。所有試劑盒均購自南京建成生物工程公司。
1.7 Western blotting檢測心肌組織中硫氧還原蛋白(TRX)、硫氧還原蛋白相互作用蛋白(TXNIP)表達 取上述大鼠左心室心肌組織100 mg,冰上勻漿,于4℃、12 000 r/min離心15 min取上清液,BCA法檢測總蛋白濃度,免疫印跡法檢測TRX和TXNIP表達情況。應用Image Lab進行圖像分析,測定灰度值。目的條帶與對應的β-actin條帶總灰度的比值作為半定量結果,進行統計學分析。所用的一抗和二抗均購自于英國Abcam公司,稀釋比為一抗1∶2 000,二抗1∶5 000。
1.8 Real-time PCR檢測心肌組織中TRX、TXNIP mRNA表達 上述大鼠左心室心肌組織50 mg,利用RNeasymini kit(美國Qiagen公司)提取心肌總RNA,采用Takara逆轉錄試劑盒合成cDNA并置于-20℃保存備用。引物由北京奧科生物技術公司設計并合成,見表1。根據QuantiFast SYBR Green RT-PCR Master(one step)試劑盒說明書進行 Real-time PCR,反應參數:95℃預變性 5 min;95℃變性 10 s,59~62℃退火 30 s,72℃延長30 s,40個循環;72℃延伸10 min。以β-actin作為內參。

Tab.1 The information of RT-PCR primers表1RT-PCR引物信息
1.9 統計學方法 采用SPSS 17.0統計學軟件進行數據分析,采用Graphpad Prism 6.0軟件系統分析、作圖;符合正態分布的計量資料以均數±標準差(±s)表示,2組間比較采用t檢驗,不同因素對檢測指標的影響采用析因設計的方差分析,以P<0.05為差異有統計學意義。
2 結果

Fig.1 Body weight and OGTT test in control rats and MS rats圖1 2組大鼠體質量及OGTT試驗
2.1 MS大鼠模型相關指標 MS組及對照組大鼠體質量自第6周起至24周逐漸升高,前者增長速度明顯快于后者,從高脂飼養后的第6周(鼠齡12周)至18周(鼠齡24周),MS組大鼠的體質量均高于對照組,見圖1A。OGTT試驗顯示,MS組大鼠各時間點血糖值均高于對照組,無論是MS組還是對照組,血糖的峰值均未達到16.7 mmol/L,但是MS組的120 min血糖高于11.1 mmol/L,提示MS組大鼠發生了IGT,而對照組大鼠未發生IGT(圖1B)。在大鼠24周齡時,MS組的空腹血糖、餐后血糖、TC、TG、收縮壓、舒張壓均明顯高于對照組(P<0.05),提示MS大鼠造模成功,可以進行心肌梗死造模,見表2。
Tab.2 Comparison of blood glucose,blood lipid and blood pressure between control rats and MS rats表2 2組大鼠血糖、血脂及血壓指標比較 (n=18,±s)
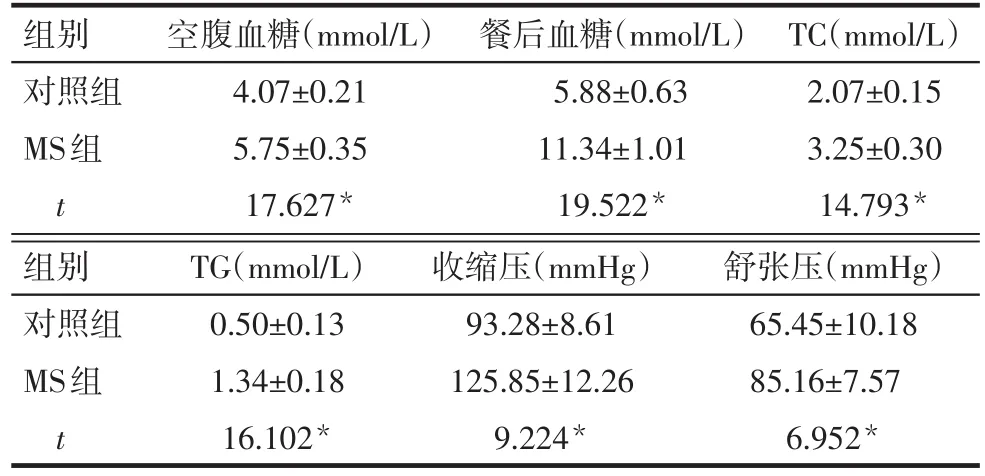
Tab.2 Comparison of blood glucose,blood lipid and blood pressure between control rats and MS rats表2 2組大鼠血糖、血脂及血壓指標比較 (n=18,±s)
*P<0.05;1 mmHg=0.133 kPa
組別對照組MS組t空腹血糖(mmol/L)4.07±0.21 5.75±0.35 17.627*餐后血糖(mmol/L)5.88±0.63 11.34±1.01 19.522*TC(mmol/L)2.07±0.15 3.25±0.30 14.793*組別對照組MS組t TG(mmol/L)0.50±0.13 1.34±0.18 16.102*收縮壓(mmHg)93.28±8.61 125.85±12.26 9.224*舒張壓(mmHg)65.45±10.18 85.16±7.57 6.952*
2.2 MS合并MI模型大鼠左室功能評價 心梗造模的手術存活率為88.89%(16/18)。析因分析結果顯示,MS和MI對大鼠的LVEDD、LVESD、LVFS、LVEF均有影響(P<0.05),兩者對大鼠的LVEDD、LVFS、LVEF有交互效應(P<0.05),見表3。
Tab.3 Left ventricular function evaluation after operation in each group of rats表3 各組大鼠術后左室功能評價 (±s)

Tab.3 Left ventricular function evaluation after operation in each group of rats表3 各組大鼠術后左室功能評價 (±s)
*P<0.05
組別Sham組MS-Sham組MI組MS-MI組析因分析n9988 LVEDD(mm)7.30±0.37 7.56±0.49 9.25±0.30 10.15±0.47 LVESD(mm)5.18±0.46 5.49±0.32 7.50±0.39 8.14±0.29 LVFS(%)32.63±1.53 31.83±0.80 19.25±1.26 15.72±0.16 LVEF 0.61±0.02 0.58±0.03 0.37±0.05 0.30±0.01 FMS FMI FMS*MI 16.806*252.853*4.970*13.898*375.491*1.594 33.865*1 547.796*13.592*22.062*587.914*5.185*
2.3 心肌組織氧化應激指標的變化 析因分析結果顯示,MS和MI對大鼠心肌組織的GSH-Px、TAOC、MPO、MDA均有影響(P<0.05),兩者交互作用對大鼠心肌組織的T-AOC和MDA有影響(P<0.05),見表4。
2.4 心肌組織中TRX、TXNIP蛋白和mRNA表達變化 析因分析結果顯示,MS和MI對TRX和TXNIP蛋白和mRNA水平均有影響(P<0.05),兩者僅對TXNIP mRNA水平有交互作用(P<0.05);見圖2,表5。
Tab.4 Comparison of oxidative stress related indexes of myocardial tissue between four groups of rats表4 大鼠造模后心肌組織氧化應激相關指標比較 (±s)
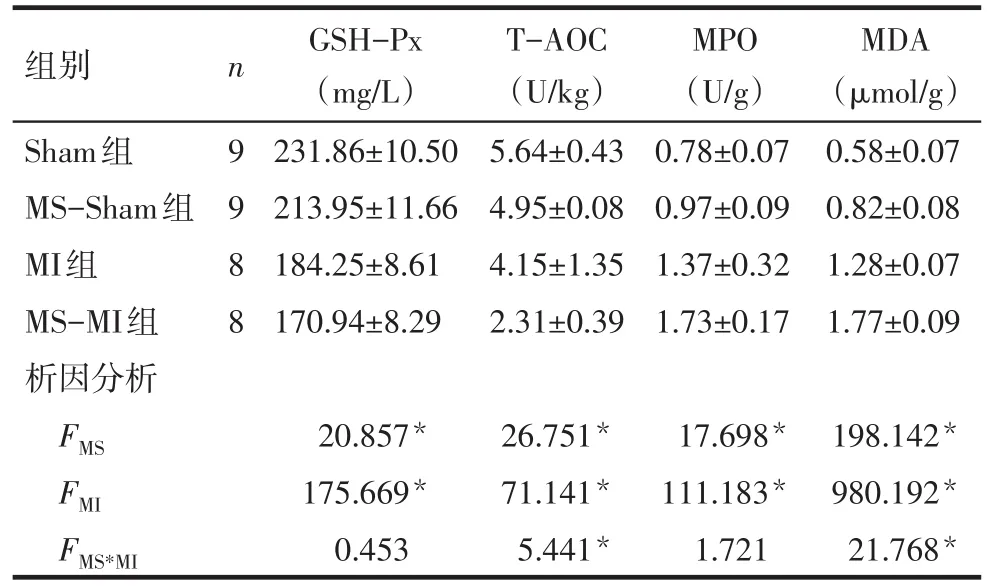
Tab.4 Comparison of oxidative stress related indexes of myocardial tissue between four groups of rats表4 大鼠造模后心肌組織氧化應激相關指標比較 (±s)
*P<0.05
組別Sham組MS-Sham組MI組MS-MI組析因分析n 9988 GSH-Px(mg/L)231.86±10.50 213.95±11.66 184.25±8.61 170.94±8.29 T-AOC(U/kg)5.64±0.43 4.95±0.08 4.15±1.35 2.31±0.39 MPO(U/g)0.78±0.07 0.97±0.09 1.37±0.32 1.73±0.17 MDA(μmol/g)0.58±0.07 0.82±0.08 1.28±0.07 1.77±0.09 FMS FMI FMS*MI 20.857*175.669*0.453 26.751*71.141*5.441*17.698*111.183*1.721 198.142*980.192*21.768*

Fig.2 The protein expression levels of TRX and TXNIP in myocardial tissue of each rat group圖2 各組大鼠術后心肌組織TRX、TXNIP蛋白表達變化

Tab.5 The protein and mRNA expression levels of TRX and TXNIP in myocardial tissue of each rat group表5 各組大鼠術后心肌組織TRX、TXNIP蛋白及mRNA的表達變化
3 討論
建立穩定、合理、可復制性強的MS動物模型對于MS基礎研究至關重要,本研究選取兼顧基因遺傳型及環境誘導型特點的OLETF大鼠作為動物模型,其多食、易患肥胖、高胰島素血癥、高脂血癥和高血糖癥,可較好地模擬人類MS自然病程[8]。本研究中,24周齡MS大鼠OGTT試驗中各個時間點的血糖均顯著高于對照組,提示MS組大鼠出現胰島素抵抗現象且伴有IGT,此外24周齡MS組大鼠體質量、空腹血糖、餐后血糖、TC、TG水平較對照組LETO大鼠顯著增高并伴有明顯高血壓,以上現象符合文獻報道的MS特征[6],表明大鼠MS造模成功,可進行下一步心肌梗死造模實驗。本研究心肌梗死造模采用結扎大鼠冠狀動脈左前降支的方式,具有周期短、精確定位梗死部位,操作便捷等優點;且手術過程未使用小動物呼吸機、未插管,簡化操作程序[7],整個過程于3 min內完成,同時也增加了實驗操作難度,對實驗者提出了較高技術要求,必須反復訓練,但對于肥胖MS大鼠,此種微創技術避免了氣管插管、切斷肋骨等二次創傷,提高術后存活率。
MS作為多種心血管危險因素的集合體,其組分如肥胖、高血壓、血脂代謝紊亂、糖耐量異常等均為心血管疾病的危險因素,與非MS患者比較,MS罹患心血管疾病、急性心肌梗死等事件的危險程度顯著增加,作為MS最嚴重的合并癥之一MI住院患者MS患病率高達51.7%[9]。臨床及動物水平的研究均顯示,MS的危險因素如胰島素抵抗、血脂異常、炎癥因子、氧化應激等在心肌梗死及梗死后進一步心功能損害中發揮重要作用[10]。超聲心動圖是檢測心肌梗死直觀而可靠的方法[11],在本研究中,大鼠心肌梗死術后經超聲心動圖檢測左室功能,析因分析結果顯示,MS和MI對大鼠的LVEDD、LVESD、LVFS、LVEF均有影響,兩者交互作用會進一步影響大鼠的左室功能(主要為LVEDD、LVFS、LVEF),提示本研究MI造模成功且MS可以加重心肌梗死造成的左室功能降低。
氧化應激是指機體在受到缺血、缺氧等不利因素時,體內生成過量、高濃度的活性氧自由基(reactive oxygen species,ROS)及活性氮 自由基(reactive ntrogen species,RNS),并由其引起的細胞凋亡、組織損傷的病理生理反應,被認為是包括心血管疾病、MS、心肌缺血及心肌梗死等一系列疾病的危險因素[12]。生理情況下,為避免體內聚集高濃度ROS,自由基清除系統發揮著重要作用。作為抗氧化系統重要組成部分,GSH-Px可迅速清除機體內過量的ROS[13],T-AOC是體內非酶性和酶性抗氧化物的總和,其為各抗氧化物之間協同保護作用的體現,可反映機體抗氧化酶的功能狀態,可間接反映機體所受氧化應激的損傷程度,其含量與細胞抗氧化能力呈正相關,與機體脂質過氧化程度呈負相關[14]。MDA是氧自由基作用于膜上多不飽和脂肪酸發生過氧化反應的終末代謝產物,可直接破壞細胞膜,可間接反映細胞的損傷程度[15]。氧化酶MPO的活性可在一定程度上反映機體受到氧化應激損傷的狀況[16]。本課題組前期研究發現,高脂飲食誘導的MS大鼠,其心肌組織已出現損害[4]。本研究通過檢測各組大鼠心肌組織中的GSH-Px、T-AOC、MPO、MDA水平,析因分析結果顯示,MS和MI對大鼠心肌組織的GSH-Px、T-AOC、MPO、MDA均有影響,兩者交互作用會進一步影響大鼠的心肌組織的氧化應激水平(主要為T-AOC和MDA),提示MS可加重心肌梗死造成的心肌組織氧化應激水平增高。
TRX作為體內的一種重要的二硫鍵還原酶,是細胞內具有氧化還原活性的可溶性酸性小分子蛋白,能夠清除ROS、還原蛋白質以恢復機體生理功能。除此之外,TRX還具有抗凋亡、調控基因表達和抗炎等作用。硫氧還原蛋白系統是機體一種對抗氧化應激,維持氧化還原反應的平衡系統。TXNIP為TRX功能和表達的負性調節因子,可下調TRX表達,進而加劇氧化應激[17]。免疫印跡和Real-time PCR實驗的析因分析結果顯示,MS和MI對TRX和TXNIP蛋白和mRNA水平均有影響,兩者交互作用僅對TXNIP mRNA水平有影響,兩者的共同作用可以分別影響TRX和TXNIP的蛋白及mRNA水平,并且兩者單獨作用都會引起心肌組織中TRX和TXNIP表達水平的變化,因此不能忽視MS本身對心肌組織硫氧還原系統的影響。蛋白轉錄及翻譯機制復雜,在心肌組織中,MS是慢性改變,MI是急性改變,兩者作用于TRX和TXNIP表達的具體機制仍需進一步探討。此外,心肌氧化應激水平受多種途徑調控,MS在引起心肌組織硫氧還原系統破壞的同時可能通過調節其他信號通路發揮作用,并在心肌梗死的過程中發揮促進氧化應激水平、破壞左室功能的作用。
綜上所述,在發生了MI后,MS會進一步加劇心肌梗死造成的左室功能下降及心肌組織氧化應激水平增高。分析其原因可能部分與破壞硫氧還原系統的穩定有關,氧化應激水平的增高進一步提高心肌損傷并影響左室功能,另外,MS對TRX和TXNIP的蛋白和mRNA水平均有影響,提示MS可能從轉錄水平影響了TRX和TXNIP的表達,但MS調控硫氧還原系統的機制及MS是否會通過其他信號通路在心肌梗死時發揮作用還需進一步探討。通過高脂飲食喂養OLETF大鼠并利用結扎冠狀動脈左前降支的方法制作MS合并心肌梗死模型的方法簡便、實用性強,符合MS合并心肌梗死臨床發病實際情況。TRX系統穩定性被破壞可能是MS加重心肌組織氧化應激水平及左室功能下降的內源性機制之一。本課題組將進一步深入研究MS合并心肌梗死后可能影響心肌功能的信號通路,為臨床治療MS合并心肌梗死提供新的方向。

