反式-4-羥基-L-脯氨酸發酵菌株的篩選
李春玲,丁亞蓮,謝文靜,牛春,張萍
(寧夏泰瑞制藥股份有限公司,銀川 750101)
反式-4-羥基-L-脯氨酸(trans-4-hydroxy-L-proline, Hyp),簡稱羥脯氨酸,是一種稀有亞氨基酸,在醫藥保健、材料化工、食品營養和護膚美容等行業都具有廣泛的應用[1-3]。值得關注的是,Hyp是膠原蛋白的組成成分,也是肝和膽囊的構成成分, 具有多種生理功能和生物活性,對維持動物正常生理代謝、提高體內營養物質利用效率起著重要作用[4-6]。目前,Hyp的生產方法有三種,即生物組織提取法、化學合成法和微生物合成法。生物組織提取法是利用動植物組織作為原料,通過系列化學方法回收得到Hyp[7]。目前,該方法是國內生產Hyp的主要方法,但存在生產和純化步驟多、雜酸含量高、產率低、成本高、環境污染大、廢水廢渣難處理等諸多問題[5]。化學合成法多以(S)-芐氧甲基環氧乙烷為原料,通過系列化學反應,最終生成Hyp。該方法存在原材料成本高,生產過程中會使用有毒性物質等問題,實際生產已經棄用[8]。微生物合成法即微生物發酵法,是通過微生物細胞發酵表達反式-4-脯氨酸羥化酶(trans-4-proline hydroxylase),將游離的L-脯氨酸(L(-)-proline,)轉化為Hyp的生產方法。與前兩種方法相比,微生物發酵法具有反應所需能耗低、專一性極強、無副產物、原材料來源廣泛、不使用或很少使用有毒物質、環境污染小等優點[8-10]。
采用生物組織提取法生產Hyp的方法已經不符合我國日益嚴峻的環保形式,而且有限的動植物資源也嚴重制約了本行業的發展。化學合成法工藝復雜,成本較高,且環境污染嚴重。因此,采用微生物發酵法生產Hyp將成為未來發展的必然趨勢。但是,國內有關Hyp的微生物發酵法研究起步較晚,僅見盛花開[11]、袁春偉[12]、劉合棟[13]等關于基因工程菌株構建、初級發酵條件優化的研究,鮮見工業化生產目的菌株篩選相關報道。鑒于此,實驗以工業化生產應用為目的,對引進的8株產Hyp菌株的生長特性、發酵效率進行比較分析,以期篩選出優良菌株,為實現Hyp微生物發酵工業化生產奠定一定基礎。
1 材料與方法
1.1 材料 出發菌株為8株含有重組質粒的產Hyp大腸桿菌,由寧夏泰瑞制藥股份有限公司技術中心引進保存。胰蛋白胨、酵母提取物購自Oxoid公司,瓊脂粉購自Sigma公司,其他試劑均為國產分析純。
活化平板(LB固體):包含胰蛋白胨、酵母提取物、氯化鈉,pH7.0~7.2,瓊脂粉。抗性平板(LB固體):包含胰蛋白胨、酵母提取物、氯化鈉、瓊脂粉、抗性RL,pH7.0~7.2。抗性培養基(LB液體):包含胰蛋白胨、酵母提取物、氯化鈉、瓊脂粉、滅菌冷卻后添加抗性RL,pH7.0~7.2。非抗性培養基(LB液體):包含胰蛋白胨、酵母提取物、氯化鈉、瓊脂粉,pH7.0~7.2。Hyp搖瓶培養基(MCG):包含葡萄糖、甘油、尿素、玉米漿、K2HPO4、KH2PO4、MgSO4·7H2O、FeSO4·7H2O、MnSO4·4H2O、ZnSO4·7H2O、VB1、抗性RL、L-脯氨酸,pH 7.4。發酵罐(50 L)培養基:葡萄糖、甘油、尿素、玉米漿、K2HPO4、KH2PO4、MgSO4·7H2O、FeSO4·7H2O、MnSO4·4H2O、ZnSO4·7H2O、VB1、抗性RL、L-脯氨酸,pH7.4。
恒溫大幅振蕩搖床(HQL150C,武漢科學儀器廠)、恒溫培養箱(LHP160,江蘇杰瑞爾電器有限公司)、分光光度計(BECKMANDU-600)、高效液相色譜系統(Waters)。
1.2 方法
1.3.1 菌種活化 將冷藏于-80 ℃冰箱的菌種取出,室溫融化,接種環劃線接種于活化平板上,30 ℃培養過夜,用活化后的菌種制備斜面種子,保存待用。
1.3.2 菌株重組質粒穩定性測定 參照盛花開等的方法[11],活化后的菌種接至裝30 mL抗性培養基的三角瓶(規格250 mL)中,30 ℃、220 r/min、搖床培養20 h后轉接非抗性培養基,連續轉接6次,取菌液梯度稀釋至10-6,涂布至活化平板,然后挑單菌落接種至抗性平板,統計質粒留存率。質粒留存率=生長菌落數/點接菌落數×100%。
1.3.3 種子制備 活化后的菌種挑取單菌落,接種至裝有30 mL抗性培養基的三角瓶(規格250 mL)中,30 ℃、220 r/min、搖床培養10 h。
1.3.4 菌株生長曲線測定 取種子液3.6 mL接種于裝有60 mL抗性培養基的三角瓶(規格500 mL)中,間隔2 h取發酵液,連續取樣12次,以ddH2O為對照,測定樣液在600 nm吸光值,作生長曲線。
1.3.5 菌株全細胞酶活測定 參照劉合棟等的方法[13],取發酵液1.5 mL,12000 r/min離心2 min;棄去上清液,回收菌體,加入500 μL酶反應緩沖液(MES 240 mmol/L、L-脯氨酸20 mmol/L、α-酮戊二酸40 mmol/L、硫酸亞鐵4 mmol/L、Vc 8 mmol/L)重懸菌體細胞,混勻,30 ℃ 220 r/min、搖床培養15 min后,沸水浴2 min,終止酶反應,測定Hyp濃度,分析細胞全酶活性。定義1個單位酶活為1 min將1 nmol/L L-脯氨酸完全轉化為反式-4-羥脯氨酸的酶量,單位為U。全細胞酶活是每mg干菌體的酶活,單位為U/mg。
1.3.6 Hyp濃度測定 參照盛花開等的方法[11],取發酵時間24~48 h的發酵液,每隔4 h取樣1次,利用高效液相色譜法測定Hyp濃度。液相條件:C18柱(200 mm×4.6 mm),流動相為乙腈∶水=5∶95,流速為1.0 mL/min,柱溫為室溫。
2 結 果
2.1 菌株重組質粒穩定性分析 8株菌株經活化后,對其菌株重組質粒穩定性進行測定分析,結果發現編號Hyp-Y1801、Hyp-Y1805、Hyp-Y1808的菌株重組質粒的留存率均超過95%,重組質粒穩定性較好,作為出發菌株(表1)。

表1 菌株重組質粒穩定性Tab 1 Stability of recombinant plasmid in strains
2.2 菌株生長曲線分析 對Hyp-Y1801、Hyp-Y1805、Hyp-Y1808菌株的發酵生長曲線進行分析發現,三菌株均在發酵4 h時進入對數生長期,在2 h
后進入平穩期,對數期約為8 h(圖1)。種子培養時間確定為10 h。
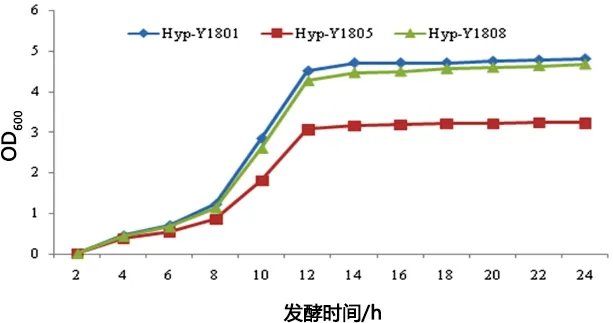
圖1 菌株生長曲線分析Fig 1 Strain growth curve analysis
2.3 菌株全細胞酶活分析 取Hyp-Y1801、Hyp-Y1805、Hyp-Y1808平穩期(12 h)發酵液,對菌株全細胞酶活進行分析發現,Hyp-Y1801、Hyp-Y1805、Hyp-Y1808全細胞酶活分別為0.076、0.037、0.071 U/mg,其中Hyp-Y1801、Hyp-Y1808酶活較高。
2.4 菌株發酵效率分析 以Hyp-Y1801、Hyp-Y1808為生產菌株進行發酵小試,每隔4 h取樣1次,測定發酵液中Hyp的濃度,以此確定菌株的生產效率。表2結果表明,隨著時間延長Hyp的濃度逐漸升高,發酵44 h時Hyp濃度達到最高,分別為50.4 g/L、47.5 g/L。

表2 菌株發酵效率Tab 2 Fermentation efficiency of strains
3 分析與討論
目前,國內主要依靠生物組織提取生產Hyp,該方法存在最主要的問題是產物的得率很低,僅為4%~7%,而且產生大量排放物,帶來巨大的環保風險,這些問題大大限制了該技術規模化應用[6],導致國內Hyp生產發展十分緩慢,生產規模較小,產量極其有限。但是,隨著Hyp的廣泛應用,市場對其需求急劇增加。微生物發酵法生產技術具有成本低、效率高等優勢,采用該技術開展Hyp規模化、高效化生產,是未來發展的必然。目前,國內尚未見微生物發酵法工業化生產Hyp的報道。
Hyp生產的發酵菌株主要包括細菌、霉菌以及鏈霉菌等,其中對大腸桿菌(細菌)發酵菌株研究較多,應用較為成熟[8]。本研究引進了8株產Hyp大腸桿菌菌株,并對其發酵生產性能進行系統分析。引進的產Hyp大腸桿菌為基因工程菌株,菌體所含的重組質粒負責編碼Hyp合成的關鍵酶。重組質粒的穩定性是保障Hyp發酵生產的根本。本研究發現, Hyp-Y1801、Hyp-Y1808菌株重組質粒的穩定性很好,留存率均超過了95%,可以有效保障Hyp發酵生產的順利進行。在此基礎上,本研究對菌株的生長特性、全細胞酶活和生產效率進行了分析,發現Hyp-Y1801、Hyp-Y1808發酵4 h時,進入對數生長期,在12 h后進入平穩期,對數期約為8 h,這與盛花開[11]、劉合棟[13]等的研究報道較一致。Hyp-Y1801菌株的全細胞酶活較高,且發酵效價達到了50.4 g/L,較袁春偉[12]、劉合棟[13]等報道的高18.6%,較Shibasaki等[8]報道的高22.9%,具有較好的實際生產應用潛力。有關Hyp-Y1801中試生產試驗正在進行之中,菌株的優良特性在規模化生產中的實際表現還有待進一步驗證。

