脂餐負荷前后AGEs和DHEAS變化及其與動脈硬化關系的實驗研究
,, ,,
目前,動脈硬化(AS)仍是導致人類死亡與殘疾的主要原因。氧化應激,即機體內抗氧化物質與包括活性氧(ROS)、活性氮、非自由基及自由基等在內的氧化物質之間的失衡[1]。20世紀50年代,人們在損傷血管中就已經檢測到被過度氧化的脂質與蛋白質,至今氧化應激已被廣泛認為是血管內皮損傷、動脈硬化發生發展的關鍵機制[2]。脂質代謝異常是動脈硬化最重要的危險因素,其主要發病機制為高脂血癥引起ROS增多與一氧化氮(NO)減少,從而導致機體處于氧化應激狀態[3]。晚期糖基化終末產物(AGEs)通過直接修飾蛋白質、脂質、核酸等物質或與其受體相互作用的方式誘導氧化應激反應[4],而硫化脫氫表雄酮(DHEAS)則可通過多機制抗氧化作用延緩動脈動脈硬化的發展。本研究觀察不同階段動脈硬化的脂餐負荷前后AGEs與DHEAS水平變化及其與動脈硬化的關系。
1 材料與方法
1.1 實驗對象和動脈粥樣硬化模型建立 實驗對象為健康雄性新西蘭大白兔10只(3月齡,體重2.5~3 kg,購于山西省畜牧研究所),高脂喂養12周,高脂飼料含1%膽固醇(北京索萊寶科技有限公司,中國)、8%蛋黃、91%基礎飼料,且于初始及第4周、8周、12周分別給予高脂餐負荷,其中含2%膽固醇、8%蛋黃、90%基礎飼料。
1.2 血漿AGEs、DHEAS水平檢測 在實驗初始及第4周、8周、12周時,于禁食后12 h及脂餐負荷后2 h、4 h、6 h、8 h,經耳緣靜脈取血4 mL收集于分離膠促凝管,用自動生化分析儀離心機(BECKMAN,美國)3 000 r/min離心15 min,取上清于EP管中-80 ℃保存待測。全部實驗結束時,采用酶聯免疫吸附法(ELISA)測定血清AGEs、DHEAS水平(AGEs、DHEAS試劑盒 上海西唐生物科技有限公司)。
2 結 果
研究結束時,實驗動物均出現腹主動脈粥樣硬化病變。動脈硬化過程中脂餐負荷前后血清AGEs、DHEAS變化情況詳見表1、表2。
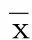
表1 動脈硬化過程中脂餐負荷前后AGEs水平變化(±s) ng/mL
與同周空腹相比,1)P<0.05;與初始相比,2)P<0.05
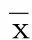
表2 動脈硬化過程中脂餐負荷前后DHEAS水平變化(±s) ng/mL
與同周空腹相比,1)P<0.05;與初始相比,2)P<0.05
3 討 論
血管壁中過量的ROS主要來自還原型煙酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶[5],增加的ROS使得血管內皮功能障礙,巨噬細胞聚集、激活,脂質過氧化等,誘導動脈粥樣硬化及相關心臟事件發生。研究發現高脂飲食顯著增加AGEs的含量[6],高水平的AGEs可通過激活NADPH氧化酶[7]、降低內皮型一氧化氮合酶(eNOS)及NO的生物利用度[8]等途徑導致體內ROS過量蓄積,引起脂質過氧化。DHEAS由腎上腺皮質產生,是血液中主要的類固醇激素,被人們譽為“超級激素”或“青春之泉”,其一方面能夠直接改善動脈粥樣硬化病人血管壁的病理學過程[9],另一方面,其抗氧化活性可降低血漿脂質過氧化物[10]。Sumiko等[11]發現在男性中血清DHEAS水平與頸動脈最大內中膜厚度、平均內中膜厚度呈負相關;國內外多位學者研究顯示,冠狀動脈造影異常病人血清DHEAS水平較對照組明顯降低,且與冠狀動脈粥樣硬化的程度呈負相關[12-13]。因此,通過測定AGEs、DHEAS水平可反映高脂飲食后體內氧化與抗氧化能力。高脂血癥是AS的危險因素,但多年來空腹階段的血脂水平一直是人們的關注點,是評判高脂血癥的主要標準。早在1979年Zilversmit[14]就提出了“餐后階段是致AS發生的關鍵時期”的論點,人類每天的規律飲食使得血脂水平在多數時間處于較高狀態,而且一次高脂飲食會加劇下一餐餐后血脂升高的程度,進而影響整天血脂水平[15]。研究表明,餐后高脂血癥導致AS形成并促進其發展,是一種重要的致AS因素,是冠心病的獨立危險因素,能更好地預測冠心病[16]。
與既往研究結論一致,持續高脂飲食可誘導氧化應激發生,且明顯加重于單次脂餐負荷后。本研究發現隨著高脂飼料喂養時間延長,兔血清AGEs于4周時明顯增高,12周最高,DHEAS呈遞減趨勢,說明長時間高脂飲食增強機體內氧化應激,減弱其抗氧化能力。本實驗于動脈硬化不同階段予以脂餐負荷后,血清AGEs在初始餐后8 h、4周與8周餐后4 h明顯增高,DHEAS于初始餐后8 h、4周餐后2 h、6 h及8周餐后2 h明顯降低,提示在動脈硬化各階段急性大量攝入脂肪均會導致機體氧化應激反應加強、抗氧化能力減弱。因此,無論是健康人群,或是心血管疾病高危人群均應按照“膳食寶塔”均衡飲食結構,不可長期高脂飲食,也不可短時間暴飲暴食。
此外,受實驗樣本量、實驗動物個體差異及實驗時間的限制,關于動脈粥樣硬化過程中脂餐負荷對氧化應激的影響尚需進一步研究。

