外源性抑制Wnt信號通路對BMP-2誘導的人牙髓細胞向成牙本質分化的影響
浦鐵民,韓亞琨
(1吉林醫藥學院附屬醫院,吉林 132011;2中國醫科大學)
外界刺激可誘發牙本質的形成或修復。修復性牙本質形成過程中,人牙髓細胞(HDPC)分化為成牙本質樣細胞取決于多種因子與信號通路的調控[1]。骨形態發生蛋白(BMP)在成牙本質細胞分化過程中發揮重要作用。另外,堿性磷酸酶(ALP)、牙本質基質蛋白(DMP-1)和牙本質涎磷蛋白(DSPP)等目前已作為判斷HDPC牙本質細胞分化的分子標志[2]。然而,目前對調節牙髓成牙本質細胞分化的分子信號研究仍有限。相關研究顯示,Wnt 信號在細胞增殖和分化過程中發揮廣泛的調控作用[3]。2017年11月,本研究擬探討外源性抑制Wnt人信號通路對BMP2誘導的HDPC向成牙本質分化的影響。現報告如下。
1 材料與方法
1.1 材料 HDPC購自ATCC。10%FBS、Heracell VIOS 160i CO2細胞培養箱、BCA蛋白濃度檢測試劑盒、ABI 7500型實時熒光定量PCR系統、Quantity One軟件(德國賽默飛世爾科技公司),DKK-1蛋白(上海鑫樂生物科技有限公司),青霉素、鏈霉素、DMEM培養基(美國GIBCO公司),乙醇胺、MgCl2(北京拜爾迪生物技術有限公司),對硝基苯磷酸(上海寶曼生物科技有限公司),DSPP、DMP-1抗體(巴傲得生物科技有限公司),核固紅(上海恒遠生物技術發展有限公司),核蛋白提取試劑盒(北京基萊生物科技有限公司),TRIzol reagent、反轉錄試劑盒、SYBR Green(大連寶生物工程有限公司),蛋白提取試劑盒(北京泰澤瑞達科技有限公司),β-catenin抗體(美國CST中國分公司),LAMIN A單克隆抗體(上海翊圣生物科技有限公司),二抗 IgG、Odyssey?紅外成像系統(LI-COR Biosciences公司),多功能酶標儀(Bio-Rad,上海伯樂生命醫學產品有限公司)。
1.2 HDPC細胞形態觀察 將HDPC細胞系置于在含有10%FBS,100 U /mL青霉素和100 mg/mL鏈霉素的DMEM培養基中,置于37 ℃、5%CO2的細胞培養箱中培養。于鏡下觀察細胞。
1.3 HDPC 預處理及分組 取傳至第三代的細胞,以3×104細胞/孔分別接種至4個24孔板中,于37 ℃ 5%CO2的細胞培養箱培養。當細胞密度接近70%時,將細胞分為三組,每組8孔:對照組(對照組),不做任何特殊處理;單純BMP-2誘導組(單純誘導組)將培養液更換為BMP-2誘導液(將BMP-2溶于完全培養基中,配成濃度為100 ng/mL的培養液),連續培養;Wnt抑制劑DKK-1處理后再誘導組(抑制劑處理組)于培養基中加入DKK-1蛋白至終濃度為100 ng/mL,培養24 h后,將培養液更換為BMP-2誘導液,連續培養。
1.4 各組細胞核β-catenin蛋白表達檢測 細胞培養10 d后,收集培養細胞,利用核蛋白提取試劑盒提取細胞核蛋白,具體操作參照試劑盒說明書。BCA蛋白濃度檢測試劑盒檢測核蛋白濃度。10%SDS-PAGE電泳分離蛋白,全濕法轉至PVDF膜。5%脫脂乳4 ℃封閉過夜,PBS緩沖液洗膜,β-catenin抗體(1∶100稀釋)或LAMIN A單克隆抗體(1∶1 000稀釋)作為一抗,室溫孵育膜3 h,PBS緩沖液洗膜。室溫條件下,二抗 IgG(1∶20 000稀釋)孵育2 h,PBS緩沖液洗膜,高壓ddH2O洗膜,Odyssey?紅外成像系統對蛋白表達量進行分析。使用Quantity One軟件分析蛋白表達。
1.5 ALP活性檢測 采用PNPP偶氮法檢測。收集細胞至預冷PBS緩沖液中冰浴,1 500 r/min離心6 min。取上清,利用ALP混合物(0.1 mol/L乙醇胺、1 mmol/L MgCl2和10 mg/mL對硝基苯磷酸)37 ℃孵育30 min,加入氫氧化鈉終止反應,多功能酶標儀于410 nm處讀取光密度值。
1.6 鈣化結節數量計算 采用Von Kossa染色。收集細胞,加入5%硝酸銀溶液處理細胞,暴露細胞于紫外光線下30 min,5%硫代硫酸鈉中和2 min,蒸餾水洗滌細胞5 min。細胞核固紅染色1 min。每組細胞隨機選擇8個區域,40倍鏡下觀察,利用Scion Image軟件(Scion Corp.)對染色密度進行定量分析。
1.7 各組細胞DSPP、DMP-1 mRNA和蛋白表達檢測 應用實時熒光定量PCR檢測各組細胞DSPP、DMP-1 mRNA相對表達。使用TRIzol reagent試劑盒提取總RNA,利用反轉錄試劑盒將總RNA反轉錄為cDNA,以GADPH為內參,使用SYBR Green于ABI 7500型實時熒光定量PCR系統進行實時熒光定量。每個樣品設置3個重復孔,2-ΔΔCt法計算分析結果。應用蛋白免疫印跡法檢測各組細胞DSPP、DMP-1蛋白表達。應用蛋白提取試劑盒提取細胞總蛋白,具體操作參照試劑盒說明書。BCA蛋白濃度檢測試劑盒檢測總蛋白濃度。10%SDS-PAGE電泳分離蛋白,轉膜。5%脫脂乳4 ℃封閉過夜,洗膜,DSPP、DMP-1抗體(1∶200稀釋)或β-actin單克隆抗體(1∶1 000稀釋)作為一抗,室溫孵育膜3 h,洗膜。熒光二抗IRDye 680RD donkey anti-mouse IgG(1∶20 000稀釋)孵育2 h,洗膜,Odyssey?紅外成像系統對蛋白表達量進行分析。使用Quantity One軟件分析蛋白表達。DSPP正向引物5′-AATTTGCATCTCCTAGC-3′,反向引物5′-GAAAAACTCTTCCCTCC-3′;DMP-1正向引物5′-TTCATTGGGCATAGATTTC-3′,反向引物5′-TACCTGGTTACTGGGAGAG-3′;GADPH正向引物5′-GCTCTCTGCTCCTCCTGTTC-3′,反向引物5′-CATCGCCCCACTTGATTTTG-3′。
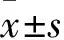
2 結果
2.1 HDPC形態 顯微鏡下觀察,HDPC細胞培養至第2天時,數量增加,形態不一,多呈多角性、梭形。培養至第4天時,細胞增殖迅速,排列緊密,細胞融合率達90%,可進行傳代。
2.2 各組細胞核β-catenin蛋白表達比較 對照組、抑制劑處理組、單純誘導組HDPC核β-catenin蛋白表達量分別為1.00±0.18、0.25±0.04、0.67±0.09;與對照組相比,單純誘導組、抑制劑處理組中HDPC細胞核β-catenin蛋白表達均下調(P均<0.05);與單純誘導組相比,抑制劑處理組中HDPC細胞核β-catenin蛋白表達下調(P<0.05)。
2.3 各組ALP活性比較 對照組、抑制劑處理組、單純誘導組ALP活性分別為1.00±0.05、2.21±0.13、1.40±0.11;與對照組相比,單純誘導組、抑制劑處理組ALP活性增加(P均<0.05);與單純誘導組相比,抑制劑處理組ALP活性增加(P<0.05)。
2.4 各組細胞鈣化結節數量比較 對照組、抑制劑處理組、單純誘導組Von Kossa染色密度定量值分別為1.23±0.77、0.41±0.15、0.20±0.07;與對照組相比,單純誘導組、抑制劑處理組鈣化結節數量增加(P均<0.05);與單純誘導組相比,抑制劑處理組鈣化結節數量增加(P<0.05)。
2.5 各組細胞DSPP、DMP-1表達比較 與對照組相比,單純誘導組、抑制劑處理組中DSPP、DMP-1 mRNA與蛋白表達均增加(P均<0.05);與單純誘導組相比,抑制劑處理組DSPP、DMP-1 mRNA與蛋白表達增加(P<0.05)。見表1。

表1 各組DSPP、DMP-1表達比較
注:與對照組相比,*P<0.05;與抑制劑處理組相比,#P<0.05。
3 討論
牙髓細胞具有可塑性和多向分化潛能的能力,其分化潛能是牙髓牙本質復合體對損傷應答及形成修復性牙本質的決定性因素[4]。骨形態發生蛋白(BMP)可刺激成牙本質細胞分化和牙本質基質分泌,從而促進修復性牙本質的形成[5]。相關研究證實,BMP-2具有誘導成牙本質細胞分化的作用[6]。本研究證實,BMP-2可誘導HDPC成牙本質向分化,與過往研究一致。
Wnt信號通路參與細胞增殖、遷移及分化的調節,在多種組織干細胞分化過程中發揮重要調控作用[7]。Cho等[8]研究發現,內源性Wnt信號通路可促進人脂肪基質細胞增殖和抑制成骨分化。β-catenin是經典Wnt信號通路中關鍵因子,細胞核內β-catenin表達可直接反映該通路活性。近來研究發現,經典Wnt/β-catenin信號通路參與牙根發育過程[9]。在經典Wnt信號通路中,Wnt與 FZD、LRP-5/6受體結合形成復合體,引起DVL聚集及Axin的降解,酪蛋白激酶Iε對DVL進行磷酸化,磷酸化的DVL與Frat1結合抑制GSK-3β活性,GSK-3β、Axin、APC結合受抑,導致β-catenin發生核內轉移,從而影響一系列相關蛋白表達。DKK-1是經典Wnt信號通路常用競爭性抑制劑之一。本研究發現,抑制劑處理組中HDPC細胞核β-catenin蛋白表達量顯著下調,提示抑制劑處理組DKK-1成功抑制細胞Wnt信號通路。
成牙本質細胞分化與礦化前期需經歷細胞增殖與細胞外基質的合成時期,在此階段可檢測到基質成熟蛋白和特異性蛋白的表達,如ALP,由于發生成牙本質細胞分化的細胞中ALP高于未分化的細胞,因此ALP被認為是成牙本質細胞分化的早期標志物[10]。本研究發現,抑制劑處理組ALP活性較對照組、單純誘導組增加,差異有統計學意義,與von Kossa染色結果一致,同時抑制劑處理組鈣化結節數量顯著增加,提示抑制Wnt信號通路活化能促進BMP-2誘導成牙本質細胞分化過程。
DSPP、DMP-1是判斷成牙本質細胞分化的重要指標。DSPP屬于非膠原基質,為牙本質和骨特異性基因,在牙本質礦化和牙齒發育中起重要作用,但DSPP合成后即被酶切為DSP和DPP[11]。Jia等[12]研究發現,在成牙本質細胞分化過程中,DSPP基因突變可致礦化平衡紊亂,造成嚴重的牙本質疾病。DMP-1屬于牙本質特異性磷酸性蛋白,于成牙本質細胞分化早期發生特異性表達,通常與DSPP協同判斷成牙本質細胞分化情況[13]。本研究結果顯示,抑制劑處理組細胞中DSPP、DMP-1 表達顯著增加,提示Wnt信號通路發生抑制可促進BMP-2誘導成牙本質細胞分化過程中DSPP和DMP-1的表達。
綜上所述,外源性抑制Wnt信號通路,可促進BMP-2誘導HDPC分化為成牙本質細胞。

