PARP抑制劑PJ34在綠膿菌素引起的巨噬細胞損傷中的作用
祝飛美 何瑾晨 黃寧 王祎
(四川大學華西基礎醫學與法醫學院病理生理學教研室,四川 成都 610041)
銅綠假單胞菌(Pseudomonasaeruginosa,PA)是一類易引起多種急慢性感染的革蘭陰性機會致病菌,該菌分泌的綠膿菌素(Pyocyanin,PCN)是一種具有氧化還原活性的吩嗪類物質,可自由穿透生物膜[1],通過產生活性氧(Reactive oxidant species, ROS)消耗細胞內還原性GSH并通過抑制細胞內抗氧化信號通路的活化引起廣泛的細胞氧化應激損傷,進一步引起細胞功能紊亂,導致包括中性粒細胞[2]、肺上皮細胞[3]等多種細胞死亡。巨噬細胞在PA感染引起的一線免疫應答反應中起重要作用[4],但目前關于PCN對巨噬細胞的損傷作用及機制知之甚少,因此,深入探討PCN介導的巨噬細胞損傷的具體機制,對于研究新型的免疫輔助藥物和解毒藥物對抗銅綠假單胞菌感染治療具有重要意義。
瞬時受體電位2(Transient receptor potential melastain 2,TRPM2)通道廣泛表達于多種免疫細胞表面,能被二磷酸腺苷核糖以及H2O2刺激產生的活性氧自由基ROS激活而開放,介導Ca2+離子內流入單核細胞、巨噬細胞、中性粒細胞等,從而進一步引起細胞死亡[5]。PJ34是DNA修復蛋白(poly(ADP-ribose)polymerase,PARP)的抑制劑,可以有效阻斷活性氧自由基ROS引起的細胞膜上TRPM2通道[6]。本文擬選用小鼠腹腔來源巨噬細胞RAW264.7作為細胞感染模型,探討TRPM2離子通道抑制劑PJ34在PCN引起的氧化應激損傷中的作用,為綠膿菌素感染的治療提供新的思路。
1 材料與方法
1.1 試劑與細胞
MTT (Beyotime公司);胎牛血清(Hyaline公司);DMEM(Gebico公司);RAW264.7細胞均購自上海中科院細胞中心,培養在含10%胎牛血清的DMEM培養基中。
1.2 方法
1.2.1 MTT細胞毒性實驗
收集對數生長期RAW264.7細胞制成單細胞懸液,按4×104個細胞·孔-1接種于96孔板,過夜培養后更換含不同濃度PJ34(0,100,200,400,800,1600 nM)或者含不同濃度PCN(0,12.5,25,50,100 μ)的新鮮培養基100 μL。處理24 h后,每孔加入5 mg·mL-1MTT溶液10 μL,于37℃、5%CO2孵箱中避光孵育2 h,棄去孔中培養液,每孔加入150 μL DMSO溶解底部藍色結晶,搖床避光震蕩10 min后上機,于595nm處檢測吸光度,每次試驗重復3次。細胞生長抑制率
1.2.2熒光顯微鏡和流式細胞術測定細胞內ROS水平
RAW264.7細胞按照每孔16×104個·孔-1接種于24孔板,過夜后800 nM PJ34預處理2 h(對照組給與0.1% DMSO))加入100 μ的PCN孵育3 h后,PBS洗3次,更換新鮮培養基,加DHE10 μ每孔37 ℃孵育20 min,OLYMPUS倒置熒光顯微鏡IX73(Ex/Em=518 nm/605 nm)觀察。另收集細胞采用流式細胞儀檢測細胞內DHE熒光強度。
1.2.3 激光共聚焦顯微鏡觀察細胞內Ca2+水平
取激光共聚焦培養皿,按照每皿1×105個細胞/孔接種。過夜后800 nM PJ34預處理2 h(對照組給與0.1%DMSO),加入 100 μ的PCN孵育3 h,HBSS緩沖液洗3次,后每孔加Rhod-/AM(5 μ),37 ℃孵育30 min,激光共聚焦顯微鏡(Zeiss LMS 710)下觀察細胞內Ca2+水平。
1.2.4 熒光顯微鏡觀察巨噬細胞吞噬功能
RAW264.7細胞按照每孔16×104個·孔-1接種于24孔板,過夜后800 nM PJ34預處理2 h(對照組給與0.1% DMSO),加入100 μ的PCN孵育3 h后,加入18 μg·mL-1碳顆粒繼續共孵育2 h,顯微鏡下觀察巨噬細胞吞噬碳顆粒的情況。
1.2.5 統計學分析
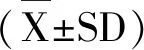
2 結果
2.1 細胞毒性實驗
結果如圖1A所示,當采用PJ34(0,100,200,400,800,1600 nM)處理RAW264.7細胞24 h,對細胞活力無顯著影響。但PCN(25,50,100 μ)顯著降低RAW264.7細胞存活率,并呈一定的濃度依賴趨勢,如圖1B所示。在PCN 100 μM處理24 h的條件下,與空白組相比較,細胞的存活率僅有31%-35%,具有顯著性統計學差異(P<0.01)。并且與單用PCN 100 μM組相比較,PJ34預處理組的細胞存活率明顯較高(P<0.01)。
2.2 PCN對RAW264.7細胞內ROS和Ca2+水平的影響及PJ34的作用
熒光顯微鏡觀察各組細胞內ROS的水平,結果如圖2A所示,PCN未處理時,細胞內ROS水平較低,PCN(100 μM)刺激3 h,PJ34未預處理組與預處理組比較,細胞內ROS水平明顯較高。流式細胞術檢測結果如圖2C,800nM的PJ34預處理可有效緩解PCN刺激引起的細胞內ROS水平升高(P<0.05)。根據文獻報道,細胞內的ROS水平與Ca2+水平密切相關,PCN能通過調節細胞線粒體膜的通透性增加細胞內Ca2+水平,從而對細胞產生進一步的氧化應激損傷[7]。激光共聚焦熒光顯微鏡下觀察細胞內Ca2+水平結果如圖2B所示,PCN刺激下,細胞內ROS水平的增加伴隨著細胞內Ca2+水平的升高,而PJ34可有效抑制PCN引起的細胞內Ca2+水平增加。

圖1 PJ34 和PCN 對RAW264.7細胞活力的影響注:A:不同濃度PJ34對RAW264.7細胞的影響;B:不同濃度PCN對RAW264.7細胞活力的影響;C:PJ34對PCN誘導的巨噬細胞存活率的影響。n=6,與未用PJ34 預處理組比較,*P﹤0.05;**P﹤0.01;***P<0.001。

圖2 PJ34對PCN引起的RAW264.7細胞內ROS和Ca2+水平的影響注:A和C:PJ34對RAW264.7細胞內ROS水平的影響;B:PJ34對RAW264.7細胞內Ca2+水平的影響。與單用PCN組比較,*P﹤0.05。
2.3 PJ34緩解PCN引起的巨噬細胞吞噬功能損傷
巨噬細胞是重要的免疫細胞,其主要功能之一是清除吞噬病原體或外來物質。為了研究PCN及PJ34對巨噬細胞吞噬功能的影響,我們采用PBS制備合適濃度的碳粒,經超聲處理,得到18 μg·mL-1的碳顆粒混懸液,在各處理組條件下加入18 μg·mL-1碳顆粒混懸液與細胞共孵育,顯微鏡下觀察巨噬細胞吞噬碳粒的情況。如圖3A所示,在PCN未處理組,巨噬細胞對碳顆粒的吞噬能力較強,當給與100 μ的PCN處理3 h后,巨噬細胞幾乎喪失吞噬碳顆粒的能力,而PJ34預處理則可提高由PCN引起的RAW264.7細胞吞噬功能損傷(P<0.05)。各處理條件下巨噬細胞吞噬碳粒的統計學分析結果如圖3B所示。

圖3 PCN及PJ34對RAW264.7細胞吞噬功能的影響A:顯微鏡下觀察各處理組細胞吞噬碳粒的能力;B:Image J統計分析各處理組細胞吞噬碳粒的水平。與PCM-100 μm相比,*P<0.05;**P<0.01。n=3。
3 討論
在現階段世界范圍內廣泛爆發的多重耐藥銅綠假單胞菌感染以及治療策略嚴重缺乏的嚴峻形勢下,研發新的補充治療策略迫在眉睫。而目前國內外關于PA感染以及PCN感染的研究多集中在肺泡上皮細胞及中性粒細胞,關于PCN對單核巨噬細胞的研究報道較少。同時越來越多的研究表明,廣泛分布于免疫細胞表面的TRPM2離子通道在炎癥小體的活化,ROS的產生以及肺部炎癥和疼痛等過程中發揮著非常重要的作用[8]。這些研究結果強烈提示研究TRPM2離子通道在免疫細胞中的信號傳導機制對于多種疾病意義重大。因此在本研究中我們提出假設,TRPM2通道的活化是PCN介導的巨噬細胞損傷的重要機制。
PARP是廣泛表達于真核細胞內的DNA修復蛋白,PARP的表達活化是氧化應激引起的細胞內NAD+增高,TRPM2通道開放及TRPM2通道依賴的鈣離子轉運的必要條件[9]。在PARP-1敲除細胞中,氧化應激刺激不能引起細胞的TRPM2通道開放[10,11]。在本研究中,我們采用PARP抑制劑PJ34預處理細胞,抑制巨噬細胞表面TRPM2通道的開放,觀察其對PCN引起的細胞損傷的作用。我們的研究結果顯示銅綠假單胞菌分泌的毒力因子綠膿菌素能誘導巨噬細胞RAW264.7細胞內的ROS水平和Ca2+水平升高,并導致巨噬細胞的吞噬功能損傷,最終引起巨噬細胞死亡。而當給與PJ34預處理后,PCN對巨噬細胞的毒性損傷作用得到有效緩解,PCN引起的ROS水平和Ca2+水平增高得到抑制,對巨噬細胞吞噬功能的損傷作用減弱,并提高了PCN刺激下巨噬細胞的存活率。
本研究結果提示細胞膜TRPM2離子通道在免疫細胞抵抗外來應激時發揮的重要作用,可以明確的是本研究通過PARP抑制劑PJ34阻斷TRPM2離子通道的活化,抑制由于該離子通道活化引起的細胞內鈣離子水平失衡,可以有效緩解PCN感染條件下的巨噬細胞死亡,維持PCN狀態下巨噬細胞的吞噬功能,保護巨噬細胞氧化應激損傷,為綠膿菌素感染的治療提供了新的思路,也為TRPM2離子通道在氧化應激疾病發病中的作用提供有力證據。

