豆茶決明沖劑對高脂飲食誘導的肥胖C57BL/6J小鼠的相關炎癥因子及炎癥通路的影響
關云霞 張秋華 王丹 付彥君 王卉


[摘要] 目的 探討豆茶決明沖劑對高脂誘導C57BL/6J肥胖小鼠炎癥因子及炎癥通路的影響及對高脂所致肥胖胰島素抵抗的改善作用。 方法 C57BL/6J小鼠90只適應性喂養2周后,隨機預留對照組,其余小鼠高脂飼料喂養2周,隨機分成模型組、豆茶決明沖劑低、中、高劑量組(LD、MD、HD;0.1、0.3、0.9 g/kg)、羅格列酮組(RH)。除對照組外,其余5組給予高脂飼料,每周稱體重。每天灌胃1次,給藥8周后,摘眼球取血,測空腹血糖、胰島素和血脂,取腹部、附睪及雙腎部位脂肪。采用ELISA法檢測相關炎癥因子,采用蛋白質免疫印跡法(Western Blot)檢測IKK-β/NFκB、JNK通路蛋白的表達。 結果 豆茶決明沖劑能顯著抑制高脂誘導C57BL/6J小鼠體重的增長。豆茶決明沖劑能降低空腹血糖(FPG)、空腹胰島素(INS),改善胰島素抵抗指數(IRI);試劑盒實驗結果顯示豆茶決明沖劑能使LDL-C、TC、TG顯著降低,HDL-C明顯升高。ELISA結果顯示豆茶決明沖劑能顯著降低瘦素(leptin,LEP)、白介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)、單核細胞趨化蛋白-1(MCP-1)水平,升高脂聯素(ADPN)水平;Western Blot結果顯示,豆茶決明沖劑高劑量組對激活的IKK-β/NFκB、JNK通路有明顯的抑制作用。 結論 豆茶決明沖劑能抑制由高脂飲食誘導的肥胖以及相關炎癥因子的分泌和炎癥通路的激活,改善胰島素抵抗。
[關鍵詞] 豆茶決明沖劑;肥胖;炎癥因子;炎癥通路;胰島素抵抗
[中圖分類號] R285.5? ? ? ? ? [文獻標識碼] A? ? ? ? ? [文章編號] 1673-9701(2019)07-0033-06
[Abstract] Objective To discuss the effects of cassia nomame granules on inflammatory factors and inflammatory pathways in obese C57BL/6J mice induced by high fat diet and its effect on the improvement of obesity insulin resistance. Methods Ninety C57BL/6J mice were selected for adaptive feeding for 2 weeks. The control group was randomly reserved. The other mice were fed with high fat diet for 2 weeks, and were randomly divided into model group, cassia nomame granules low-dose group, medium-dose group and high-dose group(LD, MD, HD; 0.1, 0.3, 0.9 g/kg), and rosiglitazone group(RH). Except the control group, the other 5 groups were given high fat diet and weighed weekly. The drugs were administered once a day by intragastric administration. After 8 weeks, blood was sampled from the eyeballs to measure fasting blood glucose, insulin and blood lipids, and fat in the abdomen, epididymis and kidneys were taken. The inflammatory factors were detected by ELISA, and the expression of IKK-β/NFκB and JNK pathway proteins was detected by Western Blot. Results The cassia nomame granules significantly inhibited the growth of C57BL/6J mice induced by high-fat diet, and it could reduce fasting blood glucose(FPG), fasting insulin(INS), and improve insulin resistance index(IRI). The experimental results of the kit showed that the granules significantly reduced LDL-C, TC, and TG, and significantly increased HDL-C. ELISA results showed that the granules significantly reduced leptin(LEP), interleukin-6(IL-6), tumor necrosis factor-α(TNF-α), and monocyte chemoattractant protein-1(MCP-1) levels, and increased the level of adiponectin(ADPN). The results of Western Blot showed that the high dose of the granules had a significant inhibitory effect on the activated IKK-β/NFκB and JNK pathways. Conclusion The cassia nomame granules can inhibit the obesity induced by high-fat diet and the secretion of related inflammatory factors and the activation of inflammatory pathways, and improve insulin resistance.
[Key words] Cassia nomame granules; Obesity; Inflammatory factor; Inflammatory pathway; Insulin resistance
隨著生活水平的提高,我國肥胖人群數量迅猛增長。有研究表明,超過80% 的2型糖尿病患者同時受到肥胖的困擾,顯示出肥胖與2型糖尿病的相關關系[1]。肥胖引發的慢性炎癥能導致胰島素抵抗(IR),而長期IR最終導致糖尿病的發生。目前,IR發生的炎癥反應學說得到醫學界普遍接受。很多研究認為,肥胖時脂肪細胞分泌的多種炎癥因子,如白介素-6(IL-6)、腫瘤壞死因子α(TNF-α)等均可引起或參與炎癥反應。肥胖尤其是內臟型肥胖者脂肪細胞增生、肥大可促進分泌促炎或炎癥因子。因此,科學家提出“肥胖是一種低度的炎癥狀態”[2,3]。豆茶決明[Cassia mimosoides(Sieb.)Kitag]是豆科決明屬植物,是民間常用的藥食兩用植物,在遼寧省廣泛分布。課題組前期研究證明,豆茶決明水煎液具有抗肥胖、調節血脂和改善IR等作用[4],豆茶決明沖劑含藥血清對3T3-L1 前脂肪細胞分化有抑制作用,其分子機制可能與下調PPARγ、C/EBPα 和C/EBPβ mRNA 和蛋白表達相關[5]。基于以上研究,本文旨在研究豆茶決明沖劑對飲食誘導的肥胖的防治及其對炎癥因子和炎癥通路的作用。
1 材料與方法
1.1 材料
1.1.1 動物? 健康雄性C57BL/6J小鼠90只,體重20~24 g,購于北京華阜康生物科技股份有限公司,動物合格證號 SCXK(京)2014-0004。
1.1.2 藥物? 豆茶決明全草:采摘于遼寧省寬甸,經遼寧省食品藥品檢驗所王維寧教授鑒定為豆茶決明[Cassia mimosoides(Sieb.)Kitag]干燥全草。豆茶決明沖劑制備:同本課題組前期實驗方法[5],稱取豆茶決明干燥全草107 g,粉碎,加10倍量80%乙醇,加熱回流提取2次,每次1 h,過濾后合并濾液,減壓濃縮、干燥得初提物。初提物粉碎,過80目篩,加蔗糖3份糊精1.25份,85%乙醇做潤濕劑,18目篩整粒,60℃減壓真空干燥,105℃遠紅外滅菌,即得。
1.1.3 豆茶決明沖劑、陽性藥和高脂飼料的配制? 將86 g豆茶決明沖劑溶于672 mL蒸餾水,充分溶解為豆茶決明沖劑高劑量組,再分別稀釋3、9倍作為豆茶決明沖劑中、低劑量組。羅格列酮片(成都恒瑞制藥有限公司,批號H20030569)1片4 mg溶于106.7 mL水中,充分溶解,作為陽性藥組。高脂飼料配比同本課題組前期實驗方法[4]:普通飼料77%,蔗糖10%,熟豬油10%,膽固醇2%,膽酸鹽1%,由北京科奧協力有限公司制作。
1.1.4 試劑及設備? 瘦素(leptin,LEP)、脂聯素(ADPN)、腫瘤壞死因子(TNF-α)、白介素6(IL-6)、單核細胞趨化蛋白1(MCP-1)ELISA檢測試劑盒(上海酶聯生物科技有限公司,批號分別為:ml002287、ml057809、ml002095、ml002293、ml037840);低密度脂蛋白(LDL-C)、總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)測試盒(南京建成生物工程研究所,批號均為:20170907);JNK、IKKβ、NFκB單克隆抗體(北京博奧森生物技術有限公司,批號:bs-2592R、bs-7557R、bs-23217R);P-JNK、P-IKKβ單克隆抗體(Signalway Antibody,USA,批號:11504-1、11931-1);HRP AffiniPure Goat Anti-Rabbit IgG(H+L)(EARTHOX,USA,批號:E030120);β-actin(北京博奧森生物技術有限公司,批號:bs-0061R);蛋白marker(賽默飛世爾科技有限公司,批號:26617);SDS-PAGE蛋白上樣緩沖液(5X)(碧云天生物技術有限公司,批號:P0015);Western及IP裂解液(碧云天生物技術有限公司,批號:P0013);ECL發光液(碧云天生物技術有限公司,批號:P0018);一、二抗稀釋液(碧云天生物技術有限公司,批號:P0023A、P0023D);BCA蛋白濃度測定試劑盒(碧云天生物技術有限公司批號:P0012S);SDS-PAGE凝膠試劑盒(碧云天生物技術有限公司,批號:P0012A);蛋白酶抑制劑混合物(北京索萊寶科技有限公司,批號:A8260);PVDF膜(北京智杰方遠科技有限公司,批號:IPVH00010)。電子調溫電熱套(天津市泰斯特儀器有限公司,型號:98-1-B);旋轉蒸發器(上海亞榮生化儀器廠,型號:RE-3000);循環水式多用真空泵(鄭州長城科工貿有限公司,型號:SHB-ⅢA),電熱鼓風干燥(上海精宏實驗設備有限公司,型號9423A);多功能酶標儀(奧地利TECIN,型號:INFINITE M200);垂直電泳槽(上海天能科技有限公司,VE680微型);全自動化學發光圖像分析系統(公司上海天能科技有限公司,型號:Tanon-5200);ESP600電泳儀(上海天能科技有限公司,型號:ESP 600)。
1.2研究方法
C57BL/6J雄性小鼠適應性喂養2周后,隨機預留對照組15只小鼠,其余小鼠高脂飼料喂養2周,2周后隨機分為5組,即模型組、陽性藥羅格列酮組(RH)、豆茶決明沖劑高、中、低劑量組(HD、MD、LD),對照組給予普通飼料,其他5組給予高脂飼料喂養,每天按0.02 mL/g灌胃給藥1次,HD、MD、LD組給予0.9、0.3、0.1 g/kg三個劑量,RH組按0.75 mg/kg灌胃給予羅格列酮,對照組與模型組灌胃給予飲用水,連續給藥8周。
1.3觀察指標
(1)一般情況觀察:每天觀察小鼠毛色、狀態、飲食及尿液糞便。(2)體重、空腹血糖及脂肪重量。給藥后,每周稱體重,第8周末,禁食不禁水12 h,測量空腹血糖,摘眼球取血。處死小鼠,取小鼠腹部、附睪以及雙腎部位的脂肪,用濾紙吸取表面液體,用電子天平分別稱重,-80℃冷藏備用。(3)血清FBG、INS和血脂HDL-C、LDL-C、TC、TG的濃度:按照試劑盒說明檢測。(4)血中瘦素、脂聯素、TNF-α、IL-6、MCP-1的含量:酶聯免疫法試劑盒檢測。(5)計算胰島素抵抗指數:IRI=(空腹胰島素濃度×空腹血糖濃度)/22.5。(6)脂肪組織中p-IKKβ/IKKβ、p-JNK/JNK、NFκB的變化:蛋白質免疫印跡法(Western Blot)檢測,取腹部脂肪組織100 mg放入液氮研磨,加500 μL裂解液與磷酸酶抑制劑混合液(100:1)充分裂解,4℃、12000轉/min、離心10 min,重復離心直到上清液清澈,提取上清。BCA試劑盒檢測樣品蛋白濃度。蛋白質樣品加上樣緩沖液95℃變性5 min,用10% SDS-PAGE凝膠,90 V分離蛋白,400 mA轉膜40 min。轉膜后Western封閉液封閉30 min。一抗4℃孵育過夜,二抗孵育2 h,曝光顯影檢測蛋白質。
1.4 統計學分析
采用SPSS19.0軟件對數據進行處理與分析,計量資料用均數±標準差(x±s)表示,兩兩比較采用LSD-t檢驗及Dunnett-t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 各組小鼠生長狀況比較
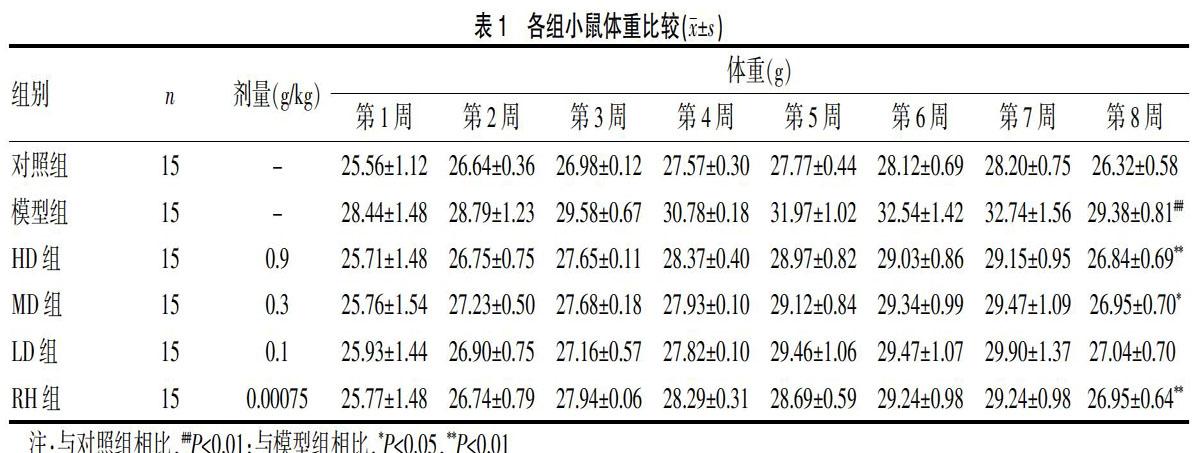
對小鼠的皮毛、狀態觀察發現,對照組和豆茶決明組小鼠皮毛光亮、飲食狀態良好、無腹瀉情況產生。與對照組相比,模型組體重明顯升高,給藥第8周末實驗結束時二者有顯著性差異(P<0.01)。與模型組相比,HD、RH組抑制效果最為明顯(P<0.01),MD組也有所下降(P<0.05)。LD組無明顯變化(P>0.05)。實驗結果表明,豆茶決明沖劑可以減輕高脂誘導的小鼠體重的增加(表1)。
2.2各組小鼠脂肪重量比較
由表2可知,與對照組相比,模型組雙腎、腹部及附睪脂肪重量明顯增加。與模型組相比,MD、HD、RH組腹部脂肪、雙腎及附睪脂肪重量明顯降低(P<0.01,P<0.05)。LD組可使腹部脂肪降低(P<0.01),但是對雙腎及附睪脂肪重量無明顯影響(P>0.05)。結果表明,豆茶決明沖劑可以抑制高脂誘導的小鼠體內脂肪的增加(表2)。
2.3 各組小鼠空腹血糖(FPG)、胰島素(INS)和胰島素抵抗指數(IRI)比較
從表3可以看出,與對照組比較,模型組小鼠的空腹血糖(FPG)、胰島素(INS)以及胰島素抵抗指數(IRI)明顯升高;與模型組比較,LD、MD、HD組、RH組的FPG、INS和IRI明顯下降。表明豆茶決明沖劑可以顯著降低高脂飲食小鼠的FPG、INS和IRI。
2.4 各組小鼠血脂比較
經過高脂飼料喂養后,與對照組相比,模型組LDL-C、TC、TG明顯升高(P<0.01),HDL-C明顯降低(P<0.01);與模型組相比,MD、HD、RH組LDL-C、TC、TG均降低, HDL-C水平升高。LD組HDL-C水平升高,LDL-C降低。結果表明,豆茶決明沖劑對血脂具有調節作用,隨著劑量的增加,作用越明顯(表4)。
2.5各組小鼠相關炎癥因子比較
與對照組相比,模型組經高脂飼料喂養后,腫瘤壞死因子α(TNF-α)、血清中瘦素(leptin, LEP)、單核細胞趨化蛋白-1(MCP-1)、白介素-6(IL-6)含量明顯增加(P<0.01),而脂聯素(ADPN)水平顯著降低。與模型組相比,MD、HD、RH組能使LEP、IL-6、TNF-α、MCP-1含量明顯降低(P<0.01),ADPN水平顯著升高,表明豆茶決明沖劑對高脂誘導的肥胖小鼠相關因子具有調節作用(表5)。
2.6各組小鼠相關炎癥通路比較
與對照組相比,經高脂飼料喂養后模型組的p-IKKβ/IKKβ、NFκB、p-JNK/JNK比值升高,而LD、MD、HD組及RH組其比值明顯低于模型組。見圖1、表6。
3討論
目前,公認脂肪細胞是一種內分泌細胞,脂肪組織是內分泌組織,其分泌的脂肪細胞因子是形成IR的原因之一。據此,我們認為肥胖、脂類代謝異常是導致IR 重要原因之一[6]。我們前期研究已經初步表明豆茶決明水煎液具有減肥、降脂、改善胰島素抵抗作用[4]。本研究將豆茶決明制備為沖劑并對其作用機制進行探討。實驗結果顯示,豆茶決明沖劑可降低IR 小鼠體質量、FPG 和INS 水平。豆茶決明降低小鼠的體脂重、TC和TG水平,減少脂肪組織的脂肪重量,明顯降低FPG、INS和IRI,表明豆茶決明沖劑具有改善IR的作用。
肥胖是一種常見的慢性代謝性疾病,是基因、環境包括飲食環境等因素共同作用的結果[7]。胰島素抵抗(IR)是指在各種原因的影響下使胰島素對葡萄糖攝取和利用的效率下降,機體代償性的分泌過多胰島素而產生高胰島素血癥[8]。肥胖引起異位脂質積累和在骨骼肌中產生胰島素脫敏,產生全身胰島素抵抗和2型糖尿病[9]。在肥胖狀態下,脂肪細胞會分泌一系列的細胞因子從而誘發免疫和炎癥過程,這種免疫和炎癥過程可能會參與胰島素抵抗(IR)的發生及發展,相關的炎癥因子主要含有白介素-6(IL-6)、腫瘤壞死因子α(TNF-α)、單核細胞趨化蛋白-1(MCP-1)等[10]。除以上相關炎癥因子外,也有研究發現脂肪因子(瘦素、脂聯素)可能也參與了IR的產生。瘦素(leptin,LEP)由脂肪組織分泌,通過作用于下丘腦減少機體的食物攝入,增加能量消耗,從而調節整體的糖脂平衡和內分泌功能。研究表明在肥胖狀態下,體內的LEP分泌顯著升高,出現瘦素抵抗,此變化在胰島素抵抗的發展中起重要作用[11]。脂聯素(ADPN)主要也是由脂肪細胞分泌,具有提高胰島素敏感性的作用[12]。我們的前期研究已經表明,豆茶決明可以抑制體重升高,改善糖、脂類代謝,抑制肥胖形成的作用[4]。本實驗結果顯示,豆茶決明沖劑能顯著抑制小鼠血清TNF-α、LEP、MCP-1、IL-6濃度,增加ADPN含量,表明豆茶決明沖劑能有效地改善胰島素抵抗小鼠的炎癥反應。
研究表明脂肪組織與細胞中分泌的TNF-α、IL-6多種相關因子能夠激活胰島素靶細胞中的JNK、IKKβ炎性信號通路[13-15]。JNK是環境應激和炎癥的關鍵調解者,屬于絲裂原活化蛋白激酶(MAPK)家族,被FFA、TNF-α、IL-6等炎癥因子激活后使胰島素受體底物(IRS)307位上絲氨酸磷酸化,減弱了胰島素的行動,產生胰島素抵抗[16,17]。IKKβ通路主要通過兩種途徑干擾胰島素抵抗。IKKβ通路可直接作用于胰島素信號通路中信號分子如胰島素受體底物(IRS),并催化其特定部位的Ser/Thr殘基磷酸化,進而抑制信號分子的Thr磷酸化,導致IR;也有研究認為被TNF-α、IL-6等炎癥因子激活的IKK可以磷酸化IκB,使IκB和NF-κB解離,NF-κB轉移到細胞核內與DNA靶基因相應位點結合生成mRNA,由此激活NF-κB信號通路,進而產生大量炎癥細胞因子,然后進一步加速IR的形成[18,19]。近期許多研究表明,抑制JNK可抑制自噬,降低胰島素抵抗[20]。高脂飲食通過增加JNK1的表達提高了JNK激活引起抑郁[21];高脂飲食通過激活脂肪組織炎癥、JNK和NF-κB通路導致小鼠胰島素抵抗[22,23]。激活IKKβ/NF-κB導致神經元損耗和分化受損,IKKβ/NF-κB介導的下丘腦成體神經干細胞損傷是肥胖及相關糖尿病的重要神經退行性機制[24]。木犀草素可以抑制相關血管的生成,改善高脂飼料誘導的小鼠肥胖及胰島素抵抗(IR)[25,26];張磊等[27]研究也證明飲食補充木犀草素可以抑制高脂飲食誘導的脂肪組織巨噬細胞M1極化,降低脂肪組織中巨噬細胞及促炎細胞因子TNF-α、IL-6、MCP-1的mRNA的表達,從而改善高脂飲食誘導的脂肪組織慢性炎癥的發生。綜上研究表明,JNK和NF-κB通路是高脂誘導小鼠胰島素抵抗重要炎癥信號通路。本文對JNK、IKKβ炎性信號通路的研究表明,模型組小鼠實驗結果同文獻[22,23,27]一致,豆茶決明沖劑可以降低p-IKKβ/IKKβ的比值和抑制NF-κB表達,降低p-JNK/JNK的比值,證明豆茶決明沖劑可以抑制肥胖時最重要的致炎通路的激活。
通過對瘦素、脂聯素、IL-6、TNF-α、MCP-1和對JNK、IKKβ通路的研究,我們認為豆茶決明沖劑可以抑制炎癥因子和炎癥通路的激活,從而改善肥胖產生的胰島素抵抗。此研究為將豆茶決明開發成安全有效、無毒副作用的減肥產品奠定了基礎。
[參考文獻]
[1] 詹莉莉,楊志秋,傅正偉.肥胖與慢性炎癥的研究進展[J].中國細胞生物學學報,2011,33(3):297-305.
[2] 鄒大進,李慧.肥胖、炎癥與胰島素抵抗[J].國外醫學·內分泌學分冊,2004,(4):291-293.
[3] 張豫文,洪潔.炎癥因子與胰島素抵抗[J].診斷學理論與實踐,2010,9(1):90-94.
[4] 楊楚楓,楊洋,張玥,等.豆茶決明對高脂誘導C57BL/6J小鼠肥胖和胰島素抵抗的影響[J].中國實驗方劑學雜志,2015,21(10):141-145.
[5] 李慧玲,劉天竹,王丹,等.豆茶決明沖劑含藥血清對3T3-L1前脂肪細胞分化的抑制作用[J].中藥藥理與臨床,2018,34(1):89-92.
[6] 楊洋,王丹,楊楚楓,等.五苓散對高脂膳食誘導小鼠胰島素抵抗的影響[J].中國中醫藥信息雜志,2015,(3):73-76.
[7] 倪國華,張璟,鄭風田.中國肥胖流行的現狀與趨勢[J].中國食物與營養,2013,19(10):70-74.
[8] 楊江林,劉康,劉保林.小檗堿促進葡萄糖攝取作用的機制研究進展[J].醫藥前沿,2014,(8):213.
[9] Petersen KF,Shulman GI.Pathogenesis of skeletal muscle insulin resistance in type 2 diabetes mellitus[J].Am J Cardiol,2002,90(5A):11G-18G.
[10] 樸春麗.從脂肪組織炎癥機制探討中醫治療糖尿病的思路和方法[A]. 中華中醫藥學會糖尿病分會.第十次全國中醫糖尿病大會論文集[C].中華中醫藥學會糖尿病分會,2007:152-155.
[11] 范強,楊麗霞,程濤,等.胰島素抵抗相關炎癥因子研究進展[J].衛生職業教育,2016,34(23):155-157.
[12] 高海明.瘦素與胰島素抵抗關系及運動[J].體育科技文獻通報,2010,18(4):129-131.
[13] Yadav A,Kataria MA,Saini V,et al.Role of leptin and adiponectin in insulin resistance[J].Clin Chim Acta,2012, 417C:80-84.
[14] 周瑩,張麗娟.胰島素抵抗與炎癥因子及其相關信號傳導通路[J].心血管康復醫學雜志,2010,19(1):107-109.
[15] 牛潔,劉銅華.炎癥與胰島素抵抗關系研究概況[J].深圳中西醫結合雜志,2008,(2):116-119.
[16] 侯志強,李宏亮,李光偉.內質網應激、JNK通路在胰島素抵抗發生中的相關作用[J].中國醫學雜志,2008,88(6):247-248.
[17] Yang R,Trevillyan JM.c-Jun N-terminal kinase pathways in diabetes[J].Int J Biochem Cells Biol,2008,40 (12):2702-2706.
[18] Minsheng Y,Konstantopoulos N,Jongsoon L,et al.Reversal of obesity and diet induced insulin resistance with salicylates of targeteddisruption of IKKβ[J]. Science,2001, 293:1673-1677.
[19] Shoelson SE,Lee J,Yuan M,Inflammation and the IKKβ beat/Ikappa B/NF-kappa B axis in obesity and diet- induced insulin resistance[J].Int J Obes Relat Metab Disord,2003,27(Super.3):S49-S52.
[20] Yan H,Gao Y,Zhang Y. Inhibition of JNK suppresses autophagy and attenuates insulin resistance in a rat model of nonalcoholic fatty liver disease[J].Mol Med Rep,2017, 15(1):180-186.
[21] Magdy YM,El-Kharashi OA,Nabih ES,et al.Potential involvement of JNK1 repression in the hepatic effect of sitagliptin and metformin in rats subjected to high fat diet and chronic mild distress[J]. Biomed Pharmacother,2017,85:225-238.
[22] Zhou J,Xu G,Ma S,et al. Catalpol ameliorates high-fat diet-induced insulin resistance and adipose tissue inflammation by suppressing the JNK and NF-κB pathways[J]. Biochem Biophys Res Commun,2015, 467(4):853-858.
[23] Sahin K,Orhan C,Akdemir F,et al.β-Cryptoxanthin ameliorates metabolic risk factors by regulating NF-κB and Nrf2 pathways in insulin resistance induced by high-fat diet in rodents[J]. Food? Chem Toxicol,2017, 107(Pt A):270-279.
[24] Li J,Tang Y,Cai D.IKKβ/NF-κB disrupts adult hypothalamic neural stem cells to mediate a neurodegenerative mechanism of dietary obesity and pre-diabetes[J].Nat Cell Biol,2012,14(10):999-1012.
[25] Xu Na,Zhang Lei,Dong Jing,et al.Low-dose diet supplement of a natural flavonoid,luteolin,ameliorates diet-induced obesity and insulin resistance in mice[J].Molecular Nutrition & Food Research,2014,58(6):1258-1268.
[26] Liu Jian,Divoux A,Sun Jiusong,et al.Genetic deficiency and pharmacological stabilization of mast cells reduce diet-induced obesity and diabetes in mice[J].Nature Medicine,2009,15(8):940-945.
[27] 張磊,鮑斌,劉健.木犀草素通過蛋白激酶C途徑抑制肥胖相關的巨噬細胞極化[J].食品科學,2014,35(13):186-191.
(收稿日期:2018-08-26)

