肝膽管囊腺癌1例
章馨允 吳塵軒(通訊作者) 郭洪生
(天津市第三中心醫院腫瘤內科 天津市肝膽疾病研究 天津 300170)
患者女性,40歲,既往體健。2017.7無明顯誘因出現寒戰、發熱,最高體溫40℃,無咳嗽、咳痰,無腹痛、腹瀉,就診于當地醫院,B超示:肝臟7×6cm囊性腫物,考慮肝膿腫,予以膿腫置管引流及抗感染治療1月,癥狀無明顯好轉,后就診于我院,強化MRI示:肝右葉可見混雜密度影,內可見分隔,分隔及病灶邊緣中等強化,周圍可見多發環形強化影,并可見引流管,不除外惡性腫瘤;腫瘤標志物示:CA 19-∶>1000u/ml;結合病史及相關檢查,不除外肝惡性腫瘤合并感染,排除手術禁忌,于2017.9行右半肝切除術+膽囊切除術,術中可見肝臟右后葉巨大腫物突出肝表面,質硬,邊緣不規則,且腫物與膈肌粘連,切取部分膈肌送術中冰凍回報:(膈肌粘連處)考慮轉移性腺癌,因腫瘤侵及膈肌范圍較大,術中給予侵及膈肌以氬氣刀燒灼,并植入5-FU緩釋化療藥物;切開腫物呈魚肉狀,質硬,包膜不完整,可見多個膿性腔隙;術后病理示:(右半肝)中-低分化腺癌,考慮來源于膽管;IHC:CK7(+),CK19(+),Hep(-),S-100(-),GPC3(-),Vim(-),Ki-67 50%(+),特染支持診斷;肝膈肌粘連處(+);考慮患者膈肌轉移,術后CA 19-9∶83.69u/ml,未達到根治性切除,術后行GEMOX方案(吉西他濱+奧沙利鉑)化療2周期,后復查CT示:肝內多發異常強化灶,腫瘤再發?轉移瘤?CA 19-9∶196.9u/ml,療效評價:疾病進展;考慮患者術后2月肝內快速進展,但無遠處轉移,給予肝臟TACE術加強局部治療以控制腫瘤生長,后聯合DCF方案(多西他賽+順鉑+氟尿嘧啶)2周期全身化療,復查CT:肝內轉移灶較前增大、增多,CA 19-9∶496.85u/ml,療效評價:疾病進展;后患者放棄進一步治療,于2018.6月死亡。
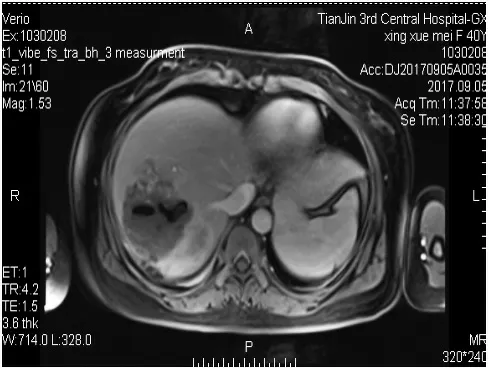
圖1 術前強化肝臟MRI
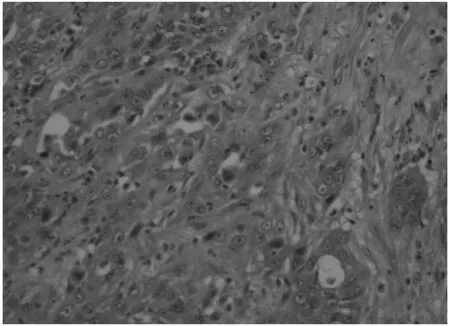
圖2 術后病理 H&Ex40
討論
肝膽管囊腺癌(biliary cystadenocarcinoma,BCAC)是一種罕見的肝臟惡性腫瘤,由Willis等人在1943年首先提出,好發于中年女性,據統計其發病率僅占所有肝臟惡性腫瘤的0.41%[1]。由于臨床表現不典型,所以早期診斷困難,常與其他肝臟良性囊性病變相混淆。組織來源可能為:肝臟囊腺瘤或其他良性的囊性病變;膽管上皮或膽管周圍腺體。BCAC雖然病因仍然不明確,但是有報道顯示大多數BCAC來源于之前存在的囊腺瘤或其他良性的囊性病變[2]。另外,有研究顯示BCAC是膽管癌的囊性變異,共同表達膽管表型[1]。在BCAC女性患者中通常存在卵巢樣間質(ovarian stroma,OS),但是在男性患者中沒有發現這種成分。這可能是由于在胚胎發育中,肝臟和生殖腺臨近造成了組織的遷移。CA19-9是膽管癌的腫瘤標志物,有報道顯示在有OS成分的BCAC中CA 19-9有升高,而在無OS的BCAC中CA 19-9基本正常[3]。臨床表現上,這種有OS成分的BCAC亞型成惰性預后較好,相反無OS成分的BCAC進展迅速預后較差,可能由于這個原因,BCAC中男性患者預后較女性差[4]。BCAC影像學表現通常為多囊性,中間有分隔、結節和不規則增厚的囊壁;MRCP與傳統強化CT相比,在正常與非正常組織鑒別、腫塊浸潤范圍、囊腔分隔及囊壁小結節判斷等方面更具優勢;PET-CT對于良惡性腫瘤的鑒別診斷中具有重要價值[5]。BCAC的治療以外科手術切除為主,手術范圍需距離腫瘤組織邊緣1~2cm已達到完全切除;穿刺引流,注射硬化,射頻消融等局部治療容易引起腫瘤種植轉移,應盡量避免。有報道顯示,完全根治切除后BCAC的5年生存率可達65%~70%,而局部治療及未能根治患者5年生存率僅為33%[6]。本例患者由于早期癥狀不典型,外院初診時誤診為肝膿腫,進行穿刺引流,一定程度上造成了治療延誤,增加了其播散風險,且該病發病率低,缺乏放療、化療大宗數據及推薦的治療方案,僅能根據臨床情況個體化治療,療效難以保證。由于手術完全切除后患者生存率高,且常為肝內復發、轉移,所以出現復發轉移情況后,如有手術根治條件,仍推薦反復多次手術治療。

