科創板“青睞”創新藥械上海聯影醫療、微芯生物等浮出水面
盧桂鳳
科創板對尚未盈利的創新型藥企持“開放態度”,《征求意見稿》明確,“預計市值不低于人民幣40億元,主要業務或產品需經國家有關部門批準,市場空間大,目前已取得階段性成果,并獲得知名投資機構一定金額的投資。醫藥行業企業需取得至少一項一類新藥二期臨床試驗批件”,這樣的藥企就滿足上市條件。
因為條件明確,筆者預計會有一大批醫藥公司到科創板上市。基于筆者對生物醫藥行業的理解,在此篩選出了一批契合科創板定位和標準的醫藥公司,它們極有可能是潛在受益者,尤其是醫療器械企業中的上海聯影醫療、微創醫療和創新藥企業中的微芯生物、南京傳奇等幾家公司最具代表性。
上海聯影醫療遠超老牌 微創醫療或成“微創系”
首先以“國家藥監局要聞公告過產品獲批”為前提,并將融資估值考慮在內,就可以篩選出一批“市場前景廣闊、突破核心自主技術”的企業,上海聯影醫療就是其中之一。
據統計,中國醫療影像市場有1000億元規模,在平板、監護儀、超聲等中低端市場中已經實現了較大程度的國產化,但在高端醫療影像領域依然被幾大外資高度壟斷,這也導致了國內高端醫療影像設備價格和影像檢查收費居高不下。上海聯影醫療是近年興起的新秀,在多個核心技術領域都有了質的突破,相關技術儲備已經顯著超越萬東醫療、新華醫療等傳統廠商。2017年上海聯影醫療A輪融資33億元,估值達到333億元,這在一定程度上體現了市場對高端國產醫療影像設備突破的信心與期待。目前公司還只有小幾十億營收,相比千億行業規模而言仍然有不小的進口替代增長空間。
除此之外,上海本地的核酸診斷廠商之江生物、上市首個國產TAVI的啟明醫療、上市首個國產醫療機器人的天智航、上市首個國產神經刺激器的品馳醫療等企業也都契合科創板定位與標準且市場認可度高。
除了上文提到的國家藥監局要聞公告,國家藥監局下屬醫療器械技術審評中心(CMDE)的“創新醫療器械特別審批”也是權威的認定。自2014年《創新醫療器械特別審批程序(試行)》施行至今,創新醫療器械認可數量上位居榜首的是微創醫療(15個),先健科技次之(8個)。其中微創醫療已在港股上市,但公司在各個前沿業務都獨立設置了子公司,微創心脈、微創電生理、微創神通3家公司已經符合科創板標準,另有3家預計2~3年內達標,不排除未來在科創板形成“微創系”的可能。
以上海微創心脈為例,微創心脈已經獲得4個創新醫療器械認定,其中公司主要用于主動脈瘤治療的核心產品“大血管覆膜支架系列產品”的獲批徹底改寫了國內大支架完全依賴進口的歷史,并獲得2017年國家科技進步二等獎。除此之外,微創心脈的扣非凈利潤保持高速增長,2015年扣非凈利為3076.7萬元、2016年為4175.1萬元、2017年承諾不低于5225萬元;2017年營收同比增長33%,2018上半年營收同比增長51.4%。考慮到動脈瘤廣泛的發病率和國內相對較低的診療率,預計仍將保持良好的增長趨勢。更重要的是,2017年中金公司和華興資本,以18.5億元估值對微創心脈進行投資。另外還有兩處細節也可見政府對微創的認可,一是2018年促民營經濟座談會上,微創醫療董事長常兆華和恒瑞醫藥董事長孫飄揚是“唯二”坐在最內圈的醫藥嘉賓;二是上海市新市長在去年初上任的第一個工作日就去了微創調研。
上文只提到了兩個“官方認定”,除此之外,市場認可度高的企業也存在不少。比如擁有被認為是引領化學發光的第四代技術的科美生物,公司在2018年8月1日宣布完成近20億的私募股權戰略融資,獲得華興資本、君聯資本等鼎力支持,未來大概率也會走向科創板。
南京傳奇是標桿 微芯生物或是創新方向
與醫療器械類似,創新藥上也有兩個可比的“官方認定”,即“國家藥監局要聞方式公告產品獲批”和“納入藥品審評中心(CDE)的明顯療效優勢創新藥的優先審評”。據筆者分析,目前有4類企業的產品表現更為契合,一是作為近年生物科技突破典范的“PD1單抗”,4個國產產品均在列,君實生物和信達生物的PD1已上市,但恒瑞醫藥和百濟神州的PD1仍然在報產;二是產品已進入突破初期的“CART”,也有4款產品入選;三是正在遍地開花、迅速崛起的國產靶向藥;四是不斷突破地其它大、小分子藥物(見表1)。
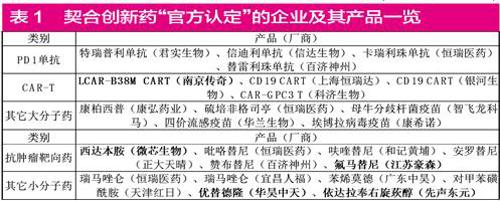
先以CART的廠商南京傳奇為例,公司產品的發展故事一如其“傳奇”之名。南京傳奇在2015年開啟LCAR B38M治療多發性骨髓瘤的研究性臨床,2017年6月隨即在美國公布引發轟動。強生對南京傳奇進行了深度調研,而后以3.5億美元首付款將南京傳奇的CART引入美國。另外,南京傳奇的母公司金斯瑞生物科技的股價也在短短2年內上漲20多倍。目前南京傳奇尚未有進一步股改等動作,但仍為CART新技術的標桿企業。
再以國產靶向藥西達本胺的廠商微芯生物為例,業內人士普遍將“貝達藥業的埃克替尼、康弘藥業的康柏西普、恒瑞醫藥的阿帕替尼、微芯生物的西達本胺”當作國產自主藥突破前期的4大標志,其中微芯生物是唯一未上市企業,該公司的西達本胺是國家1.1類新藥,擁有全球專利保護。
另外,微芯生物的1.1類控糖尿病新藥“西格列他鈉”已經完成III期報產;1.1類抗腫瘤新藥“西奧羅尼”也已進入II期臨床。據微芯生物官網介紹,5個1.1類新藥處于臨床前研究階段,并已獲得禮來亞洲基金、同創偉業、德同資本等多輪融資,預計其估值在50億元以上。筆者認為,“真正聚焦全球創新而非一味追隨市場熱點”的微芯生物代表了具有更廣泛意義的創新藥發展方向,若公司新藥開發順利,仍然有很大成長空間。
其它大、小分子藥物也有幾家未上市但不可忽視的藥企,就不一一列舉了。除此之外,隨著國內藥品創新潮的逐年壯大,大量“技術先進、前景光明”的產品可能在優先審評制度前就已獲批臨床,但未到報產階段,就不會出現在上述兩個“官方認定”里,致使上述產品和企業只顯示了冰山一角。如果換個角度,以“至少獲得1個1類自主新藥的II期臨床批件”為前提并考慮一定的估值門檻,有10家藥企比較契合條件,不過這些近半已在港股上市或已經提交了港股上市申請,由于已經完成了港股上市架構和準備,重新回到排隊等科創板概率不大,但尚無港股申報的公司仍然有不小機會考慮國內上市(見表2)。

(作者系青僑陽光基金經理)

