LPA2在PC12細胞缺血再灌注損傷致細胞凋亡中的作用*
陳志洪,蔡雪平,周小梅
(廣東省人民醫院南海醫院檢驗中心,廣東佛山 528200)
近年來,腦血管疾病成為威脅人類健康的主要疾病,其中較為常見的腦血管疾病為腦卒中,是致患者死亡和殘疾的主要因素,給社會和家庭帶來極大壓力和負擔[1]。缺血性腦卒中主要是由于患者出現血栓或栓塞致大腦相關動脈閉塞,已知的原因有興奮性毒性、細胞穩態喪失及血腦屏障破壞等,可能導致患者神經元死亡[2]。利用細胞分子學對缺血性腦卒中患者發病過程進行研究可較直觀地反映患處缺血、缺氧環境下各種因素對患者神經元的影響。溶血磷脂酸(LPA)是一種結構最為簡單的甘油磷脂酸酯,主要來源于被激活的血小板,神經系統是LAP受體表達的主要部位,且人體大腦中LAP處較高濃度狀態[3]。相關研究發現,人類發生腦卒中后,其腦組織中LAP等濃度將顯著升高,且升高LAP可致患者腦組織損傷加重[4]。PI3K/Akt途徑可通過阻斷人體細胞凋亡來有效保護人體細胞受損。PC12細胞主要來源于人體神經嵴,可分泌兒茶酚胺類遞質[5]。本研究主要探討LPA2在PC12細胞缺血再灌注損傷致細胞凋亡中的作用,現報道如下。
1 資料與方法
1.1一般資料 PC12細胞購自武漢大學基礎醫學院。所需儀器:低溫離心機(美國Thermo公司,FRESCO17)、干濕恒溫器(杭州奧盛儀器有限公司,MK2000-1)、電子天平(上海越平科學儀器有限公司)、-80 ℃及-20 ℃低溫冰箱(青島海爾股份有限公司)、三氣及普通培養箱(長沙華曦電子科技有限公司)、酶標儀(Pemn Elmer)、磁力攪拌器(常州國華電氣有限公司)、成像系統(日本Nikon DS-U3)等。
1.2方法 配置剝脫液,6.25 mL 1.0 mol/L Tris-氯化氫(pH=6.8)+73 mL蒸餾水+20 mL 10% 十二烷基硫酸鈉(SDS)+10%β-疏基乙醇,1.0 mol/L的濃縮膠緩沖液(pH=6.8)。稱取12.11 g Tris堿溶于80 mL蒸餾水中,然后采用10.0 mol/L HCL溶液將pH調至6.8,然后再定容至100 mL、1.5 mol/L分離膠緩沖液(pH=8.8),稱取18.17 g Tris堿溶于80 mL蒸餾水中,然后采用10.0 mol/L HCL溶液將pH調至8.8,然后再定容至100 mL、10×電轉緩沖液、10%四甲基乙二胺,30.30 g Tris-base+144 g甘氨酸加蒸餾水定容至1 000 mL,電轉時現配成1×電轉液中200 mL甲醇。10×電泳緩沖液,30.20 g Tris堿+144 g甘氨酸+10 g SDS,然后加蒸餾水,于60 ℃水浴鍋中加熱溶解,定容至1 000 mL,電泳時再現配。10%AP,1 g+蒸餾水溶解后定容至10 mL、10×TBST,24.20 Tris堿+80 g 氯化鈉,然后加蒸餾水定容至1 000 mL,最后再稀釋配制成1×TBST,最后再加入總體積0.1%的Tween-20、H2L5186303,5 mg H2L5196303粉末+20 μL二甲基亞砜(美國Amresco公司)配制成25 mg/mL H2L5186303,然后再從混合液中取出10 mL,并加入990 μL生理鹽水及氫氧化鈉、10×PBS緩沖液,1.20 g磷酸二氫鈉+14.40 g磷酸氫二鈉+40 g氯化鈉+1 g氯化鉀,加400 mL蒸餾水,攪拌后溶解,再調至pH=7.4,定容至500 mL等。向高糖培養基中加入10%胎牛血清(杭州四季青公司)和1%雙抗以制作DMEM高糖培養基;其中DMEM無糖培養基則不做處理。
首先,從液氮容器中將凍存時間<3個月的凍存管取出,然后立即將其放置于37 ℃溫水中,并搖動以使其融化;待其融化后將其取出并放置于超凈工作臺上將蓋子打開,吸出PC12細胞懸液并放置于離心管中,然后,再加入適量高糖培養基,封口。以轉速500 r/min進行離心處理,時間為10 min。之后采用吸管將上清液吸取棄掉,并再次加入高糖培養基,并輕輕吹打成懸液,再利用計數板進行計數,將其接種于培養皿,然后放置于37 ℃、5% CO2的培養箱中進行培養。待24 h后對細胞形態進行觀察,如細胞貼壁且呈長梭狀、突起明顯則說明細胞復蘇良好,并再次更換培養液以繼續培養。
PC12細胞傳代:工作前30 min將紫外燈打開消毒,培養基和PBS緩沖液等放置于溫度為37 ℃的水浴中預熱30 min;當PC12細胞密度在70%~80%時可進行傳代,并采用PBS緩沖液清洗1次細胞,然后再次加入適量消化液,待肉眼可見白霧狀且顯微鏡下可見細胞間隙變大則可吸出消化液。加入適量高糖培養基,輕輕吹打以使其脫壁,并將其制作成細胞懸液,然后將其沿著蓋玻片邊緣滴于細胞計數板內。顯微鏡下觀察提示PC12細胞狀態較好,且密度為70%~80%時可開始細胞凍存。
通過建立PC12細胞缺血再灌注受損細胞模型,分別于缺氧環境中培養0、3、6、9、12、15 h以進行糖氧剝奪,之后再將其放入至高糖培養基中再次復氧培養24 h,然后利用MTT來檢測細胞存活率,并對其進行分組,分為正常組、缺血再灌注組(A組)、缺血再灌注+溶劑對照組(B組)、缺血再灌注+LPA2激動劑組(C組)、缺血再灌注+LPA2抑制劑組(D組)。先進行缺氧培養一定時間后再復氧培養24 h,并采用MTT(美國Amresco公司)檢測細胞存活率,同時采用BCA法檢測LPA2受體與P-akt蛋白的表達情況。
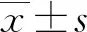
2 結 果
2.1PC12細胞缺氧存活率 缺氧0、3、6、9、12、15 h時的細胞存活率分布為100.0%、94.1%、81.2%、55.2%、49.2%、42.1%。隨著缺氧時間的增加,PC12細胞存活率呈下降趨勢,且缺氧后再復氧進行培養,結果顯示細胞存活率顯著下降(P<0.05)。
2.2各組細胞P-akt與LPA2受體表達情況 A組LPA2表達水平明顯低于B組;C組與B組相比較,LPA2表達水平顯著增高,且P-akt表達水平顯著增高,差異有統計學意義(P<0.05)。見圖1、2。

圖1 各組LPA2表達水平比較

圖2 各組P-akt表達水平比較
2.3各組細胞存活率比較 正常組、A組、B組、C組、D組細胞存活率依次為100.0%、48.6%、44.1%、69.8%、43.1%。經糖氧剝奪后,細胞存活率明顯下降,然加入激動劑后,細胞存活率明顯提高(P<0.05)。
3 討 論
缺血性腦卒中是一種發病率較高的腦血管疾病,具有較高病死率和致殘率,給人類生存質量造成極大影響[6-7]。在缺血性腦卒中患者發病早期階段,患者局部腦缺血將形成中心壞死區和周圍缺血半暗帶區,其中壞死區域中神經元將會逐漸死亡,而半暗帶區因存在側支循環而有大量神經元存活[8]。因此,如可在短時間內恢復患者半暗帶區血流供應,此時患者神經元仍可恢復功能;然而對于中心區域壞死區,即便恢復血供也會發生再灌注損傷,從而導致患者腦損傷,所以針對壞死區域已無法再挽救,只能進行有效保護,加強神經營養等。所以,缺血性腦卒中患者早期治療的目的是促進患者缺血半暗帶區域神經元功能的恢復。
LPA是一種類似生長因子的磷脂,廣泛存在于中樞神經系統中,如腦膜、胚胎大腦及血管等,其以極低水平出現于人體腦脊液中,且在人體血液成分中表達顯著,以血清清蛋白結合形式存在。LPA主要來源于被激活的血小板,但某些內皮細胞和炎癥細胞也可產生LPA。神經系統是LPA受體表達的主要部位,且人體大腦中LPA以較高水平存在,LPA與LPA2信號傳遞也會參與神經損傷反應。在腦梗死發病早期階段,缺血腦組織部位LPA水平相對較高,LPA參與到神經損傷過程中[9]。有研究發現,LPA2具有抗凋亡的作用[10-11]。本研究通過對PC12細胞實施糖氧剝脫后再繼續培養以模擬人體內糖氧剝奪現象,結果顯示,當缺氧6 h后,細胞存活率明顯下降,12 h時的存活率為49.2%,且此時細胞形態結構開始出現破壞,隨著缺氧時間的延長,細胞形態結構破壞程度明顯增加,甚至開始出現破裂等現象。通過研究發現,采用缺氧12 h時的細胞來模擬缺血半暗帶區具有一定價值,也是拯救細胞存活的關鍵[12-13]。本文對缺氧12 h的PC12細胞再次進行分組研究,結果顯示經糖氧剝奪后,LPA2受體表達與B組無明顯差異,由此可排除溶劑的影響。經使用激動劑后,LPA2受體表達明顯增加,但D組較B組LPA2受體表達明顯下降,說明經實施糖氧剝奪后,LPA2受體表達出現下降,且細胞存活率下降,但采用激動劑則可提高LPA2受體表達,同時增加細胞存活率[13-14]。
4 結 論
提高LPA2受體表達水平有利于避免細胞凋亡,對細胞起到一定保護作用,所以,利用溶栓早期治療缺血性腦卒中具有較好的效果。隨著LPA2受體的深入研究和應用,有望缺血性腦卒中患者神經功能恢復得到新的突破。

