高脂飼料誘導幼鼠非酒精性脂肪肝模型的建立
林敏華 鄧桂清 歐宇軒 陳芷琳 黃佳栓 康美霞 李錦新
1 廣州醫科大學兒科學院,廣東省廣州市 511436; 2 廣州醫科大學第三臨床學院;3 廣州醫科大學市一臨床學院; 4 廣州醫科大學第一臨床學院; 5 廣州醫科大學基礎醫學院
兒童型非酒精性脂肪肝病(Non-alcoholic fatty liver disease,NAFLD)是一種除外酒精及其他明確肝損害因素,以肝細胞彌漫性脂肪變為主要特征的臨床病理綜合征[1]。我國兒童型NAFLD發病率為3.4%,隨著兒童超重、肥胖發生率增加,NAFLD已成為我國兒童最常見的慢性肝病之一[2],若NAFLD長期遷延不愈,可導致患兒在成年時罹患心腦血管病、糖尿病等疾病的風險增高。目前尚未證實何種藥物治療兒童型NAFLD有效,有關發病機制、藥物治療研究甚少。基礎研究方面,兒童型NAFLD造模文獻也較少。因此本實驗通過高脂飲食誘導建立幼鼠NAFLD模型,為基礎研究提供可靠且病變符合兒童型NAFLD的動物模型。
1 材料和方法
1.1 實驗動物 3周齡雄性SD幼鼠SPF級,體質量50~80g,由廣東省實驗動物中心提供。
1.2 主要試劑與儀器 丙氨酸氨基轉移酶試劑盒,天門冬氨酸氨基轉移酶試劑盒,葡萄糖試劑盒,甘油三酯試劑盒,總膽固醇試劑盒,高密度脂蛋白試劑盒,低密度脂蛋白試劑盒, 上海科華生物工程股份有限公司;大鼠胰島素(INS)ELISA Kit,武漢基因美生物科技有限公司;7020型全自動生化分析儀,日本日立公司;ST-360型酶標分析儀,上海科華實驗系統有限公司。
1.3 方法
1.3.1 飼料的制備:委托廣東省實驗動物中心制備高脂飼料,能量為5.24kcal/g,具體配比為:酪蛋白≥88%為200g/kg,L-胱氨酸為3g/kg,麥芽糖糊精為125g/kg,蔗糖為68.8g/kg,纖維素為50g/kg,豆油為25g/kg,豬油為245g/kg,礦物質AIN-93為35g/kg,維生素AIN-93為10g/kg,氯化膽堿為2.5g/kg;普通飼料能量3.4kcal/g,購自廣東省實驗動物中心。
1.3.2 動物模型的制備:3周齡雄性SD幼鼠16只,隨機分為對照組和造模組,每組8只。適應性飼養3d后,對照組每天喂養普通飼料,造模組每天喂養高脂飼料,每組予自由飲水和自由進食,連續飼養6周。廣州醫科大學實驗動物中心提供清潔無塵、適宜溫濕度、良好采光的飼養環境。
1.4 觀察指標
1.4.1 一般情況:實驗期間,觀察大鼠生活習性、毛發顏色、行為習慣等特點,每周記錄幼鼠體重及進食量。
1.4.2 肝臟質量與肝指數: 6周后,大鼠禁食24h,腹腔注射1%戊巴比妥4mg/kg麻醉,心臟采血5ml,取肝稱重。肝指數=(肝臟質量/體質量)×100%。
1.4.3 血清生化指標檢查: 檢測血清中門冬氨酸氨基轉移酶(AST)、丙氨酸氨基轉移酶(ALT)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、血糖(GLU)、膽固醇(CHO)、胰島素(INS)含量,計算胰島素抵抗(HOMA-IR,HOMA-IR=GLU×INS/22.5)。
1.4.4 肝組織病理學檢查: (1)石蠟切片與HE染色:新鮮肝臟用bouin液固定24h,經梯度酒精脫水,TO透明劑透明,石蠟包埋,切片后,行HE染色。鏡下觀察脂肪變情況并進行NAFLD活動度評分(NAFLD activity score,NAS),評分標準參照美國國立衛生研究院NASH臨床研究網病理工作組指南。(2)冰凍切片與油紅染色:新鮮組織用4%多聚甲醛固定,經梯度蔗糖溶液脫水,OCT包埋,冰凍切片后,行油紅染色。觀察肝組織脂質沉積情況。
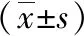
2 結果
2.1 一般情況 實驗期間,造模組體質量增長較對照組稍快(圖1),每周平均進食熱量均高于對照組(圖2),每周平均進食量均低于對照組(圖3)。6周后,造模組體質量顯著高于對照組(P<0.01),見表1,大鼠毛發稍蓬松,毛色變暗。
圖1各組幼鼠每周體重增長變化曲線 圖2各組幼鼠平均進食熱量曲線 圖3每周每只幼鼠進食總量變化曲線
2.2 肝臟質量與肝指數 對照組肝臟呈紅褐色,邊緣尖銳,質地柔軟,富有彈性。造模組肝臟體積增大,外表可見廣泛分布的黃色細顆粒,肝臟色澤暗沉,邊緣厚鈍,有油膩感,彈性較差,造模組肝臟質量、肝指數均高于對照組,差異有統計學意義(P<0.05),見表1。
2.3 血清相關指標 造模組GLU較對照組明顯升高,差異有統計學意義(P<0.05);造模組HOMA-IR較對照組顯著升高,差異有統計學意義(P<0.01);造模組 AST、ALT、HDL、LDL、TG、CHO、INS 較對照組均有所上升,差異無統計學意義,見表1。
表1 高脂飲食對幼鼠各項指標的影響
注:與對照組相比,*P<0.05,#P<0.01。
2.4 肝組織病理學改變
2.4.1 HE染色。光鏡下觀察對照組幼鼠肝組織(圖4),顯示正常肝組織結構。造模組幼鼠肝細胞體積增大,細胞質中出現大小不等的脂肪空泡,細胞核被推向一邊,部分區域可見炎細胞浸潤(圖5)。
NAS評分:造模組評分顯著高于對照組(P<0.01),且造模組中87.5%大鼠肝脂肪變程度>33%,提示可診斷為NAFLD,見表2。
2.4.2 油紅染色。對照組肝組織幾乎無著色,造模組肝細胞中的脂滴被染成橘紅色(圖6)。
3 討論
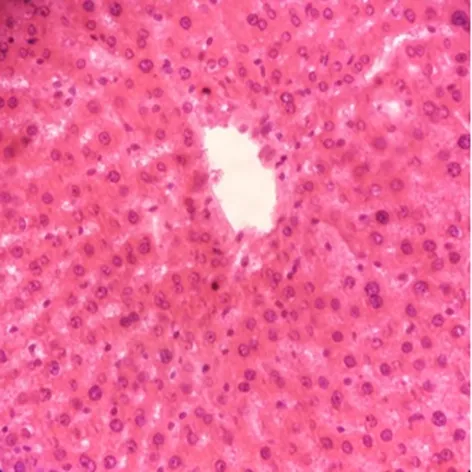
圖4 對照組(HE染色,×400)
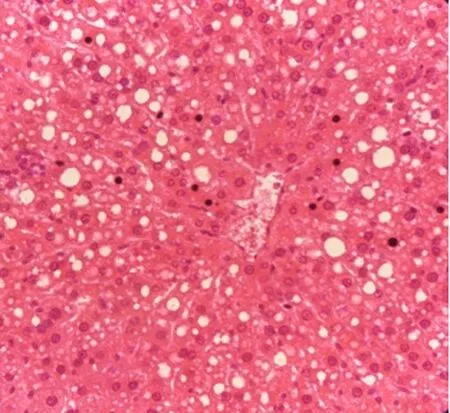
圖5 造模組(HE染色,×400)

組別肝細胞脂肪變<5%5%~33%34%~66%>66%總分(x±s)對照組62000.25±0.46造模組01342.37±0.74?
注:與對照組相比,*P<0.01。

圖6 造模組(油紅染色,×400)
目前認為二次打擊是NAFLD主要發病機制,胰島素抵抗引起肝臟中脂質堆積,是NAFLD的第一次打擊,第二次打擊是氧化應激與脂質過氧化損傷。長期食用高脂飼料的幼鼠極易發生IR[8],游離脂肪酸(FFA)增多,脂類物質轉運障礙,脂類物質CHO、TG蓄積于肝臟,VLDL也相應增加。過量的FFA有肝細胞毒性,可加速線粒體β氧化,產生大量的活性氧簇(Reactive oxygen species,ROS)觸發過氧化反應,形成脂質過氧化物;脂質過氧化物增強ROS毒性并減少ROS滅活;如此一來,形成了ROS增多和脂質過氧化增多的惡性循環[9-11],最終脂質大量累積,發展為非酒精性脂肪肝病。
從發病機制來看,造模組幼鼠肝重與肝指數較對照組高,與脂肪物質對肝細胞的毒性作用有關。肝組織出現炎癥浸潤和脂肪變,因為脂質積聚可增加促炎細胞因子的產生,如腫瘤壞死因子-α(TNF-α)和白細胞介素-6(IL-6)[12],這些炎癥因子的升高也可提示肝組織的病變情況[13]。
部分NAFLD患兒會伴隨有血脂與肝酶的異常和胰島素抵抗,然而造模組AST、ALT、HDL、LDL、TG、CHO、INS等有上升趨勢但差異無統計學意義。可能是因為并非所有患兒均表現為肝酶譜和血脂代謝的異常,故目前肝酶譜和血脂指標都不作為獨立的診斷標準[14],特別是ALT,在臨床上盡管ALT正常也不可輕易排除NAFLD,ALT正常的患兒仍可有肝組織脂肪變[15]。另外,隨著胰島素敏感性和糖處理能力下降,患兒容易并發高血糖和高胰島素血癥[16]。雖然造模組INS差異無統計學意義,但GLU和HOMA-IR差異均有統計學意義,而且HOMA-IR被認為與NAFLD存在正相關關系[17]。
本研究造模組體質量、肝質量和肝指數明顯增高,病理改變、NAS評分結果符合兒童型NAFLD的病理特征,存在高血糖、胰島素抵抗現象,證明高脂飲食可誘導幼鼠NAFLD,可為未來該病發病機制、防治等方面研究提供可靠的動物模型。

