糖尿病前期胰島β細胞分泌延遲的特征及機制
何穎 莊勤 陳哲 紀新博 陳菊明 鄧芷琳 趙舒然 李飛艷
(1海南醫學院第一附屬醫院,海南 海口 570311;2海南醫學院臨床醫學專業本科生)
糖尿病流行病學研究報告顯示我國成年人糖尿病患者占10.4%(約9 240萬例),認為可能是世界上糖尿病患病人數最多的國家〔1〕。而糖尿病前期(IGR)患病人數高達15.5%,近1.5億例〔1〕。遠高于糖尿病患者人數,是2型糖尿病(T2DM)的最重要的危險人群及后備軍。本研究針對IGR人群,探討其胰島β細胞在胰島素分泌的量、時間、分泌模式等方面所表現的特征,進一步認識糖代謝異常逐步進展過程中胰島β細胞功能缺陷的變化與機制。
1 對象與方法
1.1 研究對象 2017年10月至2018年5月海南醫學院第一附屬醫院老年科門診及病房及體檢中心患者。納入方法:依納入時間次序作為研究序號。第一個納入者為1,納入IGR受試者27例,T2DM患者29例。IGR與T2DM的診斷均采用1999年世界衛生組織(WHO)糖尿病診斷標準。IGR組:年齡(54.24±14.24)歲,男13例,女14例,病程0~15年。T2DM組年齡(56.37±13.56)歲,男14例,女15例;病程0~20年。入選標準:IGR及T2DM近1個月內均未接受任何促胰島素分泌劑〔磺脲類、列奈類、二肽基肽酶(DDP)-4抑制劑〕及長效胰島素治療。排除1型糖尿病;近1個月內無糖尿病相關急性并發癥、無心血管、腦血管急性重癥疾病事件、無惡性腫瘤疾病;近3個月未使用過糖皮質激素、特殊營養品等影響糖代謝的藥物,受檢前12 h停用任何控制血糖及血脂的藥物。T2DM組應用短效胰島素治療者16例,使用二甲雙胍者、糖苷酶抑制劑者13例。IGR組空腹血糖受損(IFG)4例、糖耐量異常(IGT)23例均未應用藥物控制血糖。受檢前1 w內無急性上呼吸道感染及腸道感染等感染性疾病;肝、腎功能正常;未采用妊娠及哺乳期病例。已獲海南醫學院第一附屬醫院倫理委員會批準。
1.2 方法
1.2.1 一般狀態評估 禁食8 h后,于清晨空腹,禁飲水,采集靜脈血檢測肝、腎功能全項、總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)及糖化血紅蛋白(HbA1c)、空腹血糖(FPG)、空腹胰島素(FINS)及空腹C肽(C-P)。
1.2.2 β細胞功能評估 采用標準饅頭餐試驗。方法:空腹狀態下10 min內進食標準饅頭1個,于開始進食時計30、60、120、180 min分別采靜脈血檢測各時點血糖、胰島素(INS)及C-P。標準饅頭餐 :以0.5 kg市場出售的標準面粉(香滿園牌),加入酵母粉4 g,清水200 ml,混勻,揉成面團,靜置發酵60 min。以天平秤平均分成5份,水蒸約20 min。制成含100 g/個標準面粉的饅頭。制作單位:海南醫學院第一附屬醫院職工食堂。
1.2.3 檢測方法 肝、腎功能、TC、TG、HDL-C、LDL-C等采用全自動生化儀(Beckman CX-7 Biochemical Autoanalyser,Brea,CA,USA)測定。血糖采用葡萄糖氧化酶法測定;HbA1c采用高壓液相法檢測,各時點INS、C-P采用化學發光法檢測。
1.2.4 胰島素抵抗及胰島β細胞功能的評估 ①胰島素抵抗的評估采用國際通用的穩態模型評估方法,即以胰島素抵抗指數(HOMA-IR)評估,計算公式為HOMA-IR= FPG×FINS/22.5。以胰島素分泌指數(HOMA-β),評估空腹時β細胞分泌功能,計算公式為HOMA-β=20×FINS/(FPG-3.5)。②分別對比研究IGR組與T2DM組在空腹、餐后30、60、120、180 min 5個時點胰島素分泌量的變化、分泌模式的變化。
1.3 統計學處理 采用SPSS17.0 統計軟件分析,HOMA-IR及HOMA-β為非正態分布的數據,將其行自然對數轉化后呈正態分布數據,記作HOMA-IR*及HOMA-β*。各時段INS及C-P分泌多為偏態分布,均以M(Q1,Q3)表示,兩組間數據的比較采用t檢驗、χ2檢驗、秩和檢驗。
2 結 果
2.1 兩組一般臨床資料對比 IGR組體重指數(BMI)、TG、LDL-C水平顯著高于T2DM組,差異有統計學意義(P<0.05);兩組TC、HDL-C差異無統計學意義(P>0.05),見表1。
2.2 胰島素抵抗及空腹胰島素分泌功能比較 IGR組HOMA-IR明顯低于T2DM組(P<0.05),提示從IGR到T2DM,胰島素抵抗逐漸加重;HOMA-β明顯高于T2DM組(P<0.05),說明從IGR到T2DM,胰島β細胞基礎分泌功能逐漸減退,見表1。
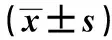
表1 兩組一般資料及HOMA-IR、HOMA-β水平比較
2.3 兩組各時段INS、C-P分泌量及高峰分泌量的對比 FINS及空腹C-P有顯著差異,IGR組明顯高于T2DM組(P<0.05)。餐后30 min(早時相)、餐后60 min及高峰時INS、 C-P,IGR組均明顯高于T2DM組(P<0.05);餐后120 min兩組INS無顯著差異(P>0.05);C-P分泌量IGR組與T2DM組有顯著差異(P<0.05);餐后180 min(晚時相)INS、C-P,兩組差異無統計學意義(P>0.05)。見表2。

表2 兩組INS、C-P各時段分泌量及高峰分泌量比較〔M(Q1,Q3)〕
2.4 兩組INS、C-P分泌延遲變化對比、高峰分泌時間對比 IGR組β細胞分泌高峰時間集中在餐后60 min,T2DM組集中在餐后120 min;IGR組早時相(餐后30 min)高峰者占25.92%/18.52%(INS/C-P);T2DM組早時相高峰者占6.70%/0.00(INS/C-P);IGR組晚時相高峰者(餐后180 min)為0.00/0.00(INS/C-P),T2DM組晚時相高峰者占17.23%/20.69%(INS/C-P)。提示IGR階段已出現明顯胰島素分泌延遲及早時相分泌缺損。T2DM的延遲及早時相缺損更加顯著,并分泌高峰繼續后移,出現晚時相高峰。兩組高峰分泌時相對比有顯著差異(P<0.05)。見表3。

表3 兩組INS、C-P分泌高峰時相比較〔n(%)〕
3 討 論
本研究提示,IGR期β細胞胰島素及C-P分泌時相及分泌量均發生了異常,并伴脂代謝異常、肥胖、體重增加等特征。國內外相關研究報道〔2〕:如Kim等〔3〕對20~79歲的IGR成年人進行連續隨訪評估,通過穩態模型HOMA-IR和HOMA-β對β細胞進行胰島素抵抗和胰島素分泌功能的評估,提示在IGR期存在明顯的胰島素抵抗、胰島素水平代償性增高,且在隨訪過程中9.4%的受試者胰島素抵抗加重及胰島β細胞的分泌功能下降,進展為T2DM。Kabadi〔4〕將120例包括正常血糖,IGR、T2DM的受試者,依BMI分成肥胖和非肥胖兩組,結果兩組受試者從正常血糖到IGR、到T2DM胰島素抵抗逐漸加重,在IGR階段血糖及胰島素分泌已出現異常,胰島素代償性分泌增多〔5,6〕,隨病情進展胰島素分泌量逐漸減少,進入T2DM。本研究中IGR組受試者空腹、早時相30 min,60 min,及高峰胰島素分泌量均高于T2DM,即為此期胰島素抵抗-T2DM早期病理生理改變所致。
本課題的一般資料研究顯示IGR組BMI、TG、LDL-C水平高于T2DM。脂代謝異常重于T2DM。Kabadi〔4〕研究也有報告肥胖、體重增加是IGR期胰島素抵抗的重要體征,與IGR期胰島素水平增高相關。有動物實驗對其相關機制研究:高脂飲食誘導的肥胖大鼠〔7〕體重增加、內臟脂肪量、血清游離脂肪酸和肝臟脂質沉積,降低了肝臟糖原含量和胰島素敏感性,出現胰島素抵抗。并且發現肥胖狀態下肝臟肝泛素特異性蛋白酶(USP)4、雙特異性磷酸酶(DUSP)14等蛋白水平變化,導致TGFβ激活的激酶(TAK)1磷酸化增強和胰島素信號轉導受損而致胰島素抵抗。所以IGR肥胖、高胰島素血癥可能是T2DM早期的重要信號與體征。Kulkarni等〔8〕對墨西哥裔美國人血漿脂質濃度與T2DM、IGR和胰島素抵抗的遺傳相關性研究提示:在眾多脂質類型中TG與T2DM風險、IGR相關,并具有遺傳性。甚至有研究報道〔9,10〕空腹血漿TG濃度尤其能反映IGR患者的胰島素抵抗。也有其他實驗研究報道〔11,12〕IGR患者血清C反應蛋白(CRP)、γ-谷氨酰轉移酶(GGT)和尿酸水平較高,并認為與IGR期胰島素抵抗、非酒精性脂肪肝有相關性。本研究中IGR組BMI及TG、LDL-C水平顯著高于T2DM組,與以上研究結果吻合,說明脂代謝異常是IGR期重要的臨床特征,因此臨床上僅對T2DM高危人群篩查血糖可能會漏掉T2DM早期胰島素代謝異常人群,應該對肥胖、高BMI等人群早期篩查β細胞分泌功能,評價其胰島素抵抗,予以早期干預,降低T2DM患病率。但是本研究中IGR組HOMA-IR明顯小于T2DM,即從IGR到T2DM胰島素抵抗逐步加重,但是并未見到T2DM組肥胖、BMI、TG等增加。其原因認為從IGR向T2DM進展過程中,體重、內臟脂肪量、血清游離脂肪酸和肝臟脂質沉積的增加,肝臟糖原含量及胰島素敏感性逐步降低〔7〕,使胰島素抵抗的相關機制TAK1磷酸化、胰島素信號轉導受損等逐步加重,導致血糖升高。另一方面內臟脂肪的增加使巨噬細胞遷移抑制因子表達增多〔13〕,加劇胰島慢性炎癥反應;也有報道線粒體功能紊亂〔14〕,線粒體活性氧自由基生成與清除平衡被打亂,氧化能力下降;葡萄糖轉運體表達減少,葡萄糖氧化能力減弱等病理改變,加劇β凋亡,影響β細胞功能,使胰島素分泌量逐步減少。因此胰島素促進糖的利用、脂肪的合成的能力減弱,體重下降。所以臨床見到伴隨T2DM進展,胰島素分泌量越來越少,但肥胖也少,甚至消瘦,BMI、TG等降低。
IGR期β細胞分泌時相的變化是本研究的重點,結果提示在IGR階段β細胞早時相分泌已經受損,峰值后移,這是IGR階段,糖耐量減低、餐后血糖增高的重要因素〔15〕。Iwahashi等〔15〕的研究發現在正常糖耐量者(NGT)及IGT者中均出現胰島素濃度峰值時間后移,NGT出現在60 min,IGT者峰值出現在120 min。Takahashi等〔16,17〕的研究報告無論NGT及IGT出現胰島素分泌延遲其患糖尿病的風險將更高,并提出胰島素分泌模式可作為T2DM的預測。本研究IGR與T2DM對比,可見糖代謝異常進展,胰島素分泌逐漸延遲,這也說明餐后血糖增高不僅有胰島素量的不足,更有胰島素峰值延遲的因素。所以在IGT甚至NGT階段給予胰島素分泌功能的早期評估,可以篩查更早期的T2DM,進而早期干預,降低T2DM患病率。
目前以上相關研究國內外數據尙不多,β細胞分泌延遲機制的研究報道更少。Kimura等〔18〕報道在具有非糖尿病并發晚期較重纖維化的非酒精性脂肪肝病(NAFLD)受試者中胰島素濃度峰值延遲至120 min,說明胰島素分泌的延遲與脂肪肝有關,也有報道在IGR階段與肥胖有關〔19,20〕。本研究結果顯示,人體在IGT階段β細胞功能已經發生確切的T2DM的病理生理改變,不僅表現在INS分泌量的變化,更出現INS分泌模式的缺陷,使機體糖、脂代謝發生變化,表現血糖開始升高、脂質代謝異常,肥胖、體重增加等。因此應早期評價胰島β細胞功能,可篩查出更早期的T2DM。

