LncRNA NEAT1靶向miR-520b調(diào)控口腔鱗癌細(xì)胞增殖、凋亡及自噬的分子機(jī)制
王斌 呂錦 孔敏 王虎
(1成都市第一人民醫(yī)院口腔科,四川 成都 610041;2四川大學(xué)華西口腔醫(yī)院放射科)
非編碼RNA約占人類基因組的98%,其中包括長(zhǎng)鏈非編碼RNA(LncRNA)和短鏈非編碼RNA(miRNA)〔1〕。LncRNA為長(zhǎng)度在200個(gè)核苷酸以上的非編碼RNA,miRNA的長(zhǎng)度在19~25個(gè)核苷酸,兩者均可通過(guò)轉(zhuǎn)錄、轉(zhuǎn)錄后水平及表觀遺傳調(diào)控基因的表達(dá),進(jìn)而參與人類多種疾病的發(fā)生發(fā)展〔2〕。自噬為真核細(xì)胞的自身降解過(guò)程,與機(jī)體衰老、神經(jīng)退行性疾病、肥胖及癌癥均具有密切關(guān)系〔3〕。大量研究證實(shí),自噬在腫瘤中具有雙重作用,在腫瘤的不同階段發(fā)揮不同作用。非編碼RNA核富集的轉(zhuǎn)錄物(NEAT)1為新發(fā)現(xiàn)的一種Lnc RNA〔4〕,在口腔鱗癌中的作用機(jī)制尚未完全清楚。miRNA(miR)-520b在不同癌癥中發(fā)揮不同作用〔5,6〕,其在口腔鱗癌中的作用尚未完全清楚。本研究擬以口腔鱗癌細(xì)胞Tca8113為研究對(duì)象,觀察抑制NEAT1、過(guò)表達(dá)miR-520b、抑制miR-520b對(duì)Tca8113細(xì)胞增殖、凋亡和自噬的影響,為口腔鱗癌的治療提供新靶點(diǎn)。
1 材料與方法
1.1 材料 人口腔鱗癌細(xì)胞Tca8113、人正常口腔上皮細(xì)胞HOEC,均購(gòu)自美國(guó)菌種保存中心(ATCC);達(dá)爾伯克改良伊格爾(DMEM)培養(yǎng)基、胎牛血清、四唑鹽(MTT)、胰蛋白酶,均購(gòu)自美國(guó)GIBCO公司;LipofectamineTM2000、二喹啉甲酸(BCA)蛋白定量試劑盒、逆轉(zhuǎn)錄試劑盒,購(gòu)自大連Takara公司;聚偏二氟乙烯(PVDF)膜購(gòu)自德國(guó)羅氏診斷有限公司;十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)試劑盒、電化學(xué)發(fā)光(ECL)發(fā)光液和RIPA蛋白裂解液,均購(gòu)自碧云天生物技術(shù)公司;雙熒光素酶報(bào)告基因檢測(cè)試劑盒,購(gòu)自美國(guó)Promega公司;Annexin V-FITC/PI凋亡檢測(cè)試劑盒購(gòu)自北京索萊寶公司。
1.2 方法
1.2.1 細(xì)胞培養(yǎng) 用含10%胎牛血清的DMEM培養(yǎng)基培養(yǎng)Tca8113、HOEC,置于37℃、5% CO2的培養(yǎng)箱中常規(guī)培養(yǎng)。
1.2.2 細(xì)胞轉(zhuǎn)染 將si-NC、si-NEAT1、miR-520b mimics、miR-NC、si-NEAT1+anti-miR-NC、si-NEAT1+anti-miR-520b按照脂質(zhì)體LipofectamineTM2000說(shuō)明書操作步驟要求轉(zhuǎn)染至Tca8113細(xì)胞,分別標(biāo)記為si-NC組、si-NEAT1組、miR-520b組、miR-NC組、si-NEAT1+anti-miR-NC組、si-NEAT1+anti-miR-520b組,轉(zhuǎn)染48 h后,采用qRT-PCR實(shí)驗(yàn)檢測(cè)轉(zhuǎn)染效率。轉(zhuǎn)染成功后,用于后續(xù)試驗(yàn)。
1.2.3 qRT-PCR實(shí)驗(yàn) 取適量對(duì)數(shù)生長(zhǎng)期1.2.2各組細(xì)胞,遵照RNA抽提試劑盒說(shuō)明書要求提取RNA,進(jìn)行定量,然后應(yīng)用逆轉(zhuǎn)錄試劑盒按照說(shuō)明書操作合成cDNA。最后按照qRT-PCR試劑盒說(shuō)明書檢測(cè)miR-520b、NEAT1。用2-△△Ct計(jì)算miR-520b、NEAT1的表達(dá)水平。
1.2.4 MTT實(shí)驗(yàn) 取適量1.2.2各組細(xì)胞,加入5 g/L的MTT溶液20 μl,培養(yǎng)4 h,然后棄去上清,每孔加入150 μl DMSO,震蕩,使結(jié)晶溶解,在490 nm波長(zhǎng)下檢測(cè)細(xì)胞吸光度(A)。細(xì)胞的增殖力與細(xì)胞活力呈正比。
1.2.5 Annexin V-FITC/PI流式細(xì)胞術(shù)實(shí)驗(yàn) 取適量1.2.2各轉(zhuǎn)染組細(xì)胞,用結(jié)合緩沖液500 μl懸浮細(xì)胞,分別加入5 μl的 Annexin V-FITC和PI,混勻,室溫避光靜置15 min。采用流式細(xì)胞儀分析結(jié)果。細(xì)胞的凋亡率(%)= 早期凋亡率+晚期凋亡率。每個(gè)樣品重復(fù)3次。
1.2.6 Western印跡實(shí)驗(yàn) 收集1.2.2各組細(xì)胞,加入裂解液,冰上裂解30 min。12 000 r/min離心10 min,。取上清置于EP管,加入5倍SDS上樣緩沖液,沸水煮沸10 min。電泳后用轉(zhuǎn)膜儀將蛋白轉(zhuǎn)移至PVDF膜;5%脫脂奶粉將膜封閉2 h,洗膜,加入一抗,4℃過(guò)夜孵育,洗膜,加二抗,4℃ 2 h。加發(fā)光液,曝光。
1.2.7 雙熒光素酶報(bào)告基因檢測(cè)實(shí)驗(yàn) 取適量對(duì)數(shù)生長(zhǎng)期1.2.2各組細(xì)胞,遵照雙熒光素酶報(bào)告基因檢測(cè)試劑盒技術(shù)手冊(cè)要求操作。psiCHECK2載體以螢火蟲熒光素酶活性為內(nèi)參,psiCHECK2-NEAT1-3′UTR WT和psiCHECK2-NEAT1-3′UTR MUT的表達(dá)為對(duì)照,轉(zhuǎn)染24 h后,檢測(cè)熒光強(qiáng)度。海參熒光素酶的發(fā)光強(qiáng)度與螢火蟲熒光素酶發(fā)光強(qiáng)度的比值即反映miR-520b與NEAT1的結(jié)合力。
1.3 統(tǒng)計(jì)學(xué)處理 采用SPSS21.0軟件,計(jì)量資料多組間比較采用單因素方差分析,兩兩比較采用SNK-
q檢驗(yàn)。
2 結(jié) 果
2.1 NEAT1和miR-520b在人口腔鱗癌細(xì)胞Tca8113中的表達(dá) 與HOEC組相比,Tca8113組細(xì)胞中NEAT1表達(dá)顯著升高,miR-520b表達(dá)顯著降低(P<0.05)。見(jiàn)表1。
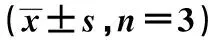
表1 NEAT1和miR-520b在Tca8113細(xì)胞和HOEC細(xì)胞中的表達(dá)
2.2 抑制NEAT1對(duì)Tca8113細(xì)胞增殖、凋亡的影響 與si-NC組相比,si-NEAT1組Tca8113細(xì)胞中NEAT1表達(dá)顯著降低,48、72 h時(shí)細(xì)胞活性顯著降低,細(xì)胞凋亡率顯著升高(P<0.05)。見(jiàn)表2。
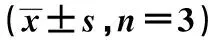
表2 抑制NEAT1表達(dá)對(duì)Tca8113細(xì)胞增殖和凋亡的影響
2.3 抑制NEAT1表達(dá)對(duì)Tca8113細(xì)胞自噬的影響 與si-NC組(0.36±0.04)相比,si-NEAT1組Tca8113細(xì)胞中LC3Ⅱ/Ⅰ蛋白表達(dá)量(1.07±0.08)顯著升高(t=13.749,P=0.000)。見(jiàn)圖1。
2.4 過(guò)表達(dá)miR-520b對(duì)Tca8113細(xì)胞增殖、凋亡和自噬的影響 與miR-NC組相比,miR-520b組Tca8113細(xì)胞中miR-520b表達(dá)顯著升高,48、72 h時(shí)細(xì)胞活性顯著降低,細(xì)胞凋亡率顯著升高,LC3Ⅱ/Ⅰ蛋白表達(dá)量顯著升高(P<0.05)。見(jiàn)表3,圖2。

圖1 抑制NEAT1表達(dá)對(duì)Tca8113細(xì)胞自噬相關(guān)蛋白LC3Ⅰ、Ⅱ表達(dá)的影響
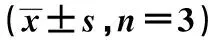
表3 過(guò)表達(dá)miR-520b對(duì)Tca8113細(xì)胞增殖、凋亡和自噬的影響
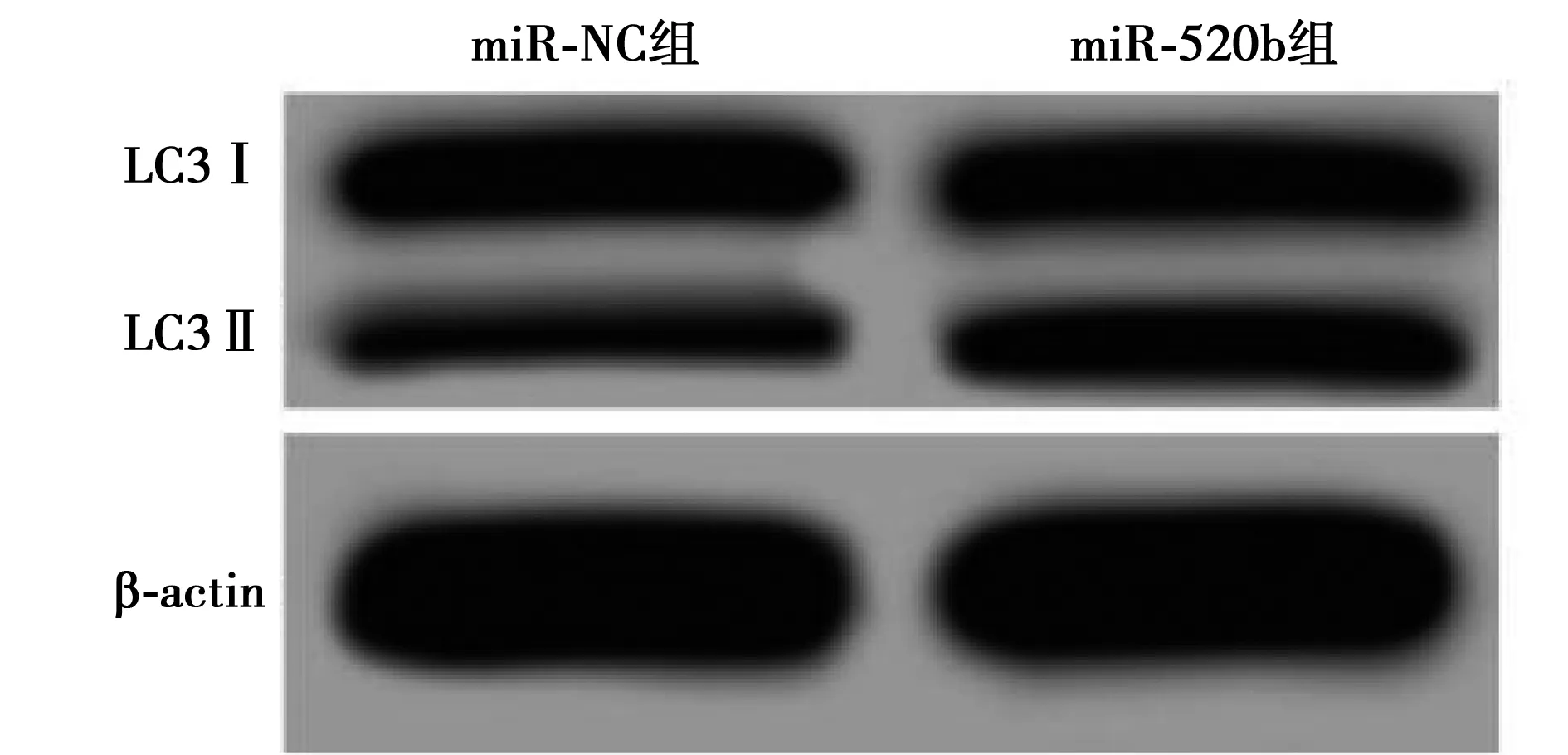
圖2 過(guò)表達(dá)miR-520b對(duì)Tca8113細(xì)胞LC3Ⅱ、Ⅰ表達(dá)的影響
2.5 NEAT1靶向miR-520b 運(yùn)用miRcode數(shù)據(jù)庫(kù)預(yù)測(cè)到miR-520b與NEAT1 3′UTR存在結(jié)合位點(diǎn)(圖3);雙熒光素酶活性檢測(cè)結(jié)果顯示,與miR-NC組相比,miR-520b組WT-NEAT1細(xì)胞中熒光活性顯著降低(miR-NC組:1.02±0.08,miR-520b組:0.41±0.05;t=11.199,P=0.000),MUT-NEAT1細(xì)胞中熒光活性不受影響(miR-NC組:1.04±0.07,miR-520b組:0.98±0.09;t=0.912,P=0.414)。與pcDNA組(0.45±0.04)比較,pcDNA-NEAT1組miR-520b水平(0.21±0.03)顯著降低(P<0.05);與si-NC組(0.42±0.05)比較,si-NEAT1組miR-52b水平(1.04±0.06)顯著升高(P<0.05)。
2.6 抑制miR-520b和抑制NEAT1對(duì)Tca8113細(xì)
胞增殖、凋亡和自噬的影響 與si-NEAT1+anti-miR-NC組相比,si-NEAT1+anti-miR-520b組Tca8113細(xì)胞在48、72 h細(xì)胞活性顯著升高,細(xì)胞凋亡率顯著降低,LC3Ⅱ/Ⅰ蛋白表達(dá)量顯著降低(P<0.05)。見(jiàn)圖4,表4。

圖3 NEAT1的3′UTR中含有與miR-520b互補(bǔ)的核苷酸序列

1~4分別為:si-NC;si-NEAT1;si-NEAT1+anti-miR-NC;si-NEAT1+anti-miR-520b圖4 LC3Ⅰ、LC3Ⅱ蛋白表達(dá)
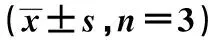
表4 抑制miR-520b和抑制NEAT1對(duì)口腔鱗癌Tca8113細(xì)胞增殖、凋亡和自噬的影響
3 討 論
NEAT1在許多人類癌癥中起關(guān)鍵作用〔7,8〕,與機(jī)體多種疾病的發(fā)生發(fā)展密切相關(guān)〔9〕。大量研究證實(shí),自噬在人類的多種腫瘤中存在異常,發(fā)揮抑制或促進(jìn)腫瘤的作用〔10~12〕。Liu等〔13〕在口腔鱗狀細(xì)胞癌中的研究發(fā)現(xiàn),與鄰近的非腫瘤組織和正常口腔角質(zhì)形成細(xì)胞相比,鱗癌組織和細(xì)胞系中NEAT1的表達(dá)顯著升高,且與患者的晚期臨床分期和較短的存活時(shí)間顯著相關(guān),抑制NEAT1表達(dá)導(dǎo)致鱗癌細(xì)胞遷移和侵襲顯著減少,伴隨著基質(zhì)金屬蛋白酶(MMP)-2和MMP-9蛋白表達(dá)的減少,miR-365的抑制消除了敲低NEAT1對(duì)鱗癌細(xì)胞遷移和侵襲的抑制作用,提示NEAT1通過(guò)抑制miR-365促進(jìn)OSCC細(xì)胞的遷移和侵襲,NEAT1可能為治療鱗癌的潛在靶點(diǎn)。Huang等〔14〕研究發(fā)現(xiàn),NEAT1在口腔鱗狀細(xì)胞癌中表達(dá)異常升高,且可負(fù)向調(diào)控低表達(dá)的miR-365,敲除NEAT1可抑制細(xì)胞增殖和侵襲并誘導(dǎo)細(xì)胞周期停滯在G0/G1期和細(xì)胞凋亡,而抑制miR-365消除了敲低NEAT1對(duì)細(xì)胞過(guò)程的抑制作用,且 RGS20是miR-365的直接靶標(biāo),可通過(guò)增強(qiáng)細(xì)胞活力和運(yùn)動(dòng)性逆轉(zhuǎn)過(guò)表達(dá)miR-365的腫瘤抑制作用,此外,RGS20、細(xì)胞周期蛋白D1、E-鈣黏蛋白、N-鈣黏蛋白和波形蛋白的表達(dá)可通過(guò)NEAT1/miR-365通路調(diào)節(jié),沉默NEAT1也可抑制體內(nèi)腫瘤生長(zhǎng),揭示了NEAT1/miR-365/RGS20通路可能是OSCC治療的新策略。本研究結(jié)果發(fā)現(xiàn),Tca8113細(xì)胞中NEAT1表達(dá)顯著升高,且抑制NEAT1可抑制Tca8113細(xì)胞增殖、促進(jìn)凋亡,這與Liu等〔13〕、Huang等〔14〕的研究結(jié)果相一致;進(jìn)一步研究發(fā)現(xiàn),抑制NEAT1能促進(jìn)Tca8113細(xì)胞的自噬。
miRNA失調(diào)或功能障礙會(huì)促進(jìn)或抑制癌癥的發(fā)展〔15,16〕。miR-520b在多種腫瘤中表達(dá)異常,其在卵巢癌中發(fā)揮促癌作用〔17〕,在膀胱癌中發(fā)揮抑癌作用〔18〕。梁雪〔19〕研究發(fā)現(xiàn),miR-520b可促進(jìn)食管鱗癌細(xì)胞和乳腺癌細(xì)胞的自噬,且過(guò)表達(dá)miR-520b可抑制腫瘤細(xì)胞的增殖、遷移和侵襲。Jin等〔20〕發(fā)現(xiàn),miR-520b過(guò)表達(dá)明顯抑制了體外肺癌細(xì)胞增殖,抑制miR-520b能夠加速肺癌細(xì)胞的增殖,敲低HDAC4逆轉(zhuǎn)了抑制miR-520b誘導(dǎo)的細(xì)胞增殖,且在臨床人肺癌樣品中觀察到miR-520b和HDAC4之間的負(fù)相關(guān),提示MiR-520b降低HDAC4表達(dá)以控制肺癌細(xì)胞的增殖。Cui等〔21〕發(fā)現(xiàn)miR-520b在膠質(zhì)瘤組織和細(xì)胞中低表達(dá),且miR-520b可抑制膠質(zhì)瘤細(xì)胞的葡萄糖代謝、侵襲、血管生成和化學(xué)敏感性,其機(jī)制與直接靶向負(fù)調(diào)控MBD2有關(guān),提示miR-520b在膠質(zhì)瘤中具有腫瘤抑制劑的作用。Lu等〔22〕在頭頸癌的研究中發(fā)現(xiàn),miR-520b可通過(guò)上皮-間質(zhì)轉(zhuǎn)化機(jī)制抑制癌細(xì)胞遷移和侵襲,并增加癌細(xì)胞對(duì)藥物和輻射治療的敏感性,其機(jī)制與miR-520b靶向調(diào)控CD44有關(guān),提示miR-520b為難治性HNC治療的新靶標(biāo)。本研究發(fā)現(xiàn),miR-520b在口腔鱗癌細(xì)胞中表達(dá)異常降低;進(jìn)一步研究發(fā)現(xiàn),過(guò)表達(dá)miR-520b可抑制Tca8113細(xì)胞增殖,促進(jìn)凋亡和自噬;雙熒光素酶報(bào)告基因檢測(cè)實(shí)驗(yàn)驗(yàn)證,NEAT1靶向負(fù)調(diào)控miR-520b,且抑制miR-520b可逆轉(zhuǎn)抑制NEAT1對(duì)Tca8113細(xì)胞的增殖抑制和凋亡促進(jìn)作用。綜上所述,NEAT1可促進(jìn)口腔鱗癌細(xì)胞的增殖并抑制凋亡和自噬,其機(jī)制可能與靶向調(diào)控miR-520b有關(guān),為口腔鱗癌的診斷、預(yù)防和治療提供了新的靶點(diǎn)。

