雙標細胞因子誘導的殺傷性細胞系構建
曹卉 高元慧 鄭琳麟 劉克輝 黃鄧高
(中南大學湘雅醫學院附屬海口醫院 1中心實驗室,海南 海口 570208;2放射科)
近年來,惡性腫瘤的免疫治療是腫瘤治療研究熱點。細胞因子誘導的殺傷性(CIK) 細胞是一群非組織相容性復合體(MHC)限制性的、有效抗腫瘤活性的免疫細胞〔1〕。CIK細胞在體外具有較高的腫瘤細胞毒活性、廣譜的腫瘤靶點和對正常組織的低毒作用,且其對部分腫瘤有確切療效,目前在臨床過繼免疫治療中有廣泛應用〔2~4〕。研究顯示〔5〕,CIK細胞能夠作為一種細胞載體作用于腫瘤組織。通過體內觀察CIK細胞的增殖、分布、靶向等生物學行為可以為研究CIK細胞抗腫瘤作用機制提供一些線索。然而,自體CIK治療效果仍不盡人意,具體作用機制仍不明確,體內實時動態觀察CIK細胞的作用效應仍然是目前研究的難點。
熒光素酶(Luc)是目前應用最廣泛的活體生物發光成像報告基因之一,Luc標記的生物發光現象可在活細胞內被觀測,且發光強度與標記細胞的數目呈正比,用其標記細胞后,通過活體成像系統可直接觀察標記細胞在小動物體內的生長、轉移等情況〔6,7〕。本研究擬構建Luc-GFP-CIK細胞系,為進一步探討小鼠體內觀察CIK細胞治療腫瘤,標記細胞的分布及靶向示蹤提供細胞來源,為腫瘤治療的機制研究提供理論依據。
1 材料與方法
1.1 實驗動物 SPF級雌性C57BL/6小鼠(廣東省醫學動物中心,SCXK(粵)2013-0002),6~8 w,體重18~22 g。
1.2 細胞及主要試劑及儀器 293T細胞(中科院上海細胞所),胎牛血清(FBS,BI公司);無血清RPMI1640培養基(BI公司);重組人干擾素(IFN)-γ、重組人白細胞介素(IL)-2、重組人IL-1α均購自上海生工;CD3 單克隆抗體(廣州BD公司);抗小鼠CD3-FITC抗體、抗小鼠自然殺傷(NK)1.1-PE抗體(廣州BD公司);螢火蟲Luc底物(美國,Caliper公司);手持細胞計數器(加拿大,Intelligent-Nano公司);細胞培養箱(美國,Thermo);實時定量PCR儀(瑞士,羅氏公司);熒光倒置顯微鏡(日本Olympus公司);流式細胞儀(美國,BD公司);小動物成像系統IVIS Spectrum(美國,PE公司);引物由上海捷瑞生物科技有限公司合成;測序工作由南京思普金生物科技有限公司完成。
1.3 脾細胞分離 采用斷頸法處死小鼠,置于75%乙醇中浸泡3 min,小鼠移至超凈臺無菌平皿中,剖開皮膚層,酒精棉球擦拭肌肉層,挑起肌肉層剪開后用止血鉗固定,暴露并取出脾臟,在無菌磷酸鹽緩沖液(PBS)中去除脂肪及膜組織,剪切并碾碎脾臟組織,無血清1640培養基重懸后,過篩網(400目)收集濾過液,加入3倍體積紅細胞裂解液,室溫靜置5 min,2 000 r/min離心10 min,棄上清,加入6 ml完全培養基(1640培養基+10%FBS+1%青鏈霉素),重懸細胞,2 000 r/min離心10 min,棄上清,加入2 ml完全培養基重懸細胞并計數。
1.4 CIK細胞培養 按2×106個/ml將細胞接種于3.5 cm培養皿中,加入1 000 U/ml重組人IFN-γ后置于5% CO2培養箱中37℃培養;24 h后加入50 ng/ml CD3單克隆抗體、300 U/ml重組人IL-2和100 U/ml的重組人IL-1α;每3天半量換液并補加重組人IL-2;第14天收獲CIK細胞。
1.5 CIK細胞表型檢測 取1×105個CIK細胞,加入抗小鼠CD3-FITC抗體、抗小鼠NK1.1-PE抗體,4℃避光孵育15 min后,1 000 r/min離心5 min,PBS洗3次,離心、棄上清,加入200 μl固定液,上流式細胞儀進行檢測、分析,鑒定CIK細胞。
1.6 目的基因獲得 根據Luc的DNA序列和pCD513B-1的MCS位點,設計特異性PCR引物,Luc正義引物:5′-CCGGAATTCGCCACCATGACTTCGAAAGT TTATGATCCAG-3′,Luc反義引物:5′-CGCGGATCCTCATTGTTCATTTTTGAGAACTCGC-3′,擴增片段1 144 bp。
1.7 pCD513B-1-Rluc的構建與鑒定 20 μl體系下37℃反應過夜,EcoR Ⅰ和BamH Ⅰ雙酶切pCD513B-1載體,通過T4 DNA連接酶,將PCR產物與雙酶切后pCD513B-1質粒的10 μl體系在22℃條件下反應16 h。取10 μl連接產物轉入200 μl新鮮制備的感受態細菌中,冰浴1 h,42℃熱激90 s,冰浴5 min,加入600 μl 37℃預熱的LB培養液,于37℃、220 r/min振搖1 h,離心后全部涂于含50 μg/ml Amp的LB平板,37℃倒置培養過夜。隨機挑取4個菌落增菌培養后抽提質粒PCR擴增。反應結束后,取10 μl產物進行瓊脂糖凝膠電泳鑒定。菌落經PCR鑒定為陽性克隆者進行測序,測序驗證后進行后續實驗。
1.8 病毒的包裝與檢測 轉染前24 h,將處于對數生長期293T細胞用無抗生素DMEM+10%FBS重懸后接種6孔板,2 ml/孔。待第2天細胞密度達到80%~90%融合度時,用配置好的質粒與脂質體混合物對6孔板中液體進行半量換液。培養 6~10 h后,棄掉含有DNA-脂質體復合物的培養基,以正常培養液DMEM+10%FBS進行換液并從此刻開始計算轉染時間。轉染24 h后,熒光顯微鏡下觀察轉染效率;轉染48 h后收集細胞上清液,3 000 r/min離心20 min,去除細胞沉淀,0.45 μm濾器過濾,2 000 r/min離心濃縮后分裝于-80℃貯存。取其中一支病毒液1 μl加入已接種293T細胞的3.5 cm小皿中,6 h后半量換液,過夜后全量換液,24 h后熒光顯微鏡下檢測并計算病毒滴度。根據表達GFP的293T細胞數目計算實驗組和對照組的病毒滴度。
1.9 CIK細胞病毒感染、篩選及單克隆化 取第14天CIK細胞,加入病毒顆粒(MOI=3),37℃培養6 h后半量換液,37℃培養過夜后全量換液。繼續培養24 h,檢測到熒光表達后加入嘌呤霉素(終濃度1.2 μg/ml)培養24 h,小心吸取上層細胞至新培養皿中37℃培養,3 d后計數并稀釋至10個細胞/ml,按100 μl/孔加至96孔板中繼續培養(完全培養基+300 U/ml重組人IL-2),6 d后吸取狀態較好的細胞轉移至3.5 cm培養皿中繼續培養(約12 d逐漸長滿,期間每3 d半量換液并補加重組人IL-2),待細胞長滿后進行Luc活性檢測。
1.10 Luc活性測定 取感染后的細胞2×106個離心棄上清,用新鮮配置含有底物的200 μl完全培養基重懸細胞,吹打均勻,將200 μl細胞懸液接種至96孔板中,進行等比稀釋。室溫靜止5 min,在Xenogen IVIS Spectrum 成像系統中采集圖像。
2 結 果
2.1 脾臟CIK細胞的培養與鑒定 脾臟單個核細胞在多種細胞因子作用下均處于增殖狀態,培養前3 d細胞小,數量少;第6天開始細胞數量開始倍增,鏡下可見細胞飽滿、聚集成團,呈集落樣生長;隨著時間的延長,集落數增多,細胞呈簇狀生長,見圖1。實驗取第14天細胞。
2.2 CIK細胞表型檢測結果 新鮮脾臟細胞由0.054% CD3+NK1.1-,0.000%CD3-NK1.1+,0.140% CD3+NK1.1+組成;第3天由2.120% CD3+NK1.1-,0.420%CD3-NK1.1+,2.640% CD3+NK1.1+組成;第7天由6.100% CD3+NK1.1-,0.860%CD3-NK1.1+,9.240% CD3+NK1.1+組成;第14天由23.400% CD3+NK1.1-,4.190%CD3-NK1.1+,43.000% CD3+NK1.1+組成,見圖2。
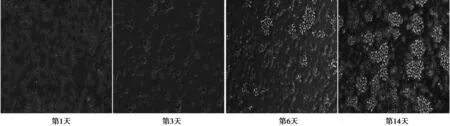
圖1 CIK細胞培養結果(×200)

圖2 CIK細胞表型鑒定結果
2.3 慢病毒表達載體的酶切鑒定及測序結果 載體pCD513B-1用EcoR Ⅰ和BamH Ⅰ進行雙酶切,PCR擴增,得到一條約1 100 bp的條帶(圖3),選取陽性克隆進行測序,結果與Luc序列一致。
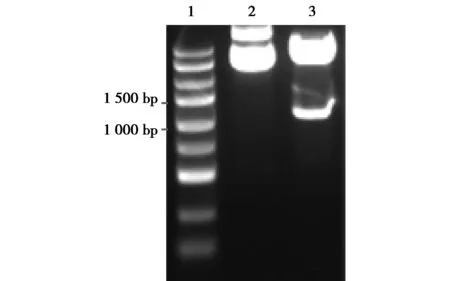
1.DNA Maker;2.未經酶切;3.雙酶切后圖3 載體酶切電泳
2.4 病毒感染結果 慢病毒感染24 h后,熒光顯
微鏡下實驗組及單克隆株組CIK細胞均表達GFP,實驗組細胞GFP表達水平高于單克隆株組細胞,見圖4。
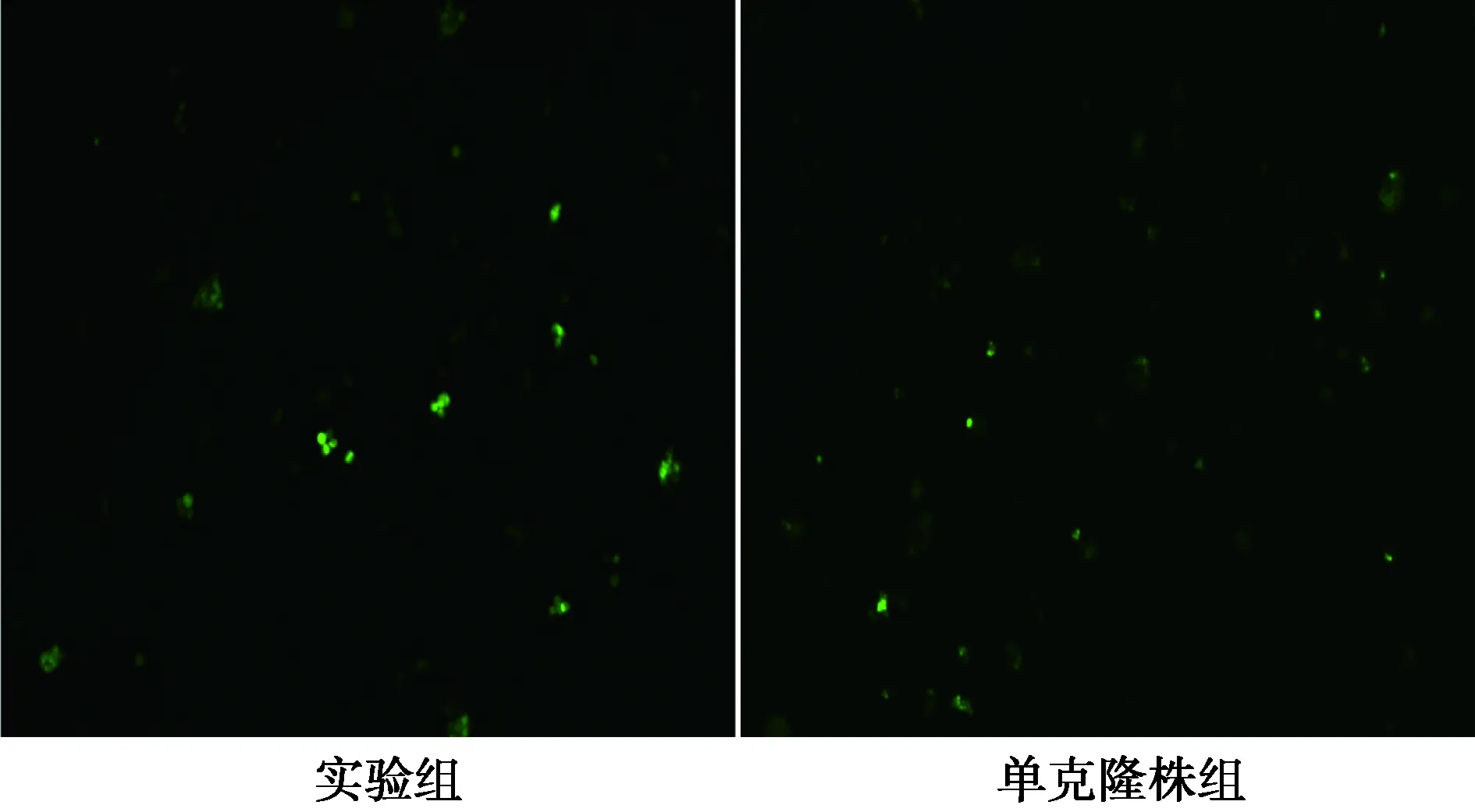
圖4 重組慢病毒感染CIK細胞后GFP表達的鏡下結果(×100)
2.5 Luc活性測定 活體成像系統下,檢測到實驗組生物發光信號隨著細胞數量的減少,發光強度下降,見圖5。
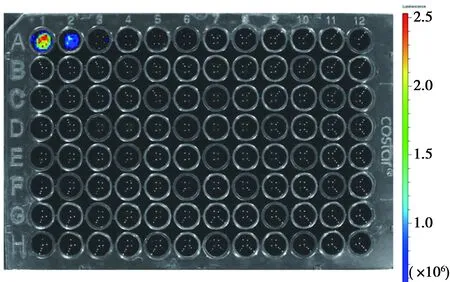
A1孔接種細胞1×106個,A2孔接種細胞5×105個圖5 重組慢病毒感染CIK細胞后活體成像系統下Luc發光檢測
3 討 論
過繼免疫療法是通過回輸體外擴增并激活的免疫細胞,如CIK、NK細胞及腫瘤浸潤淋巴細胞,以消除腫瘤細胞的一種方法〔8,9〕。有研究顯示,CIK細胞可通過體外培養外周血單個核細胞并定期添加CD3抗體及細胞因子IFN-γ、IL-2培養超過2 w來獲得〔9〕。CIK細胞是一種異質細胞群,本實驗從小鼠脾臟組織成功分離培養CIK細胞,通過流式細胞檢測技術鑒定顯示其構成比例主要由CD3+CD56+和CD3+CD56-及少部分CD3-CD56+細胞組成,與已報道文獻一致〔10〕。本次培養脾臟來源的CIK細胞,細胞量大,增殖速度快,第6天開始細胞數量開始倍增,聚集成團,呈集落樣生長,2 w左右即可獲得所需的實驗細胞。CIK有較好的臨床應用前景,但大多側重于患者生存期的比較,具體的作用機制和臨床應用尚未明確。CIK是如何歸巢并作用于腫瘤細胞、如何產生抗腫瘤效應鮮見報道。Kim等〔11〕在體外利用延時成像的方法對殺死單個腫瘤細胞所需的CIK細胞數量進行檢測,為腫瘤患者CIK細胞免疫治療的合理設計提供線索,提出在體內優化CIK細胞的活性并使其歸向腫瘤微環境可能是增加效應細胞數量的關鍵。徐贊美等〔12〕采用Ad5F11p-GFP 對CIK和NK細胞進行轉染,探討了轉染效率及轉染后細胞生物學特性的變化。但上述的課題組未進行動物體內研究,無法證實在體內CIK細胞的殺瘤活性是否與體外一致。另有學者報道〔13〕,利用表達GFP及Luc的肝癌細胞株構建肝癌動物模型,通過對發光的肝癌細胞數量的檢測來間接評價CIK細胞在體內外的殺瘤活性。這種方法在體內能夠對標記的腫瘤細胞進行直觀觀察,并測量體內腫瘤的大小來側面評價CIK細胞的活性。提示GFP及Luc可同時標記于同一細胞,可通過活體成像系統在體內實時追蹤和觀察。
普通細胞沒有光學特性,移植入動物體內不可觀察。通過體外特異性標志物標記后的細胞能夠實現活體內成像。小動物活體成像技術主要包括生物發光和熒光兩種技術,使用生物發光成像的技術來進行發光驗證,主要原因為:生物發光成像避免了動物本身自發熒光的干擾,這一技術利用Luc標記細胞或遺傳物質,加入底物熒光素后可以發生生物化學反應,利用小動物活體成像進行生物發光信號的采集。有報道〔14〕將轉基因小鼠GFP+C57BL/6與Luc+FVB-L2G85進行回交,取第十代B6-L2G85小鼠的脾臟進行原代培養,能夠獲取同時表達GFP及Luc的CIK細胞,并且在體內對CIK細胞的移植物抗宿主病(GVHD)的作用展開了深入研究。實驗中通過轉基因小鼠進行操作獲取GFP-Luc-CIK細胞,轉基因小鼠價格昂貴,不容易獲取,并且需要有專業的遺傳背景知識進行指導,操作難度大、周期長。本次實驗在體外利用慢病毒感染的方式對CIK細胞進行標記,成本較低,操作簡便、周期較短,或許可以作為替代實驗解決轉基因小鼠獲取困難、成本很高、操作復雜這一難題。CIK細胞具有體外易于擴增、對各種腫瘤細胞的非MHC限制的殺傷活性等優點而備受關注〔15~17〕。本實驗構建的Luc-GFP-CIK細胞株能夠解決研究條件有限不能從轉基因鼠獲取源細胞的問題,為小動物體內實時、動態觀察CIK細胞的分布及靶向治療腫瘤、評價CIK細胞的殺瘤活性提供細胞來源。

