超聲波處理對(duì)黑加侖果實(shí)多糖性質(zhì)與生物活性的影響
徐雅琴,杜明陽(yáng),楊 露,劉育松,魏 紅,鄭彬浩,郭瑩瑩,楊 昱*
(東北農(nóng)業(yè)大學(xué)理學(xué)院,黑龍江 哈爾濱 150030)
黑加侖別名黑穗醋栗,其果實(shí)富含多種維生素、糖類、有機(jī)酸和花青素等。研究發(fā)現(xiàn),黑加侖果實(shí)不僅是一種營(yíng)養(yǎng)豐富的水果,而且具有多種保健功效,如具有改善視功能、降血脂和降血壓等功效[1-2]。多糖是黑加侖果實(shí)主要活性物質(zhì)之一,具有抗腫瘤、抗炎、抗氧化和抗糖化等作用[3-4]。研究表明,天然多糖的生物活性受到其分子質(zhì)量和結(jié)構(gòu)特征的影響[5-6]。本課題組前期制備得到的黑加侖果實(shí)多糖大多具有較大的分子質(zhì)量,水溶性差,一定程度上影響了多糖的生物活性[7-8]。因此,選擇適宜的方法對(duì)黑加侖果實(shí)多糖進(jìn)行降解,制備不同低分子質(zhì)量多糖,可為篩選高活性黑加侖果實(shí)多糖提供依據(jù)。
超聲波作為一種綠色高效的降解方法,具有操作簡(jiǎn)單、可控性好的特點(diǎn),其在食品和醫(yī)藥工業(yè)中用于多糖的降解引起了廣泛的關(guān)注[9-10]。超聲波引發(fā)的多糖降解是由超聲空化(機(jī)械效應(yīng))引起的。超聲波處理誘導(dǎo)液體介質(zhì)內(nèi)部空化氣泡的快速形成和坍塌,產(chǎn)生強(qiáng)烈的壓力使多糖分子中共價(jià)鍵斷裂,進(jìn)而導(dǎo)致多糖的降解[8]。與化學(xué)降解和熱降解不同,超聲波降解是一個(gè)非隨機(jī)過(guò)程,其引起的壓力一般發(fā)生在分子的中心,并從內(nèi)向外輻射[10-11]。研究表明超聲不僅可以改變多糖的理化性質(zhì)(分子質(zhì)量、黏度、溶解度和流變性等),還可以提高多糖的生物活性,如抗氧化活性、抗腫瘤活性、抗炎活性[5-6,9-10]等。例如,Yan Jingkun等發(fā)現(xiàn)高強(qiáng)度超聲波處理能夠在短時(shí)間內(nèi)降低桑黃菌絲多糖特性黏度和分子質(zhì)量,而一級(jí)結(jié)構(gòu)基本沒(méi)有變化,同時(shí)降解多糖具有更高的羥自由基清除能力和總抗氧化能力[5]。Du Bin等利用超聲波降解Schizophyllum commune菌絲胞外多糖,結(jié)果表明,與原多糖相比,降解多糖分子質(zhì)量和黏度降低,抗炎活性顯著提高[6]。目前,關(guān)于超聲降解對(duì)黑加侖果實(shí)多糖的性質(zhì)和生物活性影響的報(bào)道較少。因此,本實(shí)驗(yàn)利用超聲波處理黑加侖果實(shí)多糖,制備兩種不同分子質(zhì)量多糖,對(duì)其理化性質(zhì)、結(jié)構(gòu)初步特征和體外生物活性進(jìn)行研究,以期為探究黑加侖果實(shí)多糖構(gòu)效關(guān)系提供參考。
1 材料與方法
1.1 材料與試劑
黑加侖(Ribes nigrum L.)為‘布勞德’成熟果實(shí),由黑龍江省東北農(nóng)業(yè)大學(xué)園藝站提供,-20 ℃冰箱真空密封冷藏備用。
木瓜蛋白酶 北京奧博星生物科技有限公司;果膠酶 上海藍(lán)季生物科技有限公司;D4006型大孔吸附樹(shù)脂 南開(kāi)大學(xué)化工廠;大豆卵磷脂 天津市光復(fù)精細(xì)化工研究所;所用試劑均為分析純。
1.2 儀器與設(shè)備
JY92-2D超聲波細(xì)胞粉碎機(jī) 寧波新芝生物科技股份有限公司;WFJ-7200型可見(jiàn)分光光度計(jì) 上海尤尼柯儀器有限公司;UV-2700雙光束紫外-可見(jiàn)分光光度計(jì)北京普析通用儀器有限責(zé)任公司;振動(dòng)黏度計(jì) 日本Sekonic公司;FTS135型傅里葉變換紅外光譜儀 美國(guó)Bio-Rad公司。
1.3 方法
1.3.1 黑加侖果實(shí)多糖的制備
根據(jù)課題組已探究的復(fù)合酶法制備多糖:黑加侖果實(shí)勻漿加入去離子水中,料液比為1∶20,加入木瓜蛋白酶0.3%(質(zhì)量分?jǐn)?shù),下同)、果膠酶0.15%,50 ℃下水浴振蕩50 min,然后沸水浴10 min后抽濾、濃縮,用3 倍體積的無(wú)水乙醇醇沉,4 ℃冰箱靜置過(guò)夜,粉紅色沉淀即為粗多糖。參考文獻(xiàn)[8]的方法,使用D4006型大孔樹(shù)脂對(duì)粗多糖溶液進(jìn)行純化。所得多糖溶液流水透析(截留分子質(zhì)量為3 500 Da)48 h。將透析后的多糖溶液進(jìn)行離心、濃縮、冷凍干燥,得到初步純化的多糖樣品,命名為原多糖(BFPs)。
1.3.2 黑加侖果實(shí)降解多糖的制備
利用超聲波細(xì)胞粉碎機(jī)對(duì)BFPs溶液(5.0 mg/mL)進(jìn)行降解。脈沖模式(開(kāi)1 s、關(guān)1 s),超聲溫度不高于50 ℃,超聲功率固定為700 W,降解時(shí)間分別為15 min和30 min。降解后多糖溶液經(jīng)透析(截留分子質(zhì)量為3 500 Da,48 h)、濃縮、冷凍干燥,得到兩種降解多糖UM-15和UM-30。
1.3.3 超聲降解對(duì)黑加侖果實(shí)多糖理化性質(zhì)的影響
1.3.3.1 黏均分子質(zhì)量
分別配制質(zhì)量濃度為5.0 mg/mL的原多糖和降解多糖溶液,利用烏氏黏度法[5]測(cè)定其特性黏度[η],代入Mark-Houwink方程:lg[η]=0.314 6 lg Mv-0.190 7,即可得到降解前后黑加侖多糖的黏均分子質(zhì)量(Mv)。
本實(shí)驗(yàn)Mark-Houwink方程確定方法如下:根據(jù)適合測(cè)定多糖Mv的Mark-Houwink非線性方程[η]=KMvα,得到公式lg[η]=lg K+αlg Mv,式中:[η]為特性黏度,Mv為黏均分子質(zhì)量,K為比例常數(shù),α為經(jīng)驗(yàn)參數(shù)。
通過(guò)測(cè)定葡聚糖標(biāo)準(zhǔn)品(T-40、T-110、T-500、T-2000)特性黏度[η],以lg[η]-lg Mv作圖,所得曲線斜率即為α值,截距即為lg K。
1.3.3.2 振動(dòng)黏度
分別配制質(zhì)量濃度為5.0 mg/mL的原多糖和降解多糖溶液,使用振動(dòng)黏度計(jì)測(cè)量其振動(dòng)黏度。
1.3.3.3 溶解度
參考Chen Jialun等的方法[12],并稍加修改。取多糖樣品200 mg溶于5 mL的去離子水中,在室溫下振蕩攪拌24 h。混合物3 000 r/min離心30 min,然后將上清液除去。將剩余不溶物烘干,稱質(zhì)量。以上步驟每個(gè)樣品重復(fù)3 次。溶解度按公式(1)計(jì)算。

1.3.3.4 組分分析
采用苯酚-硫酸法[13]測(cè)定總糖質(zhì)量分?jǐn)?shù);利用二硝基水楊酸法[14]測(cè)定還原糖的質(zhì)量分?jǐn)?shù);以葡萄糖醛酸為標(biāo)準(zhǔn),采用咔唑-硫酸法[15]測(cè)定糖醛酸的質(zhì)量分?jǐn)?shù);利用考馬斯亮藍(lán)法[16]測(cè)定蛋白質(zhì)量分?jǐn)?shù);利用福林-酚法[17]測(cè)定多酚質(zhì)量分?jǐn)?shù)。
1.3.4 超聲降解對(duì)黑加侖果實(shí)多糖結(jié)構(gòu)的影響
1.3.4.1 傅里葉變換紅外光譜分析
采用溴化鉀壓片法,對(duì)多糖BFPs,UM-15和UM-30在4 000~500 cm-1范圍內(nèi)進(jìn)行傅里葉變換紅外光譜掃描。
1.3.4.2 剛果紅實(shí)驗(yàn)
參考Xu Yaqin等的方法[18],將BFPs、UM-15和UM-30與剛果紅試劑分別配制成一系列不同NaOH濃度的反應(yīng)體系,在400~700 nm波長(zhǎng)范圍內(nèi),利用紫外-可見(jiàn)分光光度計(jì)進(jìn)行掃描,測(cè)定溶液的最大吸收波長(zhǎng)。用去離子水代替多糖溶液作為空白對(duì)照組。
1.3.4.3 碘-碘化鉀實(shí)驗(yàn)
向試管中加入2.0 mL多糖溶液(2.0 mg/mL),加入2 mL H2O,再加入1.2 mL碘-碘化鉀試劑(含0.02%(體積分?jǐn)?shù),后同)I2的0.2% KI溶液),振蕩混勻后,室溫下在300~700 nm波長(zhǎng)范圍內(nèi)掃描。
1.3.5 超聲降解對(duì)黑加侖果實(shí)多糖生物活性的影響
參照文獻(xiàn)[1 9]的方法,配制質(zhì)量濃度分別為0.2、0.4、0.6、0.8、1.0、1.2 mg/mL的多糖溶液,測(cè)定多糖的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和·清除率。以VC作為陽(yáng)性對(duì)照。
1.3.5.2 抗脂質(zhì)過(guò)氧化實(shí)驗(yàn)
試液的配制:300 mg大豆卵磷脂超聲輔助溶解于30 mL磷酸鹽緩沖液(phosphate buffered saline,PBS)(10 mmol/L、pH 7.4)中,得到脂質(zhì)體PBS分散系(lecithin liposome system,LLS)。將15.00 g三氯乙酸(trichloroacetic acid,TCA)、0.37 g硫代巴比妥酸(thiobarbituric acid,TBA)、2.10 mL濃鹽酸依次加入100.0 mL水中,得到TCA-TBA-HCl混合液。
抗脂質(zhì)過(guò)氧化能力的測(cè)定方法參照Yang Dong等的方法[20]并作稍許改動(dòng),分別于試管中加入1.0 mL LLS、1.0 mL 0.4 mmol/L硫酸亞鐵、1.0 mL不同質(zhì)量濃度的多糖樣品并混合均勻。在避光條件下37 ℃水浴60 min,之后加入2.0 mL TCA-TBA-HCl混合液,并于100 ℃水浴15 min,立即冷卻,以3 000 r/min離心10 min,取上清液在535 nm波長(zhǎng)處測(cè)吸光度As。空白以1.0 mL去離子水代替1.0 mL樣品,操作方法同上,可測(cè)得空白的吸光度Ac,以VC為陽(yáng)性對(duì)照。按公式(2)計(jì)算抑制率。
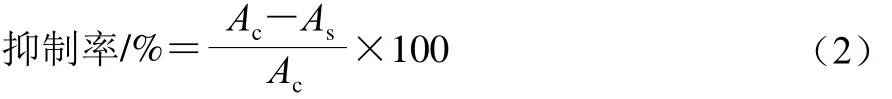
式中:Ac為不加多糖樣品溶液的脂質(zhì)氧化體系的吸光度;As為加多糖樣品溶液的脂質(zhì)氧化體系的吸光度。
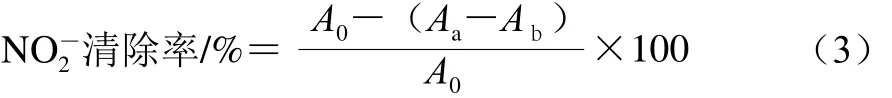
式中:A0為不加多糖樣品溶液的吸光度;Aa為加入多糖樣品溶液的吸光度;Ab為多糖溶液本身的吸光度。
1.4 數(shù)據(jù)處理與分析
所有實(shí)驗(yàn)數(shù)據(jù)均以3 次實(shí)驗(yàn)結(jié)果的平均值±標(biāo)準(zhǔn)差表示。采用Origin 8.0軟件作圖,并用SPSS 20.0軟件進(jìn)行差異顯著性分析(單因素方差分析法),P<0.05表示差異顯著。
2 結(jié)果與分析
2.1 黑加侖多糖的理化性質(zhì)
由表1可知,隨著降解時(shí)間延長(zhǎng),多糖的Mv顯著降低(P<0.05),降解15 min時(shí),Mv減少56.97%,降解時(shí)間延長(zhǎng)到30 min時(shí),Mv減少65.94%。同樣地,在超聲降解時(shí)間分別為15 min和30 min時(shí),其振動(dòng)黏度分別降低了11.86%和16.49%。顯然,在一定范圍內(nèi),延長(zhǎng)超聲作用時(shí)間,會(huì)提高多糖的降解程度。此結(jié)果與Hu Jielun等的研究結(jié)果[22]一致。該研究發(fā)現(xiàn),超聲波處理可以顯著降低車前子種子多糖的分子質(zhì)量和黏度等。溶解度測(cè)定結(jié)果表明,利用超聲波處理黑加侖多糖可以顯著增加樣品的溶解度(P<0.05)。超聲處理15 min后,多糖的溶解度增加了27.97%。當(dāng)處理時(shí)間延長(zhǎng)至30 min時(shí),UM-30的溶解度增加了61.53%。這可能是由于大分子質(zhì)量多糖的解聚并伴隨著較短聚合鏈比例的增加,導(dǎo)致降解多糖的水合趨勢(shì)增強(qiáng)和鏈間氫鍵數(shù)量減少[12]。
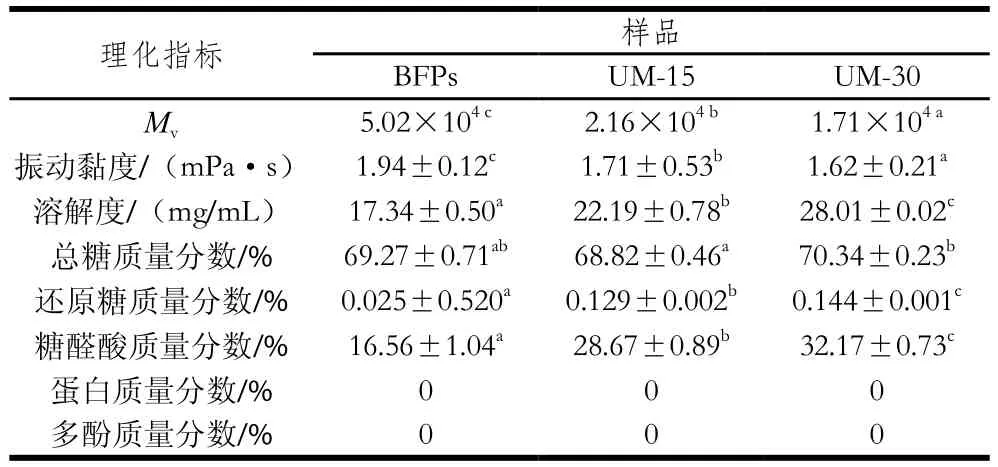
表1 多糖BFPs、UM-15和UM-30的理化性質(zhì)Table 1 Physicochemical properties of BFPs, UM-15 and UM-30
此外,由表1可知,經(jīng)過(guò)初步純化后的多糖BFPs已經(jīng)不含蛋白質(zhì)和多酚。降解多糖UM-15和UM-30與BFPs的總糖質(zhì)量分?jǐn)?shù)不存在顯著差異。但是,還原糖和糖醛酸質(zhì)量分?jǐn)?shù)顯著增加(P<0.05),且呈時(shí)間-效應(yīng)關(guān)系。還原糖質(zhì)量分?jǐn)?shù)增加說(shuō)明超聲波處理使多糖糖鏈發(fā)生斷裂,多糖分子質(zhì)量降低。而超聲波處理后多糖中糖醛酸質(zhì)量分?jǐn)?shù)增加可能是超聲波處理使位于多糖內(nèi)部更多的糖醛酸暴露出來(lái)所致[23]。
2.2 黑加侖多糖的結(jié)構(gòu)初步表征
2.2.1 傅里葉變換紅外光譜分析結(jié)果
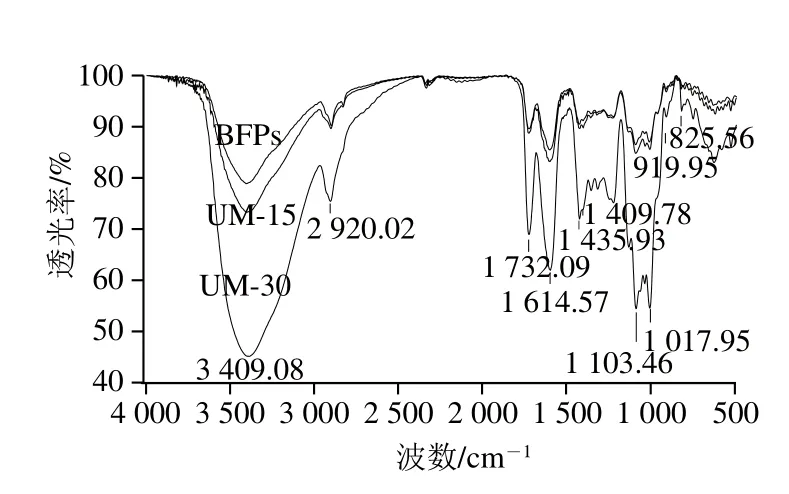
圖1 BFPs、UM-15和UM-30的傅里葉變換紅外光譜圖Fig. 1 Fourier transform infrared spectra of BFPs, UM-15 and UM-30
由圖1可以看出,BFPs及UM-15、UM-30均具有多糖的特征吸收且特征吸收峰位置基本相同,說(shuō)明降解前后多糖分子的主要官能團(tuán)沒(méi)有變化。在3 400 cm-1處的峰為羥基O—H的伸縮振動(dòng)吸收峰,2 907 cm-1附近的峰為C—H的伸縮振動(dòng)吸收峰,1 730 cm-1附近的峰為酯化羰基C=O伸縮振動(dòng),1 603 cm-1附近的峰為羧基C=O的伸縮振動(dòng)峰,此外1 430 cm-1處的吸收峰說(shuō)明BFPs、UM-15和UM-30中均含有糖醛酸,在1 200~1 000 cm-1處存在的吸收峰說(shuō)明降解前后多糖均為吡喃糖結(jié)構(gòu)[4]。綜上可知,超聲波作用于黑加侖果實(shí)多糖后并沒(méi)有改變基本結(jié)構(gòu)。
2.2.2 剛果紅實(shí)驗(yàn)分析結(jié)果
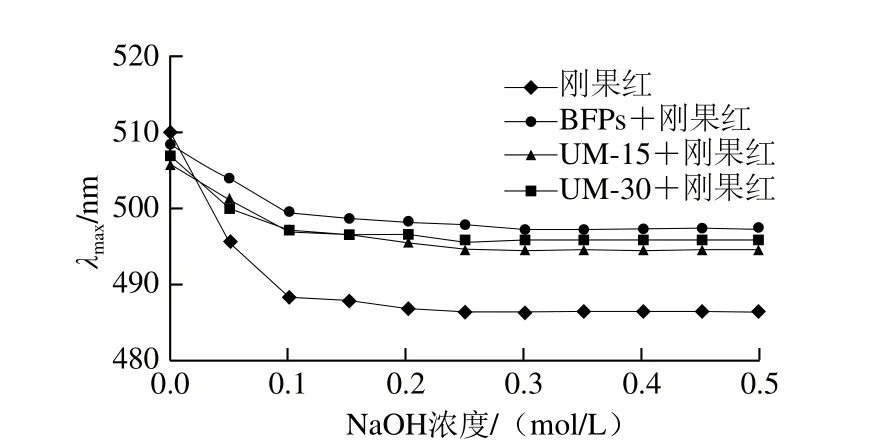
圖2 不同NaOH濃度下多糖與剛果紅絡(luò)合物的最大吸收波長(zhǎng)λmaxFig. 2 Maximum absorption wavelength of Congo red and Congo red-polysaccharides at various concentrations of NaOH
由圖2可以看出,隨著NaOH溶液濃度從0增大到0.5 mol/L,多糖BFPs及UM-15、UM-30與剛果紅試劑作用產(chǎn)生絡(luò)合物的最大吸收波長(zhǎng)均呈現(xiàn)逐漸減小的趨勢(shì)。最大吸收波長(zhǎng)的連續(xù)下降可能是因?yàn)槎嗵窃谒芤褐袨闊o(wú)規(guī)卷曲構(gòu)象,且越來(lái)越多的氫鍵被堿性溶液破壞[24]。3 種多糖在水溶液中具有無(wú)規(guī)卷曲構(gòu)象,可能歸因于這些多糖較大的分子質(zhì)量和復(fù)雜的單糖組成[25]。Mao等指出雜多糖不能形成三螺旋結(jié)構(gòu)[26]。因此UM-15、UM-30和BFPs都不具有三股螺旋結(jié)構(gòu)。
2.2.3 碘-碘化鉀實(shí)驗(yàn)分析結(jié)果
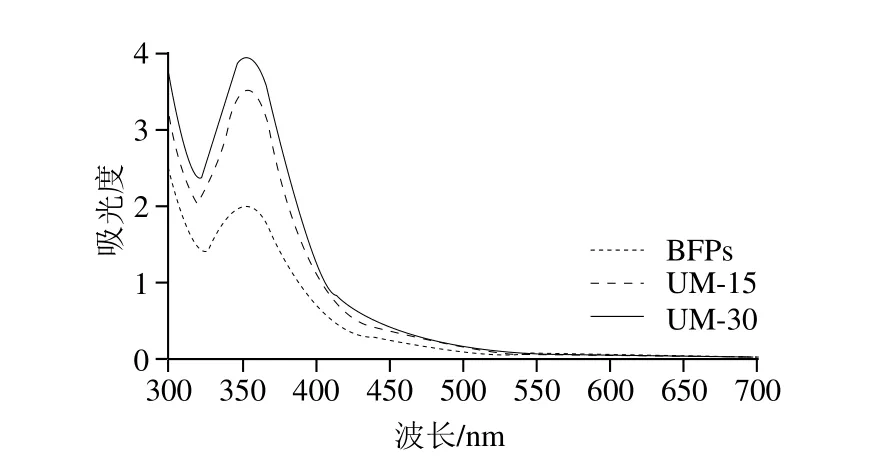
圖3 多糖BFPs及UM-15、UM-30的碘-碘化鉀實(shí)驗(yàn)紫外-可見(jiàn)光譜圖Fig. 3 Ultra violet-visible absorption spectra of BFPs, UM-15 and UM-30 reaction with iodine-potassium iodide
如圖3所示,多糖BFPs及UM-15、UM-30與碘-碘化鉀試劑的反應(yīng)液在350 nm波長(zhǎng)處均有強(qiáng)吸收峰,在565 nm波長(zhǎng)處沒(méi)有吸收峰,這說(shuō)明多糖BFPs、UM-15和UM-30均具有復(fù)雜的鏈狀結(jié)構(gòu),其側(cè)鏈較長(zhǎng)、支鏈較多[27]。綜上可知,超聲波并未改變黑加侖果實(shí)多糖的復(fù)雜分支結(jié)構(gòu)。
2.3 黑加侖多糖的體外生物活性
2.3.1 清除DPPH自由基和O2-·能力
由圖4、5可知,多糖BFPs、UM-15和UM-30在質(zhì)量濃度0.2~1.2 mg/mL范圍內(nèi),隨著多糖質(zhì)量濃度的增加,其對(duì)DPPH自由基和O2-·的清除作用增強(qiáng),呈現(xiàn)明顯的濃度依賴關(guān)系,且不同多糖清除自由基能力呈現(xiàn)顯著差異(P<0.05)。在最大實(shí)驗(yàn)質(zhì)量濃度(1.2 mg/mL)時(shí),BFPs、UM-15和UM-30的DPPH自由基清除率達(dá)到最大值,分別為(85.02±2.32)%、(87.26±1.68)%、(9 0.1 8±0.6 6)%,低于V C的最大清除率(96.97±2.51)%,BFPs、UM-15、UM-30和VC的半抑制濃度(half maximal inhibitory concentration,IC50)分別為0.269、0.228、0.207 mg/mL和0.031 mg/mL。同時(shí),BFPs、UM-15、UM-30和VC的最大·清除率和IC50分別為(52.87±2.08)%和1.193 mg/mL、(66.83±1.56)%和0.676 mg/mL、(71.43±0.25)%和0.269 mg/mL、(76.68±0.62)%和0.003 mg/mL。由此可見(jiàn),清除DPPH自由基和·能力順序?yàn)閂C>UM-30>UM-15>BFPs。
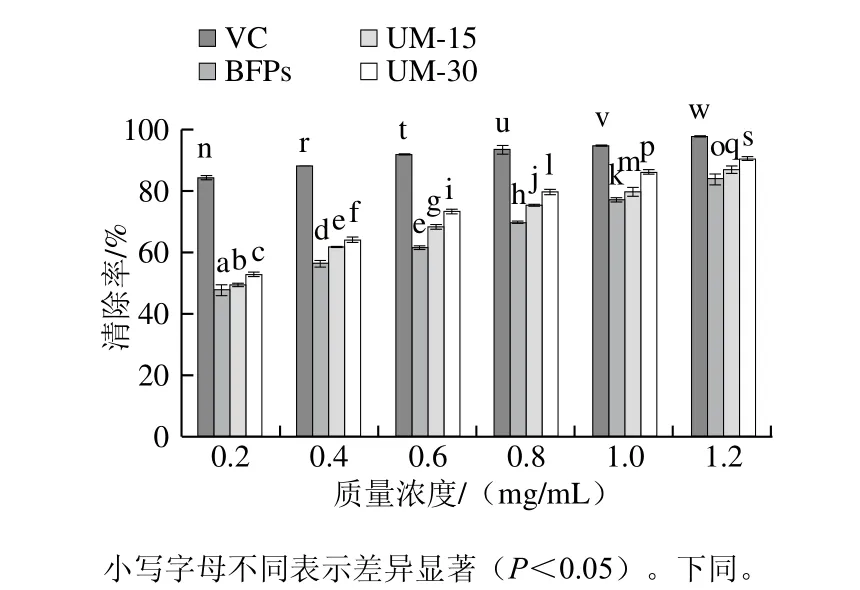
圖4 BFPs、UM-15和UM-30對(duì)DPPH自由基的清除能力Fig. 4 DPPH radical scavenging capacity of BFPs, UM-15 and UM-30
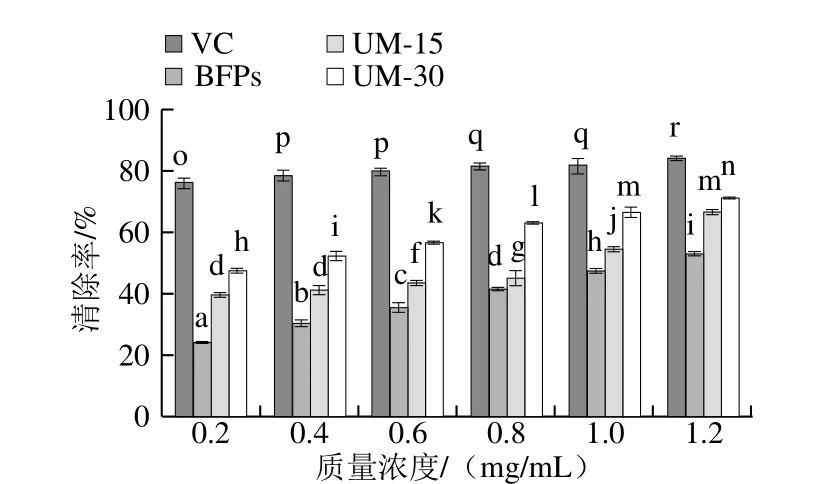
圖5 BFPs、UM-15和UM-30對(duì)·的清除能力Fig. 5 Superoxide anion radical scavenging capacity of BFPs, UM-15 and UM-30
2.3.2 抗脂質(zhì)過(guò)氧化能力
由圖6可知,在質(zhì)量濃度為0.2~1.2 mg/mL范圍內(nèi),多糖BFPs、UM-15及UM-30對(duì)脂質(zhì)過(guò)氧化的抑制作用均高于VC。隨著多糖質(zhì)量濃度的增加,3 種多糖對(duì)脂質(zhì)過(guò)氧化的抑制作用均逐漸增強(qiáng),且存在顯著差異(P<0.05)。當(dāng)質(zhì)量濃度為1.2 mg/mL時(shí),多糖對(duì)脂質(zhì)過(guò)氧化的抑制效果達(dá)到最佳水平。此時(shí),多糖BFPs、UM-15和UM-30的脂質(zhì)過(guò)氧化抑制率分別為(44.44±0.22)%、(55.35±0.16)%、(65.83±0.67)%,分別是VC最大抑制率的1.60、1.99、2.36 倍。BFPs、UM-15、UM-30和VC的IC50分別為1.971、1.035、0.771 mg/mL和3.394 mg/mL。
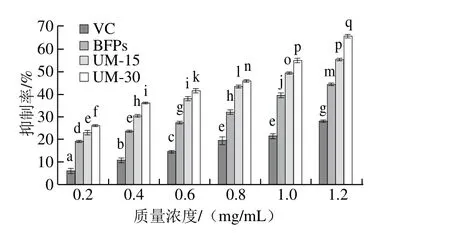
圖6 BFPs、UM-15和UM-30對(duì)脂質(zhì)過(guò)氧化的抑制能力Fig. 6 Lipid peroxidation-inhibitory capacity of BFPs, UM-15 and UM-30
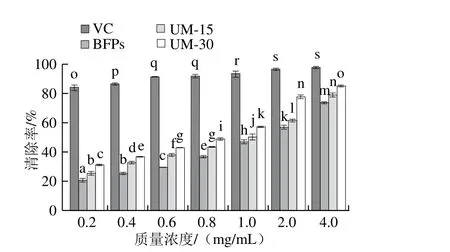
圖7 BFPs、UM-15和UM-30對(duì)的清除能力Fig. 7 Nitrite ion scavenging capacity of BFPs, UM-15 and UM-30
由圖7可以看出,在0.2~4.0 mg/mL范圍內(nèi),BFPs、UM-15及UM-30對(duì)的清除率隨著質(zhì)量濃度增大而增強(qiáng),且不同多糖對(duì)的清除能力存在顯著差異(P<0.05)。質(zhì)量濃度達(dá)4.0 mg/mL時(shí),BFPs((73.08±1.25)%,IC50=1.384 mg/mL)、UM-15((78.65±0.58)%,IC50=0.990 mg/mL)及UM-30((84.46±1.43)%,IC50=0.697 mg/mL)的清除率達(dá)到最大,但仍低于VC的最大清除率((97.12±2.34)%,IC50=0.017 mg/mL)。
綜上所述,超聲波處理能夠?qū)е潞诩觼龉麑?shí)多糖抗氧化活性顯著提高。通常,活性物質(zhì)的抗氧化作用歸因于其供氫能力。Wang Junlong等研究發(fā)現(xiàn),多糖中糖醛酸基團(tuán)的存在可以觸發(fā)異頭碳的氫原子,發(fā)生抗氧化反應(yīng)[28]。本實(shí)驗(yàn)結(jié)果表明超聲波處理能夠使黑加侖多糖中糖醛酸含量增加,提高多糖供給氫原子的能力,進(jìn)而增加多糖的抗氧化活性,這與You Qinghong等研究結(jié)果一致[29]。另一方面,超聲波處理能夠使多糖分子質(zhì)量降低,使位于多糖內(nèi)核中的活性基團(tuán)暴露,提供更多的活性位點(diǎn)與自由基反應(yīng),進(jìn)而抑制氧化反應(yīng)[23]。此外,本研究發(fā)現(xiàn)原多糖與降解多糖對(duì)DPPH自由基、O2-·的清除能力及抗脂質(zhì)過(guò)氧化能力存在差異,這可能是由于多糖發(fā)揮不同抗氧化活性時(shí)作用機(jī)制是不同的。Sun Liqin[30]、Shi Meijia[31]等在研究原多糖與降解多糖抗氧化活性時(shí)得到與本實(shí)驗(yàn)一樣的結(jié)論。關(guān)于天然多糖抗氧化活性作用機(jī)制及多糖在不同實(shí)驗(yàn)方法中抗氧化活性存在差異的原因有待進(jìn)一步深入探討。
3 結(jié) 論
本實(shí)驗(yàn)利用超聲波降解黑加侖果實(shí)多糖,制備了兩種不同分子質(zhì)量多糖。研究結(jié)果表明,超聲時(shí)間越長(zhǎng)對(duì)多糖的理化性質(zhì)(黏均分子質(zhì)量、振動(dòng)黏度、溶解度、還原糖含量和糖醛酸含量)的影響越顯著;與原多糖相比,超聲波處理并沒(méi)有改變多糖的基本結(jié)構(gòu);此外,降解多糖對(duì)DPPH自由基、O2-·和NO2-的清除能力及對(duì)脂質(zhì)過(guò)氧化的抑制作用均強(qiáng)于原多糖,且降解時(shí)間越長(zhǎng)效果越好。因此,超聲波是一種在不破壞多糖初級(jí)結(jié)構(gòu)的條件下,有效地改善多糖的理化性質(zhì),并提高其生物活性的手段,而超聲波處理的黑加侖果實(shí)多糖可能成為保障人類健康的天然抗氧化劑潛在來(lái)源。

