超聲裂解法在診斷假體周圍感染的應用
李程,Nora Renz,Andrej Trampuz
(Charité-Universit?tsmedizin Berlin,Center for Musculoskeletal Surgery,Berlin,Germany 14059)
人工關節置換術是一種有效、常用的骨科手術技術,能夠改善關節功能,提高患者的生活質量。假體周圍感染是人工關節置換術后最嚴重的并發癥。雖然發生率很低,在膝、肩關節置換術后的發生率<1%,髖關節置換術后發生率<2%[1],但是一旦發生感染給患者帶來巨大的痛苦和經濟負擔。一份來自發展中國家的報告顯示[2],假體周圍感染患者的治療費用可以比普通住院患者費用高24倍。早期明確診斷感染,對后續的手術治療起著關鍵的作用[1]。超聲裂解作為一種術中診斷假體周圍感染的方法有著較高的準確性。尤其是對于樣本采集前接受抗生素治療的患者。1998年,Tunney等[3]首次報道了超聲裂解在髖關節假體周圍感染診斷中的應用,但由于受到操作方法等影響,并沒有體現出這種培養方法的價值。2007年,Trampuz等[4]對此方法進行改進,結果顯示無論患者是否術前接受抗生素治療,超聲裂解液的敏感度均優于術中假體周圍組織培養獲得的結果。由于超聲裂解法操作簡單,而且有著較好的敏感度,這種方法逐漸應用于假體周圍感染的診斷。近年來,除了傳統的培養基培養之外,還出現了一些能提高診斷準確性的新方法,如血培養瓶培養、分子生物學技術、微量熱法等[5-8]。我們對超聲裂解法的操作步驟以及一些新的培養方法進行分析,為臨床應用提供有價值的參考。
1 假體周圍感染的診斷方法
目前,有關假體周圍感染的診斷標準還缺乏共識。肌肉骨骼感染協會(musculoskeletal infection society,MSIS)、美國感染協會(infectious diseases society of America,IDSA)、歐洲骨與關節感染協會(European bone and joint infection society,EBJIS)相繼提出了一些協助診斷假體周圍感染的指南[9-11]。在歐洲,常用的診斷假體周圍感染的指南為EBJIS提出的方法。根據EBJIS的診斷方法,如果滿足以下≥1項標準時,可診斷為假體周圍感染:a)臨床表現:竇道或瘺管形成,假體周圍可見膿液(注:關節假體金屬對金屬界面可出現類似膿液的表現,但是白細胞計數正常,所見到的為金屬碎屑)。b)組織學:每10個高倍視野下,發現≥23個粒細胞,Krenn和Morawietz分型之后的2或3型,相當于假體周圍感染。c)關節腔穿刺細胞計數:白細胞>2 000/μL或中性粒細胞>70%。(在術后6周內、類風濕性關節病、假體周圍骨折或脫位的患者可出現白細胞升高而非感染。所獲得的穿刺液標本需要在24 h內通過顯微鏡或細胞計數器,檢測出白細胞數目)。d)微生物學:關節腔穿刺液培養陽性,或至少有2份組織樣本培養出同一種細菌(對于金黃色葡萄球菌、鏈球菌、大腸桿菌等具有高度傳染性的微生物,或患者正在接受抗生素治療,只要一個組織樣本被檢測出陽性,即可診斷為假體周圍感染),或超聲裂解液≥ 50 CFU/mL(當細菌為金黃色葡萄球菌或者厭氧菌,并且正在使用抗生素時,即使<50 CFU/mL也可認為是陽性結果)。有研究發現[12],使用EBJIS指南診斷假體周圍感染時,能夠比MSIS、IDSA指南發現更多假體周圍感染的病例。
2 假體超聲裂解
目前,超聲裂解法的操作方法還沒有統一的標準,多數研究把Trampuz[4]使用的方法作為標準。首先,在手術中取出懷疑感染的假體關節,將假體關節放入合適的容器內。然后加入超聲裂解處理液進行漩渦振蕩30 s,振蕩后放入超聲清洗器中清洗5 min。清洗后再次漩渦振蕩30 s,最后將獲取的超聲裂解液移入培養基中進行細菌培養(見圖1)。
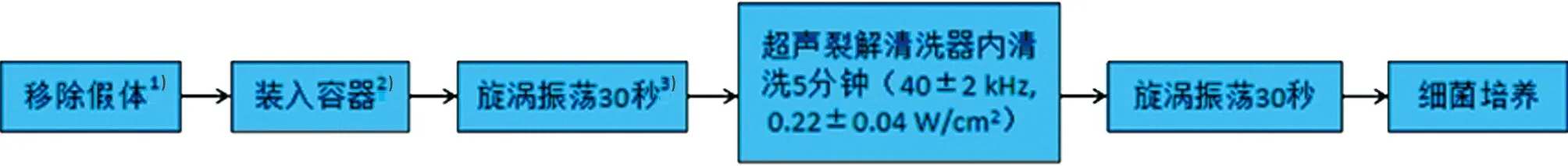
注: 1-避免污染,最好使用合適的無菌手術器械把假體裝入容器;2-必須選用無菌、結實、密封性好、大小合適的容器;3-振蕩可選用手動或置于漩渦振蕩器上
通過閱讀文獻,我們發現部分超聲裂解法的操作步驟為超聲裂解后離心[13]或超聲裂解結合漩渦振蕩[14-16]。然而,加入漩渦振蕩或者離心是否對培養結果造成影響。Zitron等[17]對35例骨科翻修手術中移除的假體采用兩組培養方法進行對比研究。一組為振蕩、超聲裂解加離心,另一組為振蕩、超聲裂解加膜濾法。結果顯示離心組的敏感度明顯高于膜濾組(78.8% vs 30.3%;P<0.001)。離心法可能會提高培養結果的敏感度。
Portillo等[18]為了發現振蕩在診斷假體周圍感染時是否有效,對135例關節翻修手術中移除的假體分為振蕩結合超聲裂解、振蕩法兩組進行對比研究。結果顯示有35例患者被診斷為假體周圍感染(急性14例,慢性21例)。當cutoff≥1 CFU/mL時,振蕩結合超聲裂解的敏感度為71%[95% CI(54%~85%)]、特異度為93%[95% CI(86%~97%)]。振蕩法的敏感度為69%[95% CI(51%~83%)]、特異度為92%[95% CI(85%~96%)]。當cutoff≥50 CFU/mL時,振蕩結合超聲裂解的敏感度為60%[95% CI(42%~76%)]、特異度為99%[95% CI(95%~100%)]。振蕩法的敏感度為40%[95% CI(24%~58%)]、特異度為99%[95% CI(95%~100%)]。在接受抗生素治療與沒有接受抗生素治療的分組中,不同cutoff以及急、慢性感染顯示出不同的結果(見圖2)。當cutoff≥1 CFU/mL(沒有接受抗生素治療的病例)或cutoff≥50 CFU/mL(接受抗生素的急性感染病例)時,振蕩結合超聲裂解與單純振蕩有相同的敏感度。除此之外,振蕩結合超聲裂解的敏感度均優于振蕩法。雖然振蕩結合超聲裂解的方法優于單純振蕩,但是以≥1 CFU/mL為標準,對于沒有接受抗生素治療的患者,也許是一種可行的培養方法。特別是對于一些沒有超聲清洗器的醫院,把移除的假體放入無菌、密封的塑料容器內,加入超聲裂解處理液。然后可進行手動振蕩或置于漩渦振蕩器上。最后,對獲取的液體進行培養基培養。
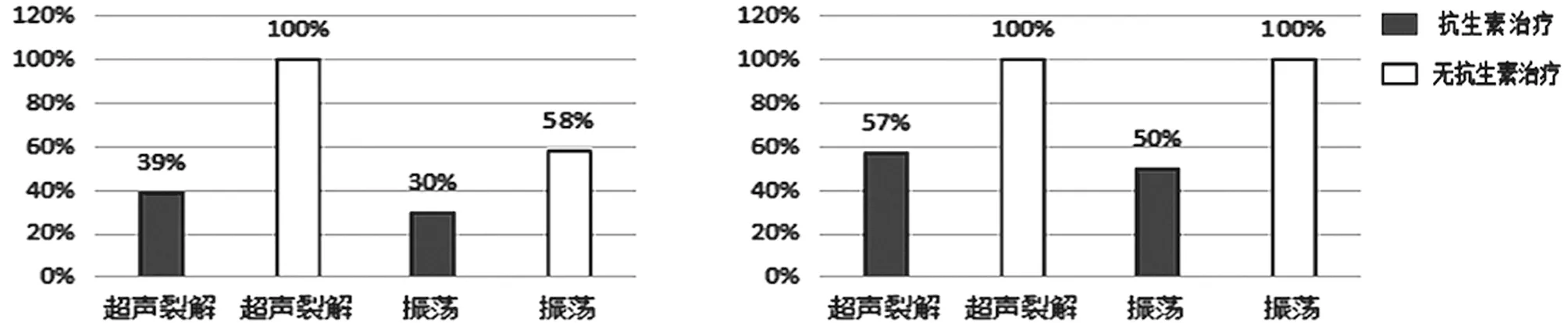
a cutoff≥ 50 CFU/mL時的敏感度 b cutoff≥1 CFU/mL時的敏感度

c cutoff≥50 CFU/mL時急性感染的敏感度 d cutoff≥50 CFU/mL時慢性感染的敏感度
圖2 接受抗生素治療對振蕩加超聲裂解、振蕩法的敏感度的影響
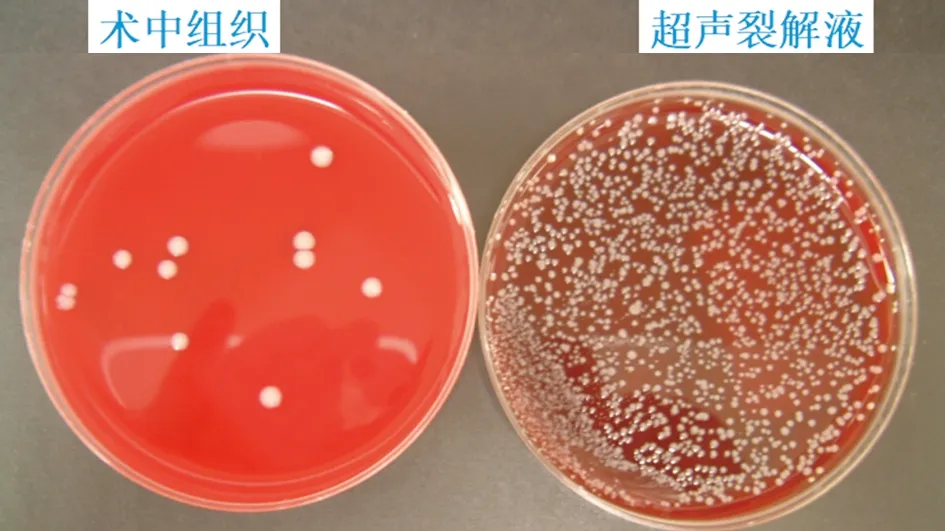
圖3 術中組織、超聲裂解液培養出的表皮葡萄球菌,超聲裂解液檢測到比假體周圍組織多10 000倍的微生物
3 超聲裂解液的培養方法
組織培養和超聲裂解法是術中診斷假體周圍感染常用的兩種方法,在診斷體周圍感染時,超聲裂解通常比組織培養法檢測出更多的微生物[19](見圖3)。
有研究發現,超聲裂解法的敏感度優于術中組織培養。超聲裂解法與術中組織培養在髖、膝關節感染的敏感度分別為92.6%、66.7%;肩關節感染的敏感度分別為66.7%、54.5%;肘關節感染的敏感度分別為89%、55%[20-22]。Prieto-Borja等[23]發現雖然超聲裂解液的總體敏感度和特異度優于組織培養、關節腔穿刺液培養。但是對于早期感染(術后3個月內),超聲裂解法較傳統培養方法,并沒有表現出明顯優勢。在延遲感染(術后3~24個月)的病例中,術中組織與關節腔穿刺液培養的基礎上結合超聲裂解培養,診斷的敏感度提升了26.6%。由于傳統的培養方法有一定的局限性,檢測病原菌的敏感度并不高,大約39%~70%之間[24]。雖然超聲裂解液在普通培養基培養時有較好的敏感度和特異度(見表2)。但為了進一步提高診斷準確性,近年一些與超聲裂解液相組合的方法,開始逐漸用于臨床診斷假體周圍感染。
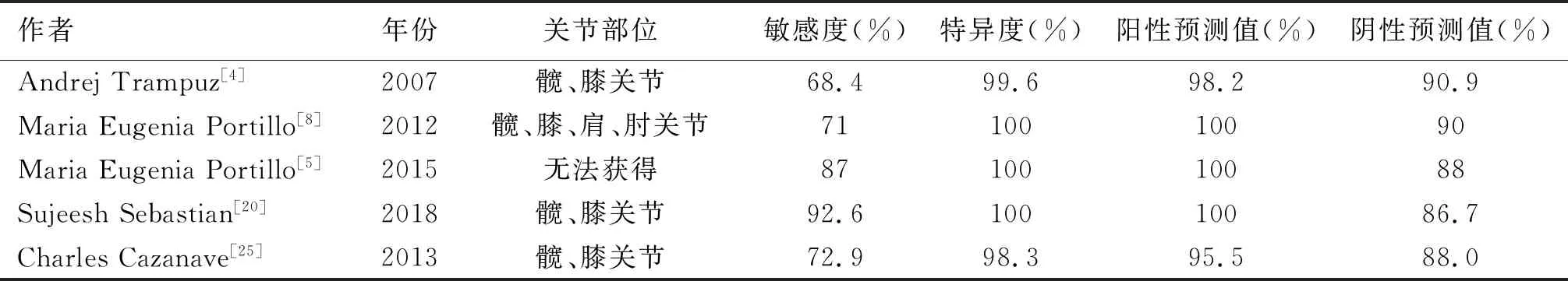
表2 超聲裂解液在普通培養基中的敏感度和特異度比較
3.1 血培養瓶法 把樣本接種在血培養瓶中進行培養的方法,早期應用于關節腔穿刺液培養[26]。然而目前有關超聲裂解液接種到血培養瓶的研究較少。Shen等[27]對110例懷疑感染的病例的超聲裂解液、關節腔穿刺液分別接種到血培養瓶中進行對比,超聲裂解液診斷假體周圍感染的敏感度為88%[95% CI(76%~95%)]、特異度為87%[95% CI(75%~94%)]。關節腔穿刺液的敏感度為64%[95% CI(49%~77%)]、特異度為98%[95% CI(91%~100%)]。超聲裂解液的敏感度比關節腔穿刺液高,但是特異度低于關節腔穿刺液。在接受抗生素治療的病例中,超聲裂解液培養結果優于關節腔穿刺液(17例對比11例)。Portillo等[5]對75例懷疑感染的骨科內植物分別進行超聲裂解液培養基培養與血培養瓶培養。在39例感染中,多數患者在標本采集前14d內接受了抗生素治療,然而結果顯示血培養瓶培養比傳統的培養基培養表現出更高的敏感度(100%對比87%)。Janz等人[28]發現超聲裂解液血培養瓶培養不僅能夠比傳統培養方式檢測出更多陽性的結果(101例對比51例)、培養時間更短(2.9 d對比4.2 d)。而且這種在全自動血培養儀培養的方式,減少實驗人員60.1%的平均工作時間[29]。為了提高診斷的準確性,減少假陽性的發生。在超聲裂解液接種到血培養瓶的過程中,注意避免污染。
3.2 分子生物學技術 隨著分子生物學技術的發展,PCR和多重PCR逐漸被用于假體周圍感染的診斷。這種方法的優勢在于培養時間短(<5 h)、自動化、不易受抗生素影響、敏感度和特異度較高、易于區分無菌性松動和假體周圍感染等[8,30]。與傳統超聲裂解法相比,超聲裂解液PCR的敏感度更高(77.1%對比72.9%)[25]。Liu等[6]對超聲裂解液PCR在假體周圍感染中的診斷進行meta分析,通過篩選共納入9篇文獻,其敏感度為75%[95% CI(71%~79%)],特異度為96%[95% CI(94%~97%)]。該研究發現新鮮標本的敏感度優于冰凍保存標本(82%對比70%),多重PCR比PCR有更高的特異度(98%對比94%)。這種方法由于花費高,并沒有在臨床普遍應用。
3.3 微量熱法 微量熱法是利用微生物生長和代謝時產生的熱效應快速檢測到細菌,這種方法由于敏感度高、方便準確,常被用于生物工程技術、藥理學等方面。在臨床上常用于篩查輸血袋是否有細菌生長[31]。2013年Borens等[7]首次發表了微熱量法診斷骨科內植物感染的臨床研究,結果顯示超聲裂解液微熱量法的敏感度為100%、特異度為97%。這種方法能夠在24h內完成細菌培養。目前微熱量法在假體周圍感染的應用較少,還需要更多的臨床研究來驗證其診斷價值。
4 超聲裂解法的機制
在所有人類感染中,有超過65%的感染與生物膜相關。由于骨科內植物假體材料的易感性,所以很容易引起生物膜相關感染。生物膜是復雜的微生物群落以嵌入胞外多糖的形式附著于假體表面。生物膜在假體表面形成可以分為四步:黏附、增殖、生物膜成熟和擴散。其中微生物黏附于假體表面是生物膜形成的第一步,也是最重要的一步[32],微生物可通過三種途徑黏附于假體表面后發生感染[33]:a)手術期間通過手術切口傳播;b)尿路感染或皮膚感染等通過血源性或淋巴源性傳播。只要假體(異物)存在,就可發生于關節置換術后的任何時期;c)通過相鄰組織傳播(感染的軟組織、骨髓炎等)。超聲裂解在低頻率、低強度的作用下,通過破壞和分離假體表面的生物膜(不影響微生物活性),從而發現更多的微生物[34]。
目前,假體周圍感染的診斷仍面臨著嚴峻挑戰。雖然超聲裂解法表現出較高的敏感度和特異度。但是,即使超聲裂解法培養出陽性結果,也要警惕可能是污染造成的假陽性。建議在診斷假體周圍感染時,采用多種培養方法相結合進行綜合評估。在醫院或實驗室條件允許的情況下,使用血培養瓶法、分子生物學技術、微熱量法等能夠提高診斷的準確性。

