高效液相色譜-氣相色譜聯(lián)用法測定稻谷和大米中的飽和烴礦物油
劉玲玲,李冰寧,歐陽杰,武彥文,*
(1.北京市科學(xué)技術(shù)研究院,北京市理化分析測試中心,北京市食品安全分析測試工程技術(shù)研究中心,北京 100094;2.北京林業(yè)大學(xué)生物科學(xué)與技術(shù)學(xué)院,北京 100083)
礦物油是C10~C50的飽和烴(mineral oil saturated hydrocarbons,MOSH)和芳香烴(mineral oil aromatic hydrocarbons,MOAH)的總稱[1],其中MOSH包括直鏈、支鏈和環(huán)狀烷烴。MOSH有害人體健康。研究表明:人體的肝臟、脾臟和淋巴結(jié)等多個(gè)組織和器官均不同程度含有MOSH,特別容易蓄積C16~C35范圍的MOSH,導(dǎo)致慢性炎癥[2]。近年來,越來越多的研究數(shù)據(jù)顯示:食品中廣泛存在礦物油污染,主要污染來源包括環(huán)境污染[3-4]、原料采收和生產(chǎn)加工過程污染[5-6]以及包裝材料遷移[7-9]等。
礦物油組成復(fù)雜,包含數(shù)以萬計(jì)的化合物,其含量無法以其中一個(gè)或幾個(gè)化合物表示,而是需要測定總量。氫火焰離子化檢測器(hydrogen flame ionization detector,F(xiàn)ID)是分析礦物油的理想檢測器,其等碳響應(yīng)特性規(guī)避了缺乏礦物油標(biāo)準(zhǔn)的問題。由于氣相色譜(gas chromatography,GC)通常與FID聯(lián)用。因此,GC-FID成為常用的礦物油分析方法[10]。然而,作為通用檢測器,F(xiàn)ID的靈敏度低、選擇性差,需要通過前處理凈化與富集目標(biāo)物。離線固相萃取結(jié)合大體積進(jìn)樣GC系統(tǒng)[11-15]是較為常用的方法。隨著儀器聯(lián)用技術(shù)的發(fā)展,高效液相色譜-氣相色譜(high performance liquid chromatography-gas chromatography,HPLC-GC)聯(lián)用也逐漸開始普及[16-20],其中HPLC的作用是分離純化,通過特殊的接口技術(shù),HPLC-GC可以同時(shí)實(shí)現(xiàn)凈化-轉(zhuǎn)移-富集-分析的自動化,簡化了實(shí)驗(yàn)操作步驟,提高了分析效率,并且避免了實(shí)驗(yàn)過程外來污染的引入[10]。
大米是世界各國的主要食糧,我國約有65%的人口日常主食是大米[21]。然而,近十幾年來礦物油污染大米的事件時(shí)有發(fā)生[1,22]。研究表明:大米中MOSH含量約為1.7~160 mg/kg[12,16,23-26],主要來源于:1)環(huán)境污染;2)收割過程中的機(jī)械油污染;3)裝袋過程中的軟麻油污染;4)包裝材料中的印刷油墨或回收紙板的遷移污染;5)運(yùn)輸和儲藏過程中的防塵劑污染;6)人為拋光大米導(dǎo)致的礦物油污染等[1]。針對大米的礦物油污染問題,本實(shí)驗(yàn)擬通過HPLC-GC研究稻谷和大米中MOSH的含量情況,建立稻谷和大米中MOSH的定量方法,包括使用氧化鋁去除稻谷提取液中烷烴干擾物,確定HPLC自動純化MOSH的中心切割條件;應(yīng)用HPLC-GC研究我國稻谷和市售大米的礦物油污染特征,分析大米中礦物油的可能污染來源。
1 材料與方法
1.1 材料與試劑
稻谷和大米樣品各12 個(gè)(以人工和機(jī)器兩種方式各采收6 個(gè)稻谷樣品,將機(jī)器采收的稻谷樣加工成大米樣品6 個(gè),隨機(jī)采購市售商品大米樣品6 個(gè))。
正己烷、二氯甲烷(均為色譜純) 美國Fisher Scientific公司;氧化鋁(100~200 目,使用前在高溫爐中400 ℃烘烤60 h,冷卻,置于干燥器備用)國藥集團(tuán)化學(xué)試劑有限公司;液體石蠟(paraffin oil,PO)、正四十八烷(n-octatetracontane,C48)、聯(lián)環(huán)己烷(cyclohexyl cyclohexane,Cycy)、膽甾烷(5-α-cholestane,Cho)、1,3,5-三叔丁基苯(1,3,5-tritert-butyl-benzene,TBB)、C7~C40正構(gòu)烷烴混合標(biāo)準(zhǔn)溶液(色譜純) 美國Sigma-Aldrich公司。
1.2 儀器與設(shè)備
自行搭建HPLC-GC聯(lián)用儀(包括LC-20A高效液相色譜系統(tǒng)(配備紫外檢測器)、GC-2010 plus氣相色譜儀(配備程序升溫蒸發(fā)(programmed temperature vaporizer,PTV)進(jìn)樣系統(tǒng)、FID和AOC-5000 Plus自動進(jìn)樣器) 日本島津公司;N-EVAP氮?dú)獯蹈蓛x 美國Organomation公司。
1.3 方法
1.3.1 標(biāo)準(zhǔn)溶液配制
C48、Cho、TBB混合標(biāo)準(zhǔn)溶液:3 mg/L;Cycy內(nèi)標(biāo)溶液:300 mg/L;液體石蠟標(biāo)準(zhǔn)工作溶液:0.5、1.0、5.0、25.0、50.0、100.0 mg/L。
1.3.2 樣品中MOSH的提取
稱取大米樣品10.0 g于50 mL錐形瓶中,加入10 μL 300 mg/L的Cycy內(nèi)標(biāo)溶液,加入正己烷于60 ℃超聲提取2 次(每次10 mL,20 min),吸取上清液;合并2 次提取液,氮吹濃縮至1 mL。為驗(yàn)證提取是否完全,樣品經(jīng)2 次提取后的殘?jiān)谜和榍逑矗偌尤?0 mL正己烷和10 μL內(nèi)標(biāo)溶液于殘?jiān)校?0 ℃超聲提取80 min,吸取上清液,濃縮后檢測其中MOSH含量,含量低于前2 次提取的4%,則認(rèn)為提取完全,可以確定提取次數(shù)為2 次。
由于稻谷樣品中含有大量的天然正構(gòu)烷烴,干擾后續(xù)MOSH的測定,因而提取液需先用活化的氧化鋁去除正構(gòu)烷烴后再進(jìn)行濃縮。具體操作方法為:將10 g活化氧化鋁裝入玻璃層析柱,以正己烷平衡柱床,然后加入提取液,以10 mL正己烷洗脫,收集洗脫液并濃縮、定容至1 mL,注入HPLC-GC分析。
1.3.3 HPLC-GC分析條件
H P L C條件:S u p e l c o L C-S I液相色譜柱(250 mm×2.1 mm,5 μm)。流動相:A為正己烷,B為二氯甲烷;梯度洗脫:0~0.1 min,100% A(流速0.3 mL/min);0.1~9.5 min,70% A(流速0.3 mL/min);9.5~18.5 min,100% B(反向,流速0.5 mL/min);18.5~28.5 min,100% A(流速0.5 mL/min)。進(jìn)樣量:100 μL。
采用AOC-5000 Plus將MOSH餾分(2.5~3.1 min)轉(zhuǎn)移至GC的PTV汽化室,MOSH進(jìn)入PTV襯管后,設(shè)置升溫程序除去溶劑,并將目標(biāo)組分導(dǎo)入GC色譜柱中分析。PTV升溫條件:初始溫度35 ℃保持1 min(分流比180∶1),以250 ℃/min升溫至360 ℃(關(guān)閉分流閥2 min,隨后以100∶1開啟分流閥)。
G C分析條件:A g i l e n t D B-5 H T毛細(xì)管柱(15 m×0.25 mm,0.1 μm);升溫程序:35 ℃保持4 min,以40 ℃/min升溫至370 ℃,保持5 min;載氣為高純氦氣;柱內(nèi)采用恒壓模式,壓力為60 kPa;FID溫度380 ℃。
1.4 數(shù)據(jù)分析
以Cycy為內(nèi)標(biāo)物定量計(jì)算MOSH的含量。MOSH的含量通過計(jì)算譜圖基線與寬峰之間的面積得到,基線取決于樣品空白的GC譜圖;寬峰上方的尖峰為天然烷烴,定量計(jì)算時(shí)扣除[10]。
GC譜圖采集和分析分別采用5D Solution和LabSolutions軟件(日本島津公司)。數(shù)據(jù)以表示,采用GraphPad Prism 7統(tǒng)計(jì)軟件進(jìn)行數(shù)據(jù)分析,配對t檢驗(yàn)方法進(jìn)行組間差異顯著性比較,P<0.05,差異顯著,P<0.01,差異極顯著。
2 結(jié)果與分析
2.1 天然烷烴的去除
植物的角質(zhì)層和表面蠟質(zhì)中含有大量天然烷烴,主要為以C23~C35為主的奇數(shù)碳正構(gòu)烷烴[1]。稻谷沒有去除稻殼、皮層和胚,因而含有大量天然烷烴(圖1A)。MOSH是由大量的、幾乎連續(xù)的直鏈、支鏈烷烴和環(huán)烷烴組成,其GC譜圖呈一個(gè)無法分離且跨越一定碳數(shù)范圍的寬峰,MOSH的含量只能通過對基線與寬峰之間的峰面積積分計(jì)算;而寬峰上面的尖峰為天然烷烴,不能算作污染物,計(jì)算MOSH時(shí)需要扣除。也就是說,如果天然烷烴不干擾MOSH寬峰輪廓勾勒計(jì)算峰面積,則無需去除天然烷烴[27]。然而,稻谷的GC譜圖(圖1A)顯示:以C27、C29、C31和C33為主的天然烷烴含量過多,已經(jīng)嚴(yán)重干擾MOSH譜圖的積分。因此,必須通過前處理去除稻谷中的天然烷烴。
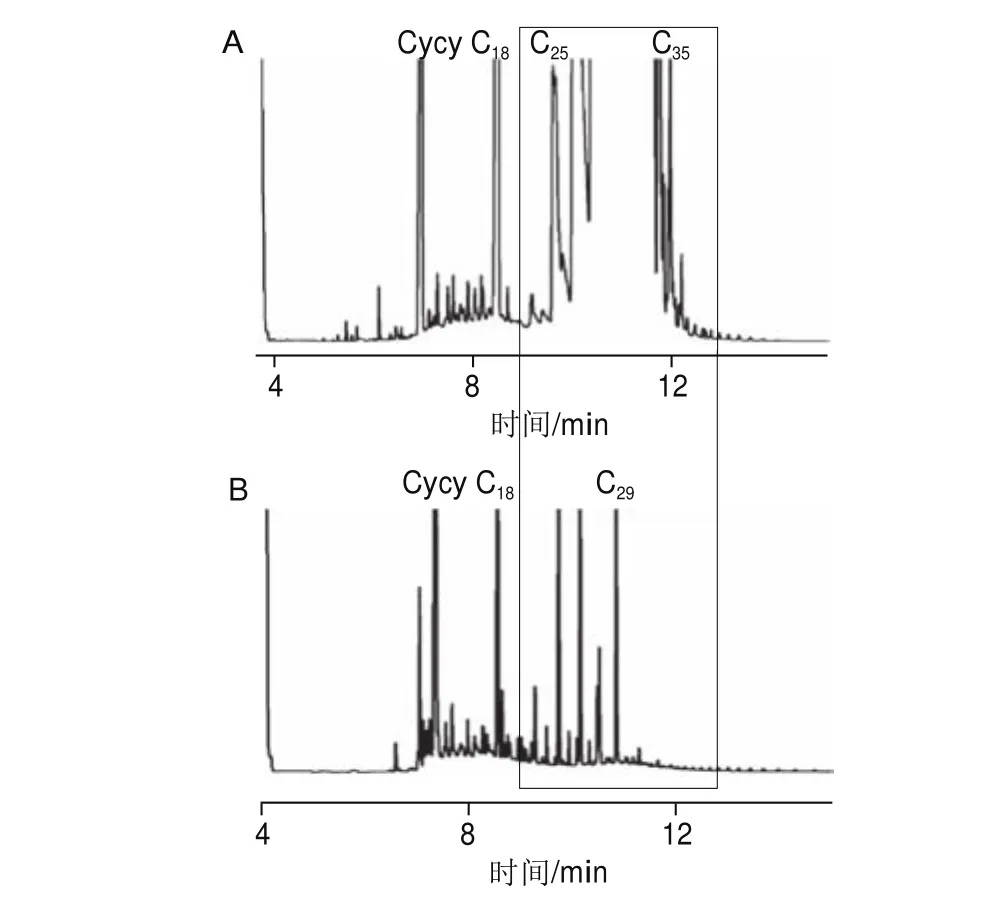
圖1 稻谷MOSH提取液經(jīng)活化氧化鋁凈化前(A)、凈化后(B)的HPLC-GC譜圖Fig. 1 HPLC-GC chromatograms of crude (A) and puri fi ed (B)MOSH extracted from paddy
通常,氧化鋁有選擇性吸附長鏈正構(gòu)烷烴的作用,但吸附能力不強(qiáng)。Fiselier等[5,28]研究表明:20 g活化氧化鋁根據(jù)不同活化溫度可吸附1~2 mg碳數(shù)高于C20的正構(gòu)烷烴;同時(shí)也會吸附少量的異構(gòu)烷烴和環(huán)烷烴,以及1.8~2.3 μg的液體石蠟,由于礦物油分析的復(fù)雜性與特殊性,一般認(rèn)為該吸附量不影響礦物油的檢測。因此,選用400 ℃活化10 g氧化鋁凈化稻谷提取液既可以去除天然烷烴,又不影響目標(biāo)物的測定。
由圖1A可見,正構(gòu)烷烴含量過高,無法找到MOSH的輪廓;圖1B為去除天然烷烴后的GC譜圖。經(jīng)過氧化鋁凈化,天然烷烴的C31~C35部分被完全吸附,大部分C25~C29烷烴被除去;剩余的烷烴已經(jīng)不再干擾MOSH寬峰的輪廓,完全不影響礦物油寬峰面積的積分計(jì)算(圖1中方框部分)。因此,確定以10 g活化氧化鋁去除稻谷提取液中的天然烷烴。
2.2 MOSH的中心切割時(shí)間
HPLC-GC中HPLC用于分離除去樣品基質(zhì)(如油脂),同時(shí)將MOSH和MOAH分離。由于HPLC色譜柱的顆粒小、分離效率高,一般采用硅膠填料即可達(dá)到分離目的[10]。其次,分離后的MOSH流分需要精準(zhǔn)地從HPLC轉(zhuǎn)移至到GC,以完成MOSH的準(zhǔn)確定量。本實(shí)驗(yàn)通過“中心切割”技術(shù)[29],將HPLC流出的MOSH轉(zhuǎn)移至GC分析,再結(jié)合GC的大體積進(jìn)樣系統(tǒng),實(shí)現(xiàn)凈化-轉(zhuǎn)移-富集-分析的自動化過程。
采用硅膠柱分離提取(濃縮)液中的礦物油時(shí),MOSH最先流出,其次是MOAH,最后是樣品基質(zhì)。對于MOSH餾分,根據(jù)體積排阻效應(yīng),通常高分子質(zhì)量的直鏈烷烴先流出,之后為低分子質(zhì)量的直鏈烷烴和環(huán)烷烴[10,30]。為精準(zhǔn)獲得MOSH餾分,本實(shí)驗(yàn)配制了C48、Cho、TBB混合標(biāo)準(zhǔn)溶液作為MOSH餾分的標(biāo)記物,其中C48為高分子質(zhì)量烷烴標(biāo)記物、Cho為MOSH餾分終止標(biāo)記物、TBB為MOAH餾分開始的標(biāo)記物。精準(zhǔn)切割MOSH餾分要求C48全部保留在MOSH中,不得出現(xiàn)在死體積中;Cho必須全部留在MOSH餾分中,不得出現(xiàn)在MOAH中;而代表MOAH的TBB則不得出現(xiàn)在MOSH餾分中。本實(shí)驗(yàn)通過標(biāo)記物確定MOSH餾分的中心切割時(shí)間為2.5~3.1 min。
2.3 方法學(xué)考察結(jié)果
2.3.1 儀器精密度和轉(zhuǎn)移性能
由于MOSH是涵蓋一定沸程范圍(C10~C50)的飽和烴混合物,低沸點(diǎn)物質(zhì)容易在溶劑排除的過程中產(chǎn)生揮發(fā)損失,本實(shí)驗(yàn)通過連續(xù)6 次直接進(jìn)樣分析C7~C40正構(gòu)烷烴混合標(biāo)準(zhǔn)溶液(1 mg/L)評估HPLC-GC的精密度和轉(zhuǎn)移性能。考察C11~C40范圍,每種正構(gòu)烷烴的重復(fù)性以相對標(biāo)準(zhǔn)偏差(relative standard deviation,RSD)表示,平均值為1.4%,儀器精密度良好。以n-C20峰面積為參照,計(jì)算C11~C40正構(gòu)烷烴相對于C20的響應(yīng)情況,結(jié)果如圖2所示。C11響應(yīng)因子為0.76,C12響應(yīng)因子為0.89,C13~C40相對于C20響應(yīng)因子在0.93~0.98范圍內(nèi)。因?yàn)榈陀贑13的MOSH污染很少發(fā)生[31],具有毒理學(xué)意義的C16~C35的響應(yīng)因子在0.93~1.0范圍內(nèi),因此,HPLC-GC的轉(zhuǎn)移性能滿足食品樣品中MOSH的測定。
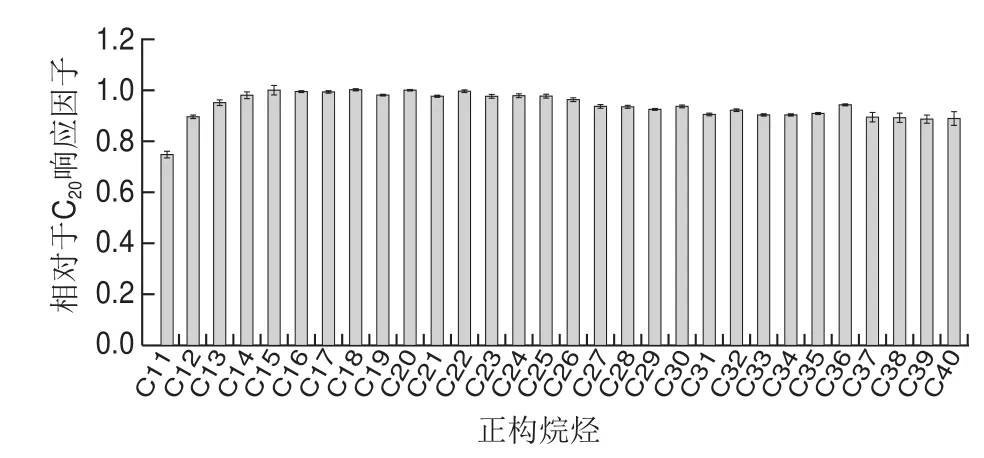
圖2 C11~C40相對于C20響應(yīng)因子分布Fig. 2 Alkane distribution profile within the range of C11–C40
2.3.2 線性范圍
液體石蠟常用作MOSH的標(biāo)準(zhǔn)物質(zhì)。將1.3.1節(jié)配制的液體石蠟系列工作溶液,在1.3.3節(jié)條件下分析。以GC譜圖中的寬峰面積與對應(yīng)質(zhì)量濃度繪制曲線,所得標(biāo)準(zhǔn)曲線為Y= 891 483X-216 571,相關(guān)系數(shù)為0.999 9,說明液體石蠟在0.5~100 mg/L質(zhì)量濃度范圍內(nèi)線性關(guān)系良好。
2.3.3 定量限的測定
定量限根據(jù)進(jìn)入FID的MOSH質(zhì)量濃度和體積確定。MOSH是飽和烴類化合物的集合(寬峰),其FID的檢測靈敏度僅是單個(gè)化合物(尖峰)的1%,因此,通常要求進(jìn)入FID的MOSH量至少達(dá)到50 ng才能準(zhǔn)確定量分析[10]。本實(shí)驗(yàn)將10 g稻谷(或大米)的提取液濃縮至1.0 mL,注入HPLC-GC的體積為100 μL,相當(dāng)于1.0 g稻谷(或大米)進(jìn)入FID檢測,因此定量限為0.05 mg/kg。
2.3.4 回收率的測定
考慮到稻谷樣品經(jīng)過了氧化鋁凈化,對分析結(jié)果的準(zhǔn)確性造成影響[11],為此,本實(shí)驗(yàn)選取一個(gè)稻谷樣品進(jìn)行方法準(zhǔn)確性驗(yàn)證,即向樣品中添加液體石蠟溶液進(jìn)行回收率實(shí)驗(yàn),添加量分別為0.25、0.5、1.0 mg/kg[32]。分析步驟為將提取液先經(jīng)氧化鋁凈化,然后濃縮、注入HPLC-GC分析,平行測定6 次后計(jì)算加標(biāo)回收率和RSD。表1表明,加標(biāo)回收率為89.1%~91.4%,RSD為4.6%~5.5%,說明該方法的準(zhǔn)確度滿足分析檢測要求。
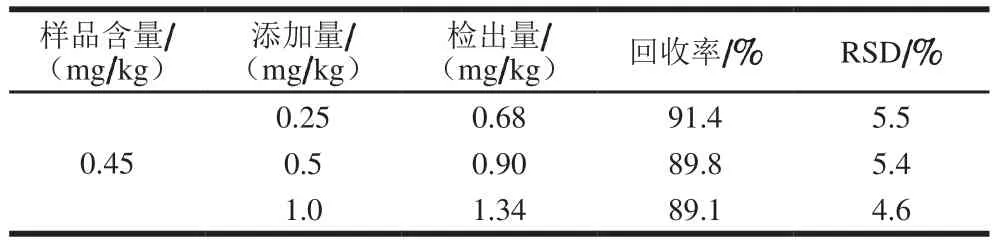
表1 稻谷樣品的加標(biāo)回收率和RSDTable 1 Recoveries and RSDs for spiked samples
2.4 樣品檢測結(jié)果

表2 稻谷和大米樣品中的MOSH含量Table 2 Contents of MOSH in paddy and rice samples
任意選取江蘇省東南部如東縣的6 塊稻田,以人工和機(jī)器兩種方式采收樣品,隨后將機(jī)器采收的稻谷樣品送至當(dāng)?shù)啬シ患庸こ纱竺讟悠罚⑶译S機(jī)采購市售商品大米樣品6 個(gè),共收集稻谷和大米樣品24 個(gè),采用HPLC-GC分析樣品的MOSH含量,結(jié)果見表2。本方法測定24 個(gè)稻谷和大米樣品中的MOSH,其含量為0.30~2.30 mg/kg。
2.4.1 比較人工和機(jī)器采收的稻谷樣品污染情況
人工采收的稻谷樣品(A1~A6)中MOSH含量平均值為0.50 mg/kg,污染主要來自于環(huán)境[1]。同一塊田地的水稻經(jīng)機(jī)器采收(B1~B6)則MOSH含量平均上升至0.60 mg/kg,可能是采收時(shí)收割機(jī)使用的潤滑油或燃料油等機(jī)械油污染了稻谷。由表3可知,對同一田地的水稻經(jīng)人工和機(jī)器兩種采收方式所得稻谷的MOSH含量配對后進(jìn)行t檢驗(yàn),P=0.009 9<0.01,進(jìn)一步說明了兩種采收方式對稻谷的MOSH含量有顯著差異,機(jī)器收割方式引入了新的污染。
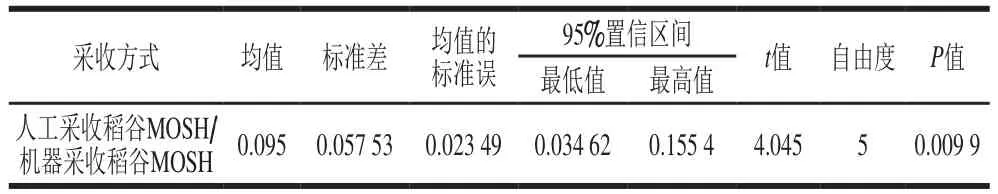
表3 采收方式的配對t檢驗(yàn)Table 3 Paired t- test of the effect of harvesting methods on MOSH content of paddy
2.4.2 機(jī)采稻谷經(jīng)磨坊加工后的污染變化
江蘇省如東縣絕大多數(shù)農(nóng)民都使用當(dāng)?shù)啬シ患庸さ淖约姨锏胤N植的大米,因此將機(jī)器采收的稻谷樣品(B1~B6)直接在當(dāng)?shù)啬シ患庸こ纱竺讟悠罚–1~C6)。如表4所示,機(jī)收稻谷和經(jīng)過磨坊加工后大米的MOSH含量配對后進(jìn)行t檢驗(yàn),P=0.001 2<0.01,隨著稻谷脫去谷殼,磨坊大米中MOSH含量顯著降低(約50%)。由此可見,稻谷中有接近一半的礦物油污染存在于谷殼中,脫殼過程可以去除大部分礦物油污染,并且主要是毒性較大的C16~C35MOSH(表2)。

表4 磨坊加工稻谷前后的配對t檢驗(yàn)Table 4 Paired t- test of the effect of mill processing on MOSH content of paddy
2.4.3 比較磨坊大米和市售大米的污染情況
我國市售商品大米樣品(7~12)MOSH的污染水平(平均值1.19 mg/kg)遠(yuǎn)低于德國市場商品大米中MOSH的污染水平(平均值12.1 mg/kg)[24],卻是農(nóng)村磨坊大米樣品(平均值0.33 mg/kg)的4 倍。磨坊將稻谷加工成大米取樣只經(jīng)過3 次碾米工序,而商品大米生產(chǎn)過程復(fù)雜,碾米工序后還需拋光、色選、包裝等工序,因而推斷后續(xù)的加工及包裝環(huán)節(jié)[25]給大米引入了新的污染。
2 種市售大米的MOSH譜圖(圖3)呈現(xiàn)出不同的碳數(shù)范圍分布和譜圖特征。其中圖3A中MOSH寬峰主要位于低沸點(diǎn)區(qū)域,碳數(shù)范圍以n-C17為中心,是柴油污染的典型特征;圖3B中的大部分MOSH處于中心碳為n-C29的高沸點(diǎn)區(qū)域,通常被認(rèn)為是潤滑油的典型特征[3]。需要注意的是,這兩種污染油的污染程度不同,圖3A的柴油污染量為0.35 mg/kg,圖3B的潤滑油污染為1.81 mg/kg。由此可見,市售大米的礦物油污染很可能是在碾米之后的拋光、色選、包裝等加工環(huán)節(jié),受到柴油和潤滑油遷移污染。
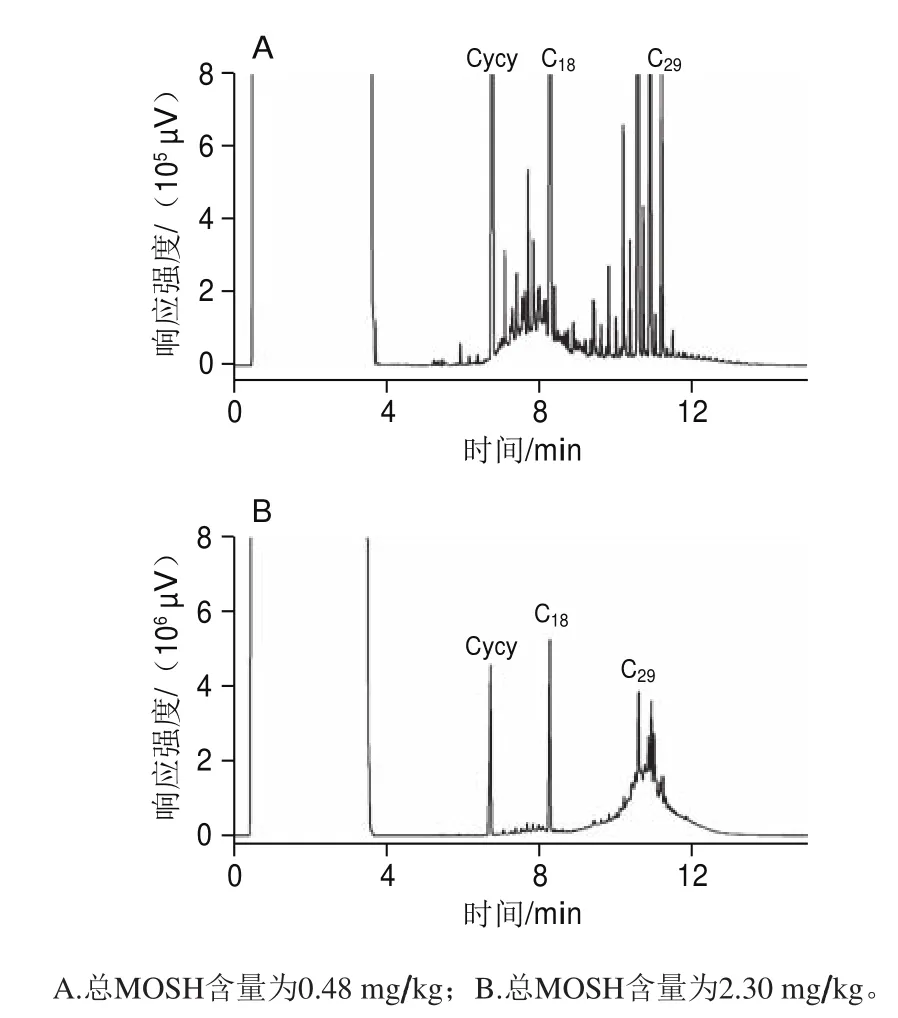
圖3 市售大米中MOSH的HPLC-GC譜圖Fig. 3 HPLC-GC chromatograms of MOSH contamination in commercial rice samples
3 結(jié) 論
本研究建立了HPLC-GC測定稻谷和大米中MOSH的方法,包括確定氧化鋁去除天然烷烴干擾的條件,應(yīng)用中心切割技術(shù)精準(zhǔn)分離得到MOSH餾分,優(yōu)化了大體積進(jìn)樣條件與GC分析條件,最終實(shí)現(xiàn)了樣品前處理與分析過程的自動化。該方法通過精密度、線性范圍、回收率等方法學(xué)考察,可以用于大米等谷物樣品的日常檢測。此外,本實(shí)驗(yàn)通過比較分析稻谷和大米樣品的MOSH含量及其GC譜圖特征,推測大米的礦物油污染來源可能來自大米商品化的拋光、色選、包裝等加工環(huán)節(jié)引入的柴油和潤滑油污染,建議加強(qiáng)產(chǎn)業(yè)鏈監(jiān)管,保證大米質(zhì)量安全。

