AP化學酸堿平衡考點整合
楊新軒
摘? 要:AP全稱為Advanced Placement,為美國大學先修課程,是學生申請國際大學評價的一個重要指標,可有效的衡量學生專業課程的學習能力。本論文從知識構成和考察方式兩個方面對高考和AP考試進行客觀的比較,并分析AP化學在酸堿平衡這一章所涉及的知識點,通過總結歷年的考察本章知識點的習題,整合出常見的知識點考察方式,并以問題的形式給出,幫助學生鞏固知識點,提高分析和做題能力。
關鍵詞:AP化學;酸堿平衡;考察題型
1 課題研究背景介紹
1.1 AP課程背景簡介
AP是Advanced Placement的縮寫,中文一般翻譯為美國大學先修課程、美國大學預修課程。指由美國大學理事會(The College Board)提供的在高中授課的大學課程。美國高中生可以選修這些課程,在完成課業后參加AP考試,得到一定的成績后可以獲得大學學分。
1.2 本課題研究動機及目標
本文作者在西安高新一中國際課程班工作時間三年,在三年間主要教授AP化學,對于考試的題目有比較全面的認識。學生在化學學科方面整體的成績不是很突出,所以就想要找出一個方法通過重新整合知識點和考法讓學生建立簡單而又印象深刻的知識框架。幫助學生將不同的酸堿平衡題目找出規律,找出常見的考察的知識點和重難點并幫助他們突破。
2 教材內容分析
酸堿平衡為AP化學教材的16章和17章。
第16章:
16.1? ?酸堿理論和布朗斯特酸堿理論;
16.2? ?共軛酸堿對及其相對強弱
16.3? ?水的自耦電離和離子積
16.4? ? pH與pOH
16.5? ?強酸強堿pH計算
16.6? ?利用電離常數計算弱酸溶液的pH值及多元弱酸pH計算
16.7? ?利用電離常數計算弱堿的pH值
16.8? ?Ka和Kb的關系
16.9? ?鹽溶液的酸堿性
16.10 結構和酸堿性強弱的關系
16.11 路易斯酸堿理論
本章內容之前是化學平衡,學生已經初步建立分析平衡問題的基本思路和能力。本章內容是酸堿平衡是基礎研究,主要研究對象為單一溶液。布朗斯特酸堿理論中的酸堿物質涵蓋范圍更加廣泛,學生要清楚在水溶液中酸堿都有怎樣的離子行為,所以電離方程式的書寫就是本章第一個重點的內容。
在此基礎之上,學生通過書寫弱酸弱堿的電離方程式,引入新的平衡常數——電離常數,利用在化學平衡這一章所學的平衡常數的應用:用平衡常數判斷反應進行的限度,來用電離常數的大小判斷弱酸的酸性相對強弱。用共軛酸堿對電離常數之積等于水的離子積可以有效判斷弱酸共軛堿的相對強弱,以此理論可順利解釋強酸制取弱酸的反應有較大的自發性。此為本章第二個重點。
pH計算的引入是酸堿平衡的一大難點,對于強酸強堿溶液的pH計算方法相對較為容易,因為二者都是完全電離,可以直接通過酸堿濃度求取氫離子濃度。而弱酸弱堿溶液pH的計算就是本章最大的難點。這部分理應引導學生列化學平衡三段式,利用平衡常數表達式來計算氫離子濃度,然后再求取pH值。弱堿的計算方法和弱酸類似。對于多元弱酸,因為是分步電離且各級電離常數依次減小,所以直接可以將其視為一元弱酸來計算pH值。
鹽溶液的酸堿性也是AP經常會考的東西,主要用于判斷滴定終點溶液的酸堿性。在AP中,可直接利用布朗斯特酸堿理論來解釋鹽溶液的酸堿性。通過判斷組成鹽的陰陽離子所屬物質可以迅速的判斷鹽溶液的酸堿性,對于水解反應,也可以直接寫成布朗斯特酸堿電離方程式。
第17章:
17.1 同離子效應
17.2 緩沖溶液及其pH計算
緩沖溶液的工作原理
17.3 酸堿中和滴定
強酸滴定強堿
強堿滴定弱酸
強酸滴定弱堿
多元弱酸滴定
鹽溶液的滴定
本章內容主要是酸堿平衡的應用,第一節同離子效應為后面的緩沖溶液和酸堿中和滴定作以鋪墊,緩沖溶液是本章內容的第一個重點。在強酸滴定弱堿的過程中或者強堿滴定弱酸的過程中,未到等當點之前待測液構成緩沖溶液,為共軛弱酸和共軛弱堿構成,所以在此過程中pH計算考察次數極多。
化學是一門以實驗為基礎的自然科學,所以酸堿平衡在實驗中最常見的考察方法就是以滴定的形式考出。第一部分就是實驗操作的考察,實驗原理,實驗儀器,每一步的實驗操作,特別是對于滴定管和移液管的考察尤為多。第二部分是酸堿滴定中的計算問題,在已知標準液、待測液體積和濃度的情況下計算待測液的濃度。第三部分主要考察在滴定過程中pH的變化,特別是強堿滴定弱酸,在最開始的時候為一元弱酸體系,可按照一元弱酸體系處理。當開始滴定還未到等當點的期間,構成緩沖溶液,此時可以先通過計算共軛酸堿對濃度,然后在用緩沖溶液pH計算公式計算pH=pKa+log[[A-][HA]]。此過程中最重要的點就是滴定半程,在半程的時候[A-]=[HA],所以pH=pKa,這也是酸堿中和滴定第二個重要的應用,可以通過酸堿中和滴定的曲線來求出電離常數大致的范圍。第三點是在等當點時pH的計算,等當點溶液中溶質為NaA,此時可以按照一元弱堿處理,計算溶液的pH值。最后一點就是指示劑的選擇,指示劑可以認為是不同顏色的共軛酸堿對,理論變色點為pH等于pKa的點,所以選擇指示劑的原則就是其pKa離等當點pH最近。
以上就是在AP化學中酸堿平衡的知識點總結和常見的考法,筆者將2002年到2018年所考到的所有關于酸堿平衡的題目選出,并對每一問的考察知識點和考察方法做以總結,并通過總結、改編和整合整理出能涵蓋所有考點的習題。
3 AP考試題目考點分析
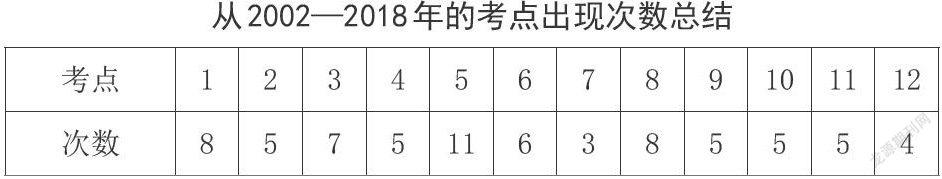
從2002—2018年的考點出現次數總結
通過對歷年的AP簡答題中的酸堿平衡問題進行分析,不難發現,對于緩沖溶液的考察尤為重要,對不同酸堿平衡體系的pH計算更加考察學生對于平衡的理解,對于溶液中離子行為的圍觀認識,有利于構建學生的微粒觀,加深學生對化學反應的認識。
而在題目逐年的分析中,筆者發現題目的考點并未發生太大的改變,但是提問的方式有很大改變,題目從簡單的計算更傾向于學生運用所學對知識進行主觀解釋,這樣就需求學生對知識點有更深刻的認識。
4 題目的整合與設計
例題:
1.已知一元弱酸HA的Ka=1.0×10-5
(a)請寫出HA電離方程式;? ? ? ? (電離方程式)
(b)HA的共軛堿是什么?? ? ? ? (共軛酸堿對)
(c)如果HB電離常數為1.0×10-6,則與HA相比哪一個的酸性更強,為什么?
A-與B-相比哪一個堿性更強,為什么?? ? ? ? (電離常數和酸堿性強弱關系)
(d)請寫出HA電離常數Ka表達式;? ? ? ? (電離常數表達式)
(e)請計算A-的電離常數Kb;? ? ? ? (共軛酸堿對Ka和Kb關系)
(f)(i)請求算濃度為0.100mol/L的HA的pH值;? ? ? ? (用Ka計算一元弱酸pH值)
(ii)請求算此溶液中HA的電離度;? ? ? ? (電離度)
(iii)0.100mol/L的HB(一元弱酸)溶液的pH值為4.00,求其電離常數Ka;? ? ? ? (用pH值求取Ka)
(iv)濃度為0.100mol/L的H2C(二元弱酸)溶液pH值為多少?
已知: Ka1=1.0×10-5? ? ? ? ? ? Ka2=1.0×10-9? ? ? ? ?(多元弱酸pH計算)
(g)(i)請計算0.100mol/L的A-溶液的pH值? ? ? ? (一元弱堿pH計算)
(ii)哪些物質是布朗斯特弱堿?? ? ? ? (對于布朗斯特酸堿理論的認識)
(h)判斷下列物質溶液的酸堿性并用水解方程式解釋。? ? (鹽溶液的酸堿性)
FeCl3? ? Na2CO3? ? NH4NO3? ? CH3COONa
(j)完成下面的方程式并指出那個物質是路易斯酸;? ? ? ? (路易斯酸堿理論)
(i)NH3 + BF3
(ii)AgCl + NH3
2.已知一元弱酸HA的Ka=1.0×10-5
(a)如果加水到0.100M的HA溶液中:? ? ? ? (稀釋過程中的離子行為)
(i)pH怎么變化,為什么?
(ii)電離度怎么變,為什么?
(iii)電離常數怎么變,為什么?
(iv)如果加入NaA到溶液中,以上三項如何變化?
(b)已知四種混合溶液組成? ? ? ? (緩沖溶液的配置和性質)
①0.1M的NaOH溶液100mL與0.1M的HA溶液100mL
②0.2M的NaOH溶液100mL與0.1M的HA溶液100mL
③0.1M的NaOH溶液100mL與0.2M的HA溶液100mL
④0.1M的NaA溶液100mL與0.1M的HA溶液100mL
(i)以上哪一個溶液是有效的緩沖溶液?
(ii)你還有其它方法可以制取緩沖溶液嗎?
(iii)計算你選擇有效緩沖溶液的pH值;? ? ? ? (緩沖溶液pH計算)
(iv)哪些緩沖溶液pH>7,哪些緩沖溶液pH<7?
(v)HCO3-是一種有效的緩沖溶液嗎?
(c)如果用0.100M的標準氫氧化鈉溶液去滴定25.00mL未知濃度的HA溶液
(i)如果消耗氫氧化鈉溶液的體積為25.00mL,則HA溶液濃度為多少?? ? ? ? (中和滴定的計算)
(ii)在等當點時,pH值大于7、小于7、還是等于7,為什么?? ?(鹽溶液酸堿性判斷)
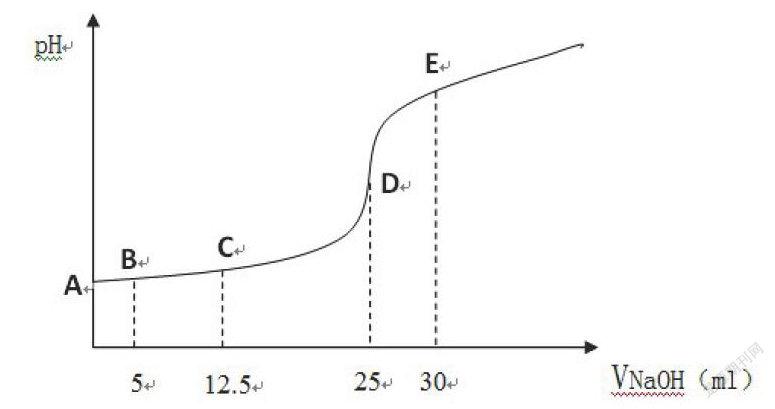
(iii)請畫出滴定曲線;? ? ? ? (滴定曲線)
(iv)請求出下圖中ABCDE五個點的pH值。(酸堿中和滴定過程中pH計算)
(v)等當點和滴定終點有什么區別?
(vi)請選擇最合適的指示劑并解釋? ? ? ? (指示劑的選擇)
以上兩道習題基本涵蓋酸堿平衡簡答題的所有考法,每一道小題對應一個知識點,對于這些知識點的要求,有些需要學生熟知,有些需要學生會計算,還有寫需要學生解釋其原理。在做這些整合題的時候,相當于有效的幫助和引導學生復習,將每一個知識點理解透徹,可以針對每個知識點自己還原知識內容,補充未涉及到的細碎知識,自我總結和梳理能力才是筆者最希望學生能通過解析整合題獲得的東西。
5教學成果反饋和反思
通過讓學生做整合題,在讓學生鍛煉讀題和做題能力的同時,也讓學生對知識和考點進行總結和復習,讓學生們在學習章節知識時能梳理出自己的知識框架。幫助學生提高視角,能站在出題人的角度上去思考題目,可以更加透徹的領悟題目的用意。在讓學生做了整合題以后,筆者和學生交流討論,學生們坦言,之前在做相關習題時主要存在的問題是讀不懂題和不知道如何入手去解決問題,而在有了整合題后,學生基本上每一個問題都可以在整合題中找到相對應的小題,可以用類似的方法去解決問題。解題能力提高較為顯著。
針對最近幾年的題目考察方式的分析,死板的問題考察已經慢慢被靈活新穎的試題背景所替換。現在的題目更多的是基于一個實驗中存在的問題引入知識點的考察,在解決問題的過程中一步步引導學生通過所學的知識去解決問題,這也正是新課標下要求在教育過程中提倡的學科素養,不僅僅讓學生學到知識,要讓學生在真是的實驗環境下,真是的生活中將所學知識合理的運用并解決問題。針對這樣的題目,如何提高學生的讀題能力是下一步需要重點解決的問題。
6 結語
培養優良的品質和優秀的學習能力,才是新時代教育工作者在培養國家的棟梁之才之時所需著眼的重點,如何有效的提高學生在處理問題時的思維模式的高度和反應效果便是我們在平日教育教學過程中最應該思考和反思的問題。我們也應該像學生一樣,在出現各種各樣新的問題和挑戰的時候,用于面對,不畏懼,不退縮,發揚“為時創新,人盡其才”的高新一中精神。

