平掃與增強CT影像組學特征診斷肺腺癌浸潤性的應用研究
高晨 葉劍鋒 吳林玉 陳愿君 王世威 許茂盛
肺癌是最常見的腫瘤之一,而肺腺癌是其中最主要的類型[1]。原位腺癌(adenocarcinoma in situ,AIS)和微浸潤性腺癌(minimally invasive adenocarcinoma,MIA)如果進行完整切除,患者五年無病生存率接近100%[2]。目前在臨床上,確定病灶性質的金標準仍然是病理學檢查,包括穿刺和手術切除[3]。但是由于腫瘤具有異質性,所以來自穿刺或者病理觀察的手術切除的腫瘤組織可能無法代表整個腫瘤的類型[4]。而影像組學是通過高通量的定量提取影像圖像的特征,并對特征進行處理和統計分析,進而來幫助診斷和預測的一種新技術[5]。但是國際上在平掃和增強CT兩種圖像獲取的影像組學特征的價值比較方面尚未有定論。故本研究旨在對比平掃和增強CT中獲取的影像組學特征在區分肺腺癌浸潤性方面的價值。
1 資料與方法
1.1 一般資料 收集2016年1月至12月在本院肺部手術符合文件的患者42例。納入標準:(1)在本院病理結果為肺腺癌,腫瘤是原發性的;(2)CT資料需要有同次平掃和增強圖像,重建層厚≤1mm;(3)在CT掃描前均未接受對該病灶活檢、放化療等操作和手術治療;(4)需在CT檢查后6周內進行手術治療并獲得病理結果。研究經醫院倫理委員會批準同意。
1.2 CT掃描 采用多層螺旋CT掃描儀(日本東芝Aquilion ONE和德國西門子SOMATOM Sensation 64),掃描參數:管電壓100~120kVp,管電流100~224mA,重建層厚分別為1mm(Aquilion ONE)和0.75mm(SOMATOM),矩陣512×512,增強掃描采用的雙筒高壓注射器于肘靜脈注射40~70ml非離子型對比劑,注射速率3ml/s。
1.3 感興趣區的勾畫 將所有患者薄層平掃和增強CT圖像(肺窗)導入ITK-SNAP(3.6.0版本)軟件,由2名放射科高年資住院醫師在不知病理結果的情況下對病灶逐層進行勾畫,勾畫的ROI大小盡可能與病灶的邊緣一致,但血管以及胸膜不會被勾畫入ROI。
1.4 影像組學特征的提取 將原始CT圖像以及使用ITK-SNAP軟件勾畫的相應ROI,批量導入AK分析軟件[6](=GE),進行影像組學特征的自動提取。提取的影像組學特征包括基于ROI大小和密度等相關低階參數以及涉及步長矩陣(RLM)和灰度共生矩陣(GLCM)等的高階紋理特征參數。
1.5 建立預測模型及統計學分析 將AK分析軟件中獲取的平掃及增強圖像的影像組學特征分別運用R軟件進行處理。對影像組學特征數據進行預處理標準化。按照2∶1的比例,隨機分為訓練組31個病灶(14個AIS/MIA,17個IAC)和驗證組15個病灶(7個AIS/MIA,8個IAC)。在R軟件中,以訓練組圖像獲得的特征值使用Lasso回歸和逐步回歸進行降維,得到剩余特征。利用R軟件和剩余特征建立logistic回歸模型,再以十折交叉驗證方法對模型進行檢驗,得到受試者工作特征曲線(ROC曲線)和計算其鑒別肺腺癌浸潤性的敏感度和特異度、準確度以及ROC曲線下面積(AUC)。利用R軟件語言包“ROC.TEST”對兩者ROC進行比較,P<0.05表示差異有統計學意義。
2 結果
符合入組條件的病例共42例,男14例,女28例;年齡38~82歲,平均(60.2±10.2)歲。病灶數46個,均為腺癌,其中原位腺癌13個,微浸潤性腺癌8個,浸潤性腺癌25個。病灶大小范圍0.6~2.9cm,均≤3cm。
AK軟件提取的影像組學特征共385個,平掃CT圖像的影像組學特征經過數據預處理,Lasso回歸后得到6個特征(見圖1、表1)。再進行逐步回歸降維后獲得3個最為有效的特征(見表1)。利用3個特征構建logistic回歸模型并以十折交叉檢驗的方法進行檢驗。平掃CT圖像驗證組鑒別肺腺癌浸潤性的敏感度、特異度、準確度和AUC分別為0.625、1.000、0.800、0.839(表2)。增強CT圖像的影像組學特征經過數據預處理,Lasso回歸后得到2個特征(見圖2、表1)。利用2個特征構建logistic回歸模型并以十折交叉檢驗的方法進行檢驗。增強CT圖像驗證組鑒別肺腺癌浸潤性的敏感度、特異度、準確度和AUC分別為0.750、1.000、0.867、0.893(見表2)。利用R語言分別比較兩者訓練組和驗證組的ROC曲線(見圖3),分別得P值0.600,0.700,均>0.05,表明兩者模型ROC的差異均無統計學意義。
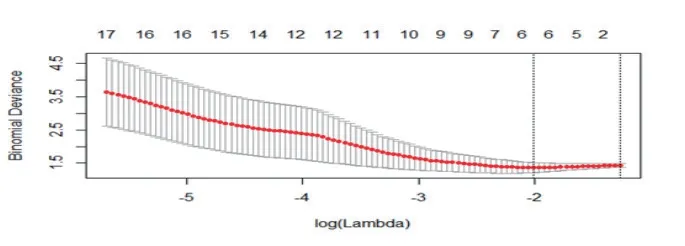
圖1 平掃CT圖像訓練組影像組學特征經Lasso回歸的降維圖
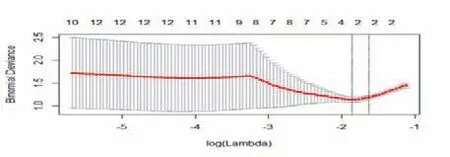
圖2 增強CT圖像訓練組影像組學特征經Lasso回歸的降維圖

表1 鑒別肺腺癌的IAC型和AIS型/MIA型的特征與方法
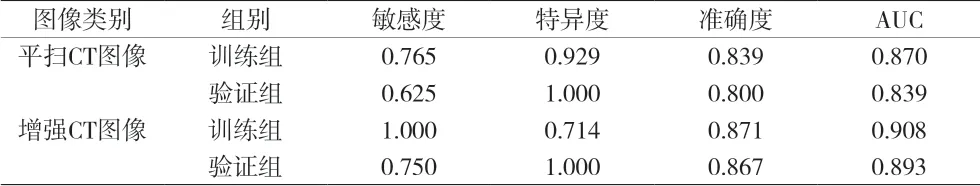
表2 IAC和AIS/MIA的統計結果
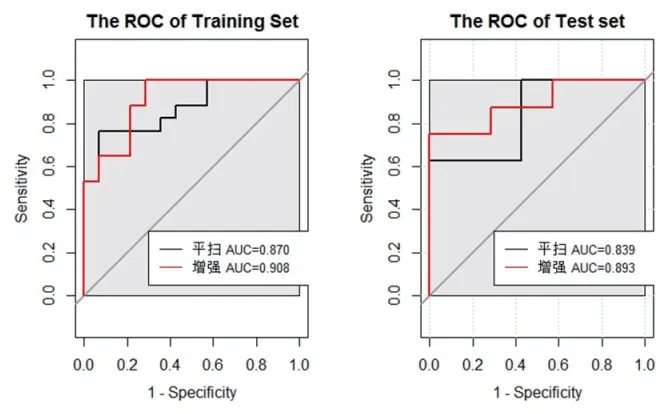
圖3 左為訓練組的模型ROC曲線;右為驗證組的模型ROC曲線
3 討論
臨床上,判斷肺腺癌浸潤性最常用的方法是CT和病理檢查。但是,CT圖像病灶的判別主觀性較強,且較病理檢查不敏感。鑒別的準確性依賴于放射科醫生擁有的知識以及經驗。不同放射科醫生,可能會對同一CT圖像上的病灶有不同的看法。而且一些CT圖像征象特異性不足也可能導致鑒別的準確性降低。
肺部病灶的病理一般來自穿刺活檢以及手術切除,目前病理結果被視為金標準[3]。但是病理檢查有其一定的局限性。第一,病理檢查具有有創性,并且存在操作風險。第二,由于腫瘤具有異質性,來自穿刺活檢或者手術切除的腫瘤病理切片結果,可能無法完全代表整個腫瘤的性質[4]。第三,穿刺活檢的部位是有限的,而且不是所有患者都能耐受病灶的手術切除,此部分患者的病理結果較難或無法獲得[7]。
隨著技術的發展,影像組學作為一種新技術受到了醫生們的關注。影像組學過程包括用計算機高通量提取感興趣區的數據特征,并進行數據處理和降維,然后構建出模型來幫助醫生診斷和預測疾病。目前,用影像組學來鑒別肺腺癌的病理類型的研究已有較大的進展。但是大部分肺部影像組學文章采用平掃薄層CT圖像來勾畫感興趣區,較少有利用增強薄層CT圖像來勾畫感興趣區。本研究由于病灶數量為46個,在平掃CT圖像特征中,經Lasso回歸降維后的特征為6個,為防止過擬合的現象,對選取的6個特征再進行逐步回歸降維,得到3個特征。從本研究的結果可以看出,在鑒別IAC和AIS/MIA上,通過增強CT圖像獲得的影像組學特征經過建模后的模型性能總體上比平掃CT圖像獲得的影像組學特征模型好,但是差異無統計學意義。根據本研究結果,作者認為在影像組學特征鑒別IAC和AIS和MIA上,平掃CT圖像可能在那些對造影劑過敏或者其他不適合增強CT檢查的患者中具有與增強CT圖像一樣的效果。但國際上部分研究者認為平掃CT圖像的影像組學特征更有意義。如有文獻報道[8],用分別獲取自增強CT圖像和平掃CT圖像的同樣的3個影像組學特征建模,使用增強CT圖像的影像組學特征使模型鑒別肺原發腫瘤與肺部肉芽腫性病變的敏感性從88%降至38%。但是也有研究[9]表明增強CT圖像的定量分析在區分IAC和AIS/MIA上更有價值。有研究者[10]認為,增強的造影劑可能會使紋理差異模糊,并且提出對比增強的影響不一定是二元的,還可能與對比劑灌注的速度、對比劑的型號、對比劑的用量、延遲掃描時間、患者的心功能和身體機能有關。而目前在國際上,關于經平掃CT圖像和增強CT圖像獲得的影像組學特征的價值對比方面,尚未有定論,有待更多的研究者來研究。
本研究的局限性如下。第一:本研究是回顧性分析,并且是單中心的研究,樣本存在一定的偏移,可能會降低本研究結論的準確性。第二:樣本量過少可能會導致建模以及結果的偏移。第三:CT圖像的參數不完全相同,可能會影響結果。第四:ROI的勾畫是人工逐層勾畫,可重復性不如半自動的ROI勾畫,而且耗時較長。
綜上所述,影像組學特征能幫助醫生診斷和預測肺部病灶。本研究結果表明,在影像組學特征區分肺腺癌浸潤性方面,平掃CT圖像和增強CT圖像都具有較高的價值,并且在不適合接受增強CT檢查的患者中,平掃CT圖像可提供價值相當的信息。當然目前影像組學領域以及增強CT圖像的影像組學特征還需進一步研究。

