雷帕霉素對動脈粥樣硬化小鼠的治療作用及機理①
王 平 姚平波 張劍鋒
(南華大學附屬南華醫院重癥醫學科,衡陽421002)
動脈粥樣硬化是臨床常見的心腦血管疾病如冠心病、腦梗死和外周血管病變的主要病理原因,其發病的本質是脂質代謝障礙,特點表現為受累動脈病變從內膜開始,一般先有脂質和復合糖類積聚、出血及血栓形成,進而纖維組織增生及鈣質沉著,并有動脈中層的逐漸蛻變和鈣化,導致動脈壁增厚變硬、血管腔狹窄,且動脈血管內膜積聚大量黃色粥樣脂質[1,2]。動脈粥樣硬化的發病原因較為復雜,與高血壓、高血脂、糖尿病、肥胖和遺傳因素等均有密切關系[3,4]。自噬是真核細胞保守的生物學現象,在維持細胞脂質穩態中發揮著重要作用[5]。自噬在粥樣硬化中扮演雙刃劍的角色,起初的研究顯示在動脈粥樣硬化過程中自噬水平明顯增加,促進了動脈粥樣硬化的進展[6,7]。但是最近有報道顯示自噬也可以緩解動脈粥樣硬化的發生[8,9]。但是機制尚不完全清楚。本研究采用自噬激活劑雷帕霉素分析了其對動脈粥樣硬化的影響,旨在為臨床治療動脈粥樣硬化提供一定的理論依據。
1 材料與方法
1.1材料 8周齡載脂蛋白E基因敲除(Apo E-/-) C57BL/6J小鼠購自北京維通利華公司;DMEM培養基、胎牛血清和青鏈霉素均購自美國Gibico公司;LC3兔多克隆抗體均購自日本MBL公司;BODIPY493/503購自美國Thermo Fisher公司;TNF-α、IL-6和IL-1β ELISA試劑盒購自美國R&D公司;Ⅱ型膠原酶購自美國Sigma公司;高脂飼料購自南通特洛菲飼料科技有限公司;JEM-ARM200F 透射電子顯微鏡購自日本電子;ZEISS510激光共聚焦顯微鏡購自德國蔡司公司。
1.2方法
1.2.1動脈粥樣硬化模型構建、分組和治療 30只6周齡ApoE-/-C57BL/6J小鼠隨機分為兩組,模型組和實驗組。同時選取15只正常小鼠作為對照組。模型組和實驗組小鼠(每組15只)均從第6周開始采用高脂飼料喂養,兩組小鼠均喂養6周,至第12周實驗組小鼠經尾靜脈注射雷帕霉素10 mg/kg,對照組和模型組經尾靜脈注射等體積的生理鹽水。連續治療1周后處死小鼠進行后續實驗。
1.2.2主動脈平滑肌細胞分離和培養 對照組、模型組和實驗組小鼠脫臼處死,75%酒精浸泡3 min,無菌條件下打開胸腔,剪取沿主動脈弓及下端至膈的主動脈,置于無菌磷酸鹽緩沖液中,用鑷子剝離血管外組織和脂肪,將血管轉移至新鮮細胞培養皿中,將血管剪碎,加入1.5 mg/ml的 Ⅱ 型膠原酶在37℃酶解30 min,然后將細胞采用80目細胞篩過濾,將細胞均勻鋪于6孔板或者爬片上,然后進行后續實驗。
1.2.3HE染色分析主動脈病理變化 對照組、模型組和實驗組小鼠處死后,取心臟主動脈,用石蠟包埋,并切成8 μm的切片,將切片在二甲苯Ⅰ和二甲苯Ⅱ中分別處理15 min使組織透明,甩掉二甲苯,切片依次置于無水乙醇Ⅰ 5 min,無水乙醇Ⅱ 5 min,95%酒精5 min,90%酒精5 min,80%酒精5 min,70%酒精5 min,然后將切片浸于蒸餾水中5 min,然后采用蘇木精染色15 min,用水沖洗干凈后,用1%鹽酸酒精分化,再用自來水沖洗15 min,然后1%氨水酒精迅速處理5 s,用自來水洗滌,然后采用1%伊紅染色3 min,自來水洗滌后再進行脫水、中性樹脂封片處理。然后在顯微鏡下觀察病理變化。
1.2.4免疫熒光分析主動脈平滑肌細胞自噬水平 待對照組、模型組和實驗組平滑肌細胞爬片貼壁后,將細胞采用4%多聚甲醛固定10 min,然后用PBS洗滌3次后,采用5%的BSA封閉液室溫封閉30 min,然后采用封閉液稀釋羊抗兔LC3抗體(1∶200),在4℃孵育過夜,次日用PBS洗滌3次,每次5 min,然后采用FITC標記的羊抗兔熒光二抗在室溫孵育2 h,結束后用PBS洗滌3次,每次5 min,用DAPI染核,封片后采用激光共聚焦顯微鏡觀察自噬膜泡的數量。
1.2.5BODIPY染色分析平滑肌細胞脂質水平 對照組、模型組和實驗組平滑肌細胞爬片貼壁后,將細胞采用4%多聚甲醛固定10 min,然后用PBS洗滌3次后,然后采用BODIPY493/503染料(1∶2 000)在室溫染色20 min,PBS洗滌3次,每次5 min,然后采用DAPI染核,最后滴加防淬滅劑,封片,采用激光共聚焦顯微鏡觀察細胞中脂質水平。
1.2.6ELISA分析炎癥因子水平 對于小鼠血清,三組小鼠處死前眼球取血,然后分離血清;對于平滑肌細胞,對照組和實驗組平滑肌細胞分別培養于6孔板中,細胞連續培養12 h后,收集細胞上清。采用ELISA試劑盒測定對照組和實驗組小鼠血清或平滑肌細胞上清中炎癥因子TNF-α、IL-6和IL-1β的水平。
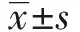
2 結果
2.1三組小鼠主動脈病理變化 與對照組小鼠比較,模型組小鼠組主動脈血管內膜增厚,血管壁厚薄不均一,可見泡沫樣細胞及膽固醇結晶形成的粥樣斑塊病灶;實驗組小鼠主動脈血管泡沫化程度緩解,動脈粥樣硬化程度減輕。實驗組小鼠主動脈壁紅色脂肪性板塊數量較模型組明顯減少,差異有統計學意義(P<0.05)。見圖1。
2.2三組小鼠平滑肌細胞自噬分析 實驗采用免疫熒光染色自噬體標記物LC3分析了雷帕霉素處理后細胞自噬體數量的變化,結果如圖2所示,可見對照組平滑肌細胞有較少的自噬體,而實驗組小鼠主動脈平滑肌細胞自噬體數量很多。定量分析顯示,對照組和模型組小鼠主動脈平滑肌細胞LC3標記的自噬體數量(11.86±3.97)個,(9.43±3.02)個明顯低于實驗組小鼠主動脈平滑肌細胞(23.87±6.03)個,差異有統計學意義(P<0.05)。
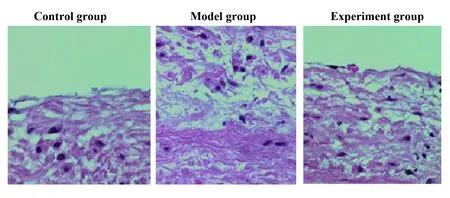
圖1 三組小鼠主動脈病理變化分析(×100)Fig.1 Pathological changes of aorta in three groups of mice(×100)
圖2 三組小鼠主動脈平滑肌細胞自噬體比較Fig.2 Comparison of autophagosome number of aortic smooth muscle cells in three groups
2.3三組小鼠平滑肌細胞脂質水平分析 結果如圖3所示,采用免疫熒光對主動脈平滑肌細胞中脂質染色顯示,可見與對照組比較,模型組細胞中大量脂質被染色,且呈聚集狀態,而經雷帕霉素處理的實驗組小鼠主動脈平滑肌細胞中脂質相對較少。定量分析顯示模型組脂質熒光強度(198.43±29.54)明顯高于對照組和實驗組脂質熒光強度(121.43±17.91)(89.43±12.49),差異有統計學意義(P<0.05)。
2.4三組小鼠血脂水平比較 結果如表1所示,與對照組比較,模型組小鼠TC、TG、LDL和HDL水平顯著升高,差異有統計學意義(P<0.05)。與模型組比較,實驗組小鼠TC、TG、LDL和HDL水平均顯著下調,差異有統計學意義(P<0.05)。對照組和實驗組小鼠外周血TC、TG、LDL和HDL水平比較差異無統計學意義(P>0.05)。
2.5三組小鼠炎癥因子水平分析 實驗采用ELISA分析對照組和實驗組小鼠外周血和主動脈平滑肌細胞培養上清中炎癥因子TNF-α、IL-6和IL-1β的水平,結果如表2所示,與模型組比較,實驗組小鼠外周血和主動脈平滑肌細胞培養上清中炎癥因子TNF-α、IL-6和IL-1β的水平均顯著下調,差異有統計學意義(P<0.06)。對照組和實驗組小鼠外周血和主動脈平滑肌細胞培養上清中炎癥因子TNF-α、IL-6和IL-1β的水平比較差異無統計學意義(P<0.05)。
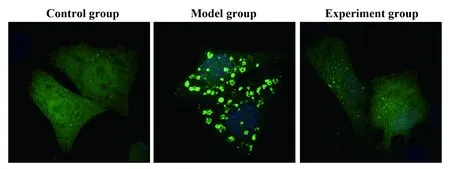
圖3 三組小鼠主動脈平滑肌細胞脂質水平比較Fig.3 Comparison of lipid level of aortic smooth muscle cells in control group and experiment group
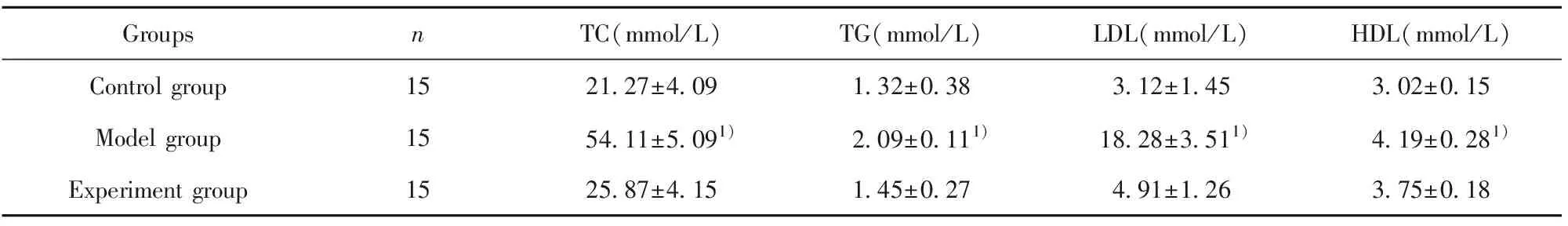
GroupsnTC(mmol/L)TG(mmol/L)LDL(mmol/L)HDL(mmol/L)Control group 1521.27±4.091.32±0.383.12±1.453.02±0.15Model group1554.11±5.091)2.09±0.111)18.28±3.511)4.19±0.281)Experiment group1525.87±4.151.45±0.274.91±1.263.75±0.18
Note:1)P<0.05 vs the control group and experiment group.
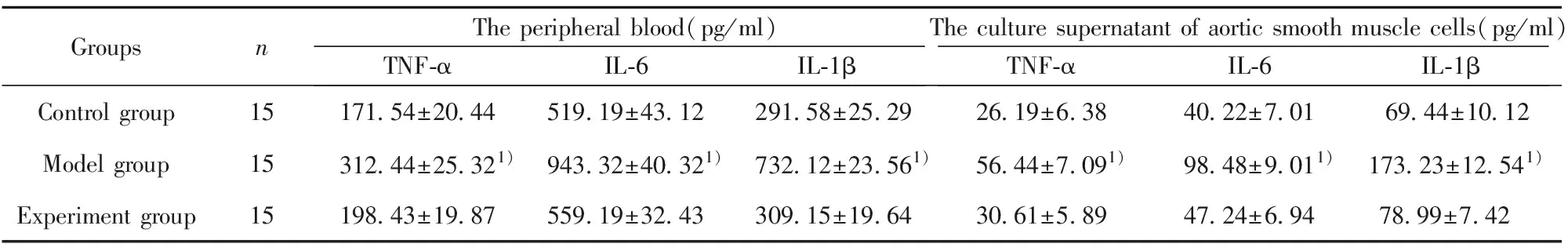
GroupsnThe peripheral blood(pg/ml)TNF-αIL-6IL-1βThe culture supernatant of aortic smooth muscle cells(pg/ml)TNF-αIL-6IL-1βControl group 15171.54±20.44519.19±43.12291.58±25.2926.19±6.3840.22±7.0169.44±10.12Model group15312.44±25.321)943.32±40.321)732.12±23.561)56.44±7.091)98.48±9.011)173.23±12.541)Experiment group15198.43±19.87559.19±32.43309.15±19.6430.61±5.8947.24±6.9478.99±7.42
Note:1)P<0.05 vs the control group and experiment group.
3 討論
自噬是來源于內質網的無核糖體附著區的雙層膜,包裹部分胞質和細胞內需要降解的細胞器、蛋白質、受損傷的細胞結構等形成自噬體,然后與溶酶體融合形成自噬溶酶體,降解其所包裹的內容物,以實現細胞本身的代謝需要和某些細胞器的更新的生物學過程。目前研究顯示自噬在許多人類疾病中發揮著重要作用,包括神經退行性疾病、腫瘤和衰老等[10,11]。研究也發現自噬在動脈粥樣硬化過程中起著重要作用[6]。研究發現離體的血管平滑肌細胞、巨噬細胞和內皮細胞受到外界刺激后,會促進動脈粥樣硬化的發生,而在這個過程中,細胞中會出現泛素化和包涵體聚集等不同程度的自噬現象[12]。此外,在動脈粥樣硬化的中晚期階段,平滑肌細胞的自噬過程將會加速纖維帽變薄,從而促使斑塊向不穩定方向發展[13]。但是隨著研究的不斷深入,自噬可能在預防動脈粥樣硬化發生過程中發揮正面角色。動脈脂質積累和泡沫化細胞形成是動脈粥樣硬化的關鍵,通過促進自噬可以顯著清除細胞內脂質水平,進而達到緩解動脈粥樣硬化的目的。
本研究首先發現注射雷帕霉素后從病理角度而言,其可以顯著緩解動脈粥樣硬化的程度,表現為動脈血管周圍脂質減少、泡沫化細胞減少,血管內膜相對完整,說明促進自噬的確對動脈粥樣硬化有治療效果。本研究從主動脈平滑肌細胞著手,研究發現雷帕霉素可以顯著提高主動脈平滑肌細胞的自噬水平,表現為細胞自噬膜泡。同時我們發現雷帕霉素處理后血管平滑肌細胞內脂質水平明顯減少。而目前已經有研究發現ox-LDL誘導臍靜脈內皮細胞,被吸收后的ox-LDL可通過自噬-溶酶體途徑降解。本研究結果再次證明促進自噬可促進主動脈平滑肌細胞將胞內大量的脂質降解。血管平滑肌細胞在動脈粥樣硬化小鼠中會處于慢性炎癥狀態,進而釋放炎癥因子,加劇動脈粥樣硬化的發生。我們的研究發現雷帕霉素處理后無論小鼠外周血還是平滑肌細胞培養上清中炎癥因子的水平均顯著下調,說明雷帕霉素誘導細胞自噬后炎癥水平得到了顯著抑制。而炎癥因子水平降低,對緩解動脈粥樣硬化具有重要意義。
綜上所述,雷帕霉素可顯著促進細胞自噬,促進主動脈平滑肌細胞加速脂質代謝,進而降低主動脈平滑肌細胞炎癥水平,緩解了動脈粥樣硬化疾病的進展。

