胰激肽原酶聯合西洛他唑與α-硫辛酸治療糖尿病周圍神經病變的臨床研究
糖尿病周圍神經病變(diabetic peripheral neuropathy,DPN)是糖尿病常見的并發癥,主要癥狀是疼痛、感覺減退等,其發病率呈升高趨勢,據統計,DPN發病率高達75.1%[1]。該病早期癥狀較隱匿,且呈進行性發展,其致死率和致殘率較高,控制不及時可發展為糖尿病足潰瘍,嚴重時導致截肢,降低病人生活質量[2]。目前胰激肽原酶和西洛他唑均是臨床治療DPN的常用藥物,能有效抑制血小板聚集,增加毛細血管通透性,改善神經狀況[3]。近年來醫學界對DPN發病機制認識不斷加深,有研究認為氧化應激反應在DPN發病中發揮關鍵性作用[4]。α-硫辛酸屬于抗氧化劑,可清除氧自由基,抑制脂質過氧化反應,加快神經傳導速度,從而改善臨床癥狀[5]。本研究在胰激肽原酶聯合西洛他唑基礎上加用α-硫辛酸治療DPN,觀察其對病人血清丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)水平和神經電生理的影響。
1 資料與方法
1.1 臨床資料 選取2016年5月—2017年7月我院收治的DPN病人114例作為研究對象,按照隨機數字表法分為觀察組和對照組。觀察組57例,男32例,女25例;年齡36~65(53.87±8.41)歲;糖尿病病程4~12(8.65±2.11)年;體質指數21~29(25.32±2.14)kg/m2;合并高血壓14例,冠心病9例,高脂血癥7例。對照組57例,男34例,女23例;年齡35~67(53.79±8.36)歲;糖尿病病程5~13(8.57±2.14)年;體質指數20~28(25.39±2.15)kg/m2;合并高血壓16例,冠心病11例,高脂血癥9例。兩組臨床資料比較,差異無統計學意義(P>0.05)。本研究經醫院倫理委員會批準,病人均知情同意。
1.2 納入與排除標準
1.2.1 納入標準 符合《中國2型糖尿病防治指南》[6]關于DPN診斷標準;年齡30~70歲;依從性好,配合本研究者。
1.2.2 排除標準 繼發性或妊娠期糖尿病;合并嚴重肝、腎功能異常;對本研究使用藥物過敏;合并惡性腫瘤;嚴重尿路或全身感染;自身有傳染性或免疫系統疾病;合并其他周圍神經病變;妊娠期或哺乳期女性;凝血功能障礙或有出血傾向。
1.3 研究方法 兩組均給予常規治療,包括控制血糖、調節血壓、降低血脂,同時給予飲食和運動指導。對照組:給予胰激肽原酶(規格:每片40 U,批準文號:國藥準字H20056124,濟南維爾康生化制藥有限公司生產)聯合西洛他唑(規格:每片50 mg,批準文號:國藥準字H10960014,浙江大冢制藥有限公司生產)治療。胰激肽原酶,每次120 U,每日3次口服;西洛他唑,每次100 mg,每日2次口服,治療4周。
觀察組:在對照組基礎上聯合α-硫辛酸(規格:每支20 mL,批準文號:國藥準字H20056403,上海現代哈森藥業有限公司生產)治療。將20 mL α-硫辛酸加入250 mL 0.9%氯化鈉溶液靜脈輸注,每日1次,治療4周。
1.4 觀察指標
1.4.1 神經病變癥狀 分別于治療前后采用神經病變主覺癥狀問卷(TSS)評價,包含感覺異常、疼痛、麻木、灼熱感4項,按照癥狀正常、輕度、中度、重度依次計0分、1分、2分、3分,分值越高提示病人該項癥狀越嚴重。
1.4.2 臨床療效 根據臨床癥狀判定,顯效:疼痛、麻木等癥狀明顯改善,腱、膝反射恢復正常,神經傳導速度恢復至正常水平;有效:疼痛、麻木等癥狀有所改善,腱、膝反射部分恢復,神經傳導速度有所增加;無效;未達到上述判定標準。
1.4.3 血清MDA、SOD水平 分別于治療前后檢測病人MDA、SOD水平,抽取空腹肘靜脈血5 mL,以3 000 r/min離心,分離血清后備用,分別采用硫代巴比妥酸法、黃嘌呤氧化酶法檢測,操作時遵循試劑盒說明書,試劑盒購自生物工程(上海)股份有限公司。
1.4.4 神經電生理 分別于治療前后采用神經肌電圖儀(DISA2000型)測量病人正中神經、腓總神經感覺傳導速度(sensory conduction velocity,SNCV)和運動傳導速度(motor conduction velocity,MNCV)。
2 結 果
2.1 兩組治療前后神經病變癥狀比較 治療前,兩組感覺異常、疼痛、麻木、灼熱感評分比較,差異無統計學意義(P>0.05);治療后,兩組感覺異常、疼痛、麻木、灼熱感評分顯著低于治療前(P<0.05),且觀察組低于對照組(P<0.05)。詳見表1。
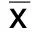

組別例數 感覺異常 治療前治療后 疼痛 治療前治療后 麻木 治療前治療后 灼熱感 治療前治療后觀察組572.14±0.230.98±0.151)1.39±0.280.69±0.141)1.53±0.340.94±0.211)1.43±0.250.82±0.191)對照組572.18±0.201.24±0.161)1.41±0.270.97±0.151)1.61±0.321.23±0.241)1.46±0.261.03±0.221)t值-0.991-8.950-0.388-10.303-1.294-6.866-0.628-5.454P 0.324 0.006 0.699 0.000 0.198 0.009 0.531 0.012
與同組治療前比較,1)P<0.05
2.2 兩組臨床療效比較 觀察組總有效率顯著高于對照組(P<0.05)。詳見表2。

表2 兩組臨床療效比較 例(%)
注:兩組總有效率比較,χ2=4.222,P=0.040
2.3 兩組治療前后MDA和SOD水平比較 治療前,兩組MDA和SOD水平比較,差異無統計學意義(P>0.05);治療后,兩組MDA水平低于治療前(P<0.05),且觀察組低于對照組(P<0.05),兩組SOD水平高于治療前(P<0.05),且觀察組高于對照組(P<0.05)。詳見表3。
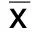

組別例數 MDA(nmol/L) 治療前治療后t值P SOD(U/mL) 治療前治療后t值P觀察組576.38±1.234.59±1.128.1240.00671.39±12.5689.67±14.41-7.2200.009對照組576.45±1.365.37±1.284.3660.01270.96±12.6283.50±13.24-5.1760.007t值-0.288-3.4620.1822.380P 0.774 0.0160.8560.019
2.4 兩組神經電生理比較 治療前,兩組正中神經、腓總神經SNCV和MNCV比較,差異無統計學意義(P>0.05);治療后,兩組正中神經、腓總神經SNCV和MNCV高于治療前(P<0.05),且觀察組高于對照組(P<0.05)。詳見表4。
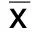

組別例數時間 正中神經 SNCVMNCV 腓總神經 SNCVMNCV觀察組57治療前36.59±1.5243.68±2.1134.28±1.3737.92±1.44治療后48.62±2.141)55.67±3.241)45.43±2.191)48.78±2.361)t值-34.601-23.412-32.588-29.657P 0.000 0.000 0.000 0.000對照組57治療前36.74±1.4343.75±2.3234.46±1.3537.85±1.53治療后43.78±1.6549.71±2.3938.79±1.5443.74±1.69t值-24.343-13.509-15.963-19.506P 0.000 0.000 0.000 0.000
與對照組治療后比較,1)P<0.05
3 討 論
DPN在臨床中較常見,相較于糖尿病其他并發癥,其發生率明顯較高,且癥狀出現早,累及周圍和中樞神經,尤其是感覺神經,對病人生活質量影響較大[7]。該病發病機制較復雜,多認為與蛋白質代謝、遺傳、自身免疫功能及神經生長因子減少等因素有關[8]。目前普遍認為高血糖是重要病理基礎,機體長期處于高血糖狀態,刺激多元醇代謝途徑并使其產生亢奮,激活醛糖還原酶,并將體內葡萄糖轉化為山梨醇,從而提高細胞內滲透壓,導致水電解質平衡紊亂,進而損傷細胞,最終誘發神經細胞變性[9]。有研究證實,氧化應激與DPN發生相關,通過損傷微血管影響神經循環,并減少神經血流灌注,導致腦組織缺氧、缺血[10]。氧化應激在高血糖機體內反應增強,引起氧化機制失衡,造成神經組織毒性反應,促使神經內膜毛細血管內皮細胞增生,引起管腔狹窄,加之糖尿病病人血液黏度高,易發生血流障礙,從而引起神經營養障礙,進而產生神經病變[11]。
MDA和SOD是常見的應激反應指標,前者是脂質過氧化反應產物,具有細胞毒性,可有效反映機體脂質過氧化水平[12]。后者可清除活性氧自由基,可反映機體抗氧化應激能力。因而合理調節MDA、SOD水平對抑制DPN病人應激反應具有重要意義。
目前胰激肽原酶和西洛他唑均是臨床治療DPN的常用藥物,前者能有效激活胰激肽原酶-激肽系統,促使激肽水平升高,通過激活纖溶酶原,促進前列腺素合成,從而降低血液黏稠度,抑制血小板聚集和血栓形成[13]。該藥可直接作用于血管平滑肌,擴張毛細血管,改善微循環[14]。西洛他唑屬于磷酸二酯酶抑制劑,可抑制血管平滑肌內磷酸二酯酶活性,并提高環磷腺苷水平,抑制血小板聚集,擴張血管平滑肌細胞,促使周圍神經微循環灌注量增加,改善神經營養狀況,防止血管阻塞,提高神經傳導速度[15]。此外其能清除機體內氧自由基,改善血管內皮功能,其半衰期長達12 h,通過持續作用于機體從而改善臨床癥狀[16]。兩種藥物聯合可提高治療效果,但不能有效抑制氧化應激反應。α-硫辛酸屬于強抗氧化劑,進入機體內可轉化為二氫硫辛酸,清除活性氧和自由基,并可促使谷胱甘肽、維生素等再生,從而維持機體抗氧化水平,進而減輕脂質過氧化[17]。其可抑制氧化應激反應,通過防止神經細胞凋亡,從而恢復神經病變,提高神經傳導速度[18]。
有研究表明,在胰激肽原酶聯合西洛他唑基礎上加用α-硫辛酸可改善神經病變癥狀[19]。本研究結果顯示:觀察組感覺異常、疼痛、麻木、灼熱感評分優于對照組,與上述研究結果相似,提示胰激肽原酶聯合西洛他唑與α-硫辛酸治療可有效改善病人神經病變癥狀,分析原因是三者聯合使用可降低血液黏稠度,抑制血栓形成,增加神經微循環灌注血流量,并改善神經營養狀況,從而改善臨床癥狀。有研究表明,采用α-硫辛酸可有效抑制DPN病人氧化應激反應[20]。本研究結果顯示:觀察組MDA、SOD水平優于對照組,提示三者聯合使用可有效改善MDA、SOD水平,與上述研究結果相似,提示三者聯合使用能改善病人氧化應激水平。
分析原因是西洛他唑與α-硫辛酸均能有效清除機體內活性氧自由基,減輕脂質過氧化反應,從而改善氧化應激反應。本研究進一步檢測神經電生理情況,結果發現,觀察組正中神經、腓總神經SNCV和MNCV優于對照組,提示三者聯合使用可有效改善神經電生理狀況。分析原因是α-硫辛酸、西洛他唑、胰激肽原酶聯用可改善神經微循環,保證神經營養供給,清除機體氧自由基,抑制脂質過氧化反應,改善神經病變癥狀,從而提高神經傳導速度。觀察組總有效率優于對照組,提示三者聯合使用可提高臨床治療效果。
綜上所述,在胰激肽原酶聯合西洛他唑基礎上加用α-硫辛酸治療DPN,可有效病人改善神經病變癥狀,血清MDA、SOD水平,提高神經傳導速度和臨床療效。但由于本研究未觀察遠期療效,存在一定局限性,有待今后進行深入探討和研究。

