T3對缺氧/復氧致小鼠心肌細胞凋亡的影響
廖小婷 曾 彬 劉 磊
急性缺氧和復氧損傷是一種常見的環境應激狀態,可造成一系列病理生理過程,包括急性氧化應激損傷、線粒體功能障礙和炎癥[1,2]。發生急性心肌梗死后,常并發嚴重的缺血再灌注損傷。越來越多的研究證明甲狀腺激素對胚胎心肌的發育至關重要,且成年后甲狀腺激素通過激活發育基因編程來調控心臟修復或再生[3,4]。本研究采用體外培養乳小鼠原代心肌細胞,進行缺氧及缺氧/復氧損傷來模擬體內缺血及缺血再灌注損傷,并對缺氧復氧細胞進行T3預處理,通過形態學觀察、流式細胞技術、JC-1免疫熒光染色、Western blot法檢測細胞凋亡,研究不同缺氧時間及缺氧/復氧對心肌細胞的損害程度,以及運用甲狀腺素T3對心肌細胞的影響。
材料與方法
1.實驗材料:(1)動物:1~2天齡的新生昆明乳鼠,雌雄不限,由湖北省實驗動物中心提供。(2)試劑:DMEM-F12培養基(美國Hyclone 公司),胎牛血清(美國Gibico 公司),胰酶(美國Beyontime 公司),膠原酶Ⅱ(美國Sigma 公司),PBS液,青-鏈霉素抗生素(杭州吉諾生物醫藥技術有限公司),Annexin V-FITC細胞凋亡試劑盒(天津三箭生物技術有限公司),JC-1試劑盒(北京索萊寶科技公司),兔抗鼠抗磷酸化Akt多抗(美國CST公司),兔抗鼠抗磷酸化PI3K多抗(英國Abcam公司),辣根過氧化物酶(HRP)標記的羊抗兔二抗(美國Aspen公司)。
2.心肌細胞培養:采用改良的兩步法分離培養心肌細胞[5]。取1~2天的新生乳小鼠,取出心臟,置于預冷PBS緩沖液中清洗2~3遍,修剪心臟,減去多余的血管、心房及心外膜組織。在0.125%胰酶中將心臟稍稍剪開但不剪碎,將心臟組織吸入15ml離心管中,加入0.125%胰酶10ml靜置,4℃過夜(10~12h)。第2天,吸出上清液,加入含0.035%膠原酶Ⅱ的消化液6ml,置于37℃水浴輕輕振搖3~5min,待液體變混濁后及停止消化,重復消化6~7次。將收集的上清液以1000r/min離心10min,棄上清,加入適量含15%胎牛血清的完全培養液(1%青-鏈霉素抗生素)重懸細胞,接種于10cm培養皿中進行差速貼壁1h去除成纖維細胞,將細胞懸液種于35mm培養皿中,細胞密度為1×106,培養24h后,用倒置顯微鏡觀察。
3.心肌細胞缺氧及缺氧/復氧模型的建立:模擬心肌缺血損傷,細胞貼壁完全且搏動良好后,吸去培養液,加入2ml不含血清的DMEM無糖培養基,置于三氣培養箱(94%N2、5%CO2、1%O2,37℃)中培養。心肌細胞缺氧/復氧模型的建立:模擬心肌缺氧/復氧損傷,細胞貼壁完全且搏動良好后,吸去培養液,加入2ml不含血清的DMEM無糖培養基,置于三氣培養箱(94%N2、5%CO2、1%O2,37℃)中培養,后棄去培養液,加入含15%胎牛血清的培養液2ml,放入培養箱(37℃、5%CO2)中復氧,即完成缺氧/復氧過程。T3預處理:心肌細胞缺氧/復氧處理前,細胞培養液中加入20μmol/L T3孵育24h,缺氧時,換用含20μmol/L T3的2ml不含血清的DMEM無糖培養基,復氧時加入含20μmol/L T3的2ml完全培養液。
4.實驗分組:分離的原代心肌細胞培養48h后,心肌細細胞缺氧及缺氧/復氧模型建立分組:正常對照(control)組;缺氧2h(H2)組;缺氧4h(H4)組;缺氧6h(H6)組;缺氧8h(H8)組;缺氧4h/復氧2h(H4/R2)組。T3藥物效應分組:正常對照(control)組;缺氧5h復氧2h(H/R)組;T3預處理+缺氧/復氧(T3+H/R)組。
5.心肌細胞狀態及搏動頻率觀察:將完成缺氧、缺氧/復氧及正常培養細胞進行境下觀察,觀察細胞狀態,搏動強度并計數細胞搏動頻率。
6.流式細胞分析:細胞進行不同處理后,用0.25%胰酶1ml洗滌2~3min,收集細胞懸浮液及培養液進行流式細胞儀檢測,以Annexin V-FITC及PI雙染分析細胞凋亡情況。每組用胰酶消化細胞后,將細胞濃度調整為106/L的細胞懸液,每組加入195μl的FITC結合液,再加入5μl FITC染液,室溫避光孵育15min,后每組加入5μl碘化丙啶(PI)染液,室溫避光孵育5min,在流式細胞儀(美國BD公司)上進行細胞凋亡分析。左下象限:活細胞比例,Annexin V陰性-PI陰性的細胞;右下象限:凋亡早期細胞比例,Annexin V陽性-PI陰性的細胞;右上象限:晚期凋亡細胞比例,Annexin V陽性-PI陽性的細胞;左上象限:操作過于劇烈而發生機械損傷的細胞,Annexin V陰性-PI陽性的細胞。凋亡細胞的比例即為凋亡早期細胞比例+凋亡晚期細胞比例。
7.線粒體膜電位檢測:對于control組、H/R組及T3+H/R組,細胞進行相應處理后,吸去培養液,用PBS洗3遍,加入1ml JC-1染色工作液,37℃避光孵育20min,后棄上清,用JC-1染色緩沖液(1×)洗滌3次,吸去多余的染色工作液,加入1ml含胎牛血清的完全培養液,于倒置熒光顯微鏡下觀察拍照。檢測 JC-1 單體時可以把激發光設置為 490nm,發射光設置為 530nm;檢測 JC-1 聚合物時,可以把激發光設置為 525nm,發射光設置為 590nm。
8.Western blot法檢測凋亡蛋白表達:取control組、H/R組及T3+H/R組細胞,加入裂解液進行蛋白提純,采用BCA法進行蛋白定量,SDS-PAGE電泳,轉膜,5%脫脂牛奶室溫封閉1h,然后用兔抗鼠cleaved caspase-3(稀釋度 1∶500,英國Abcam公司,貨號4060)以及兔抗鼠Bax(稀釋度 1∶2000,美國CST公司,貨號ab18250)抗體4℃孵育過夜。次日用辣根過氧化物酶(HRP)標記的羊抗兔二抗(稀釋度1∶10000,美國Aspen公司,貨號AS1107)室溫孵育1h,化學發光法(ECL)顯影。采用凝膠成像系統(美國UVP公司)進行分析,以目的蛋白條帶灰度值與β-actin條帶灰度值的比值反映Bax 和cleaved caspase-3的表達。
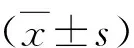
結 果
1.顯微鏡下觀察細胞形態:剛開始接種的心肌細胞成球形,懸浮于培養液中,12h后觀察已有心肌細胞貼壁生長,24h后,大部分細胞已經貼壁,呈三角形或不規則的星行,大部分細胞開始搏動,搏動頻率不一;48h后觀察心肌細胞全部貼壁,并伸出偽足,相互交接成網,并形成單層和放射狀排列的細胞簇,且心肌細胞搏動同步化,搏動頻率一致,約100次/分左右。心肌細胞經過缺氧處理后細胞搏動能力減弱,搏動頻率降低,計數不同處理組細胞的搏動頻率(表1),與正常培養細胞比較,缺氧損傷導致心肌細胞搏動能力減弱,搏動頻率降低;缺氧時間越長,心肌細胞搏動頻率越低(P<0.05)。
2.缺氧及缺氧/復氧對心室肌細胞凋亡的影響:采用流式細胞儀檢測心肌細胞凋亡率,缺氧損傷后,心肌細胞凋亡率明顯增加,隨著缺氧時間的延長,細胞凋亡率逐漸增加;且與單純缺氧損傷比較,缺氧/復氧損傷顯著增加細胞凋亡率(圖1),各組心室肌細胞凋亡率見表1。

表1 各組細胞搏動頻率、凋亡率比較

圖1 不同缺氧時間及缺氧/復氧對心肌細胞凋亡的影響
3.T3減少缺氧/復氧致心室肌細胞凋亡:確定缺氧/復氧模型對心肌細胞損傷更大后,采用缺氧/復氧損傷模型檢測T3對心肌細胞的影響,對正常對照組、缺氧/復氧組、T3+缺氧/復氧組進行流式細胞分析發現與缺氧/復氧組比較,T3可明顯降低細胞凋亡率(P<0.05,n=3)。Western blot法檢測可見與正常培養細胞比較,缺氧/復氧后心肌細胞Bax、caspase-3蛋白表達顯著增加(圖2),T3預處理可降低缺氧/復氧心肌細胞Bax、caspase-3蛋白表達(P<0.05,n=3)。

圖2 T3對缺氧/復氧致心室肌細胞凋亡的影響A.流式細胞術檢測細胞凋亡率;B.不同處理組心肌細胞凋亡率柱狀圖;C.Western blot法檢測凋亡蛋白Bax、caspase-3表達;D.不同組心肌細胞caspase-3/β-actin比例;E.不同組心肌細胞Bax/β-actin比例。與正常對照組比較,*P=0.000;與缺氧/復氧+T3組比較,#P<0.01,##P=0.000
4.T3減少心室肌細胞缺氧/復氧所致線粒體膜電位下降:采用缺氧/復氧損傷模型檢測T3對心肌細胞線的粒體膜電位影響,對正常對照組、缺氧/復氧組、T3+缺氧/復氧組進行JC-1染色,在倒置熒光顯微鏡下觀察細胞線粒體紅綠比,如圖3所示,正常培養細胞經JC-1染色,境下多為發紅光線粒體,而缺氧/復氧損傷后發紅光線粒體減少,發綠光線粒體增加,紅綠比降低,說明缺氧/復氧損傷心室肌細胞線粒體,造成線粒體膜電位降低。經過T3預處理的心肌細胞,境下可見發綠光的線粒體減少,線粒體紅綠比增加。

圖3 熒光顯微鏡下T3對缺氧/復氧致心室肌細胞線粒體膜電位影響(JC-1染色,×200)
討 論
隨著細胞與分子水平研究的不斷深入,心肌細胞原代培養已經成為心血管研究的重要方法和計數基礎,與大鼠心肌細胞比較,小鼠的心肌細胞較脆弱易損,在消化過程中會由于消化時間和力度造成細胞損傷,致心肌細胞貼壁不佳甚至幾乎不貼壁的現象[5]。因此小鼠心肌細胞原代培養時對于消化要求更高,本實驗采用改良的兩步法分離培養心肌細胞,與傳統的胰酶消化或混合酶(胰酶+混合酶)消化比較,這種方法得到的心肌細胞成活率更高,純度更好[3,5,6]。
本實驗采用三氣培養箱進行心肌細胞缺氧環境,1%O2常用于心肌細胞體外缺氧模型,因此本實驗也采用了1%O2誘導細胞缺氧環境。表1可見,隨著缺氧時間的不斷增加,心肌細胞搏動頻率逐漸降低。筆者發現,當心肌細胞缺氧時間達到8h時,細胞存活率顯著降低,大量細胞失去活性,流式凋亡檢測也證明了當缺氧8h時細胞凋亡率高達60%左右,有研究顯示8h缺氧處理誘導的心肌細胞變化足夠用作細胞相關研究[7]。因此本實驗設置細胞缺氧時間梯度最大值為8h。在進行不同缺氧時間處理的基礎上,筆者對細胞進行了缺氧/復氧損傷,與缺氧4h比較,缺氧/復氧對心肌細胞造成的損傷更大,細胞凋亡率更高,說明復氧進一步加重細胞損傷。研究證明細胞凋亡是心肌再灌注損傷的特征之一,再灌注損傷可加速不可逆轉的細胞凋亡[8~10]。且有研究顯示,細胞缺氧后復氧造成的進一步損傷在1h后趨于平緩[11]。在本實驗中,缺氧6h時,細胞損傷率加大,因此筆者采用缺氧5h復氧2h來進行后續實驗檢測。
甲狀腺激素T3是人體重要的激素,可調節機體器官的生長發育,研究發現甲狀腺激素可以增強左心室收縮功能,改善心室舒張功能及減少外周血管阻力[12,13]。且急性心肌梗死、心力衰竭等都伴隨著體內甲狀腺激素水平的改變[14,15]。甲狀腺激素可調控心肌收縮及鈣處理蛋白表達,離子通道激活和交感神經興奮,既往研究顯示急性心肌梗死后運用低劑量甲狀腺素治療可以增強心室收縮,減少心肌細胞凋亡,從而改善梗死后心功能[15~17]。本實驗中T3預處理可降低缺氧/復氧致心室肌細胞凋亡,并減少凋亡蛋白Bax和caspase-3的表達,從而發揮心肌細胞保護作用。心肌細胞凋亡是心肌缺血再灌注損傷的重要機制,其中線粒體損傷是心肌細胞凋亡和心臟收縮功能障礙的重要原因[18]。在缺血再灌注損傷過程中,過量的活性氧導致線粒體通透性轉換孔的開放,然后使Bax蛋白向線粒體外膜易位,從而觸發線粒體凋亡途徑導致細胞凋亡[18~20]。本實驗通過JC-1染色檢測心肌細胞線粒體,發現缺氧/復氧損傷可降低線粒體膜電位,說明缺氧/復氧損傷了心肌細線粒體,而T3可以恢復缺氧/復氧損傷造成的線粒體膜電位降低,保護心肌細胞線粒體,減少心肌細胞凋亡。
綜上所述,體外培養心肌細胞可以更好地進行分子機制的研究,缺氧/復氧模型的建立可以模擬體內心肌缺血再灌注損傷。缺氧/復氧可加重心肌細胞損傷,降低線粒體膜電位,甲狀腺素T3可以增加線粒體膜電位,減少細胞凋亡率,保護缺氧/復氧所致心肌細胞損傷。

