2型糖尿病腎病患者腎血流阻力指數與血清脂蛋白a對腎功能進展的預測
趙 凡 丁國華
糖尿病腎病(diabetic kidney disease,DKD)是糖尿病全身微血管病性合并癥之一,也是終末期腎臟病的主要原因。糖尿病腎病病程長,長期監測糖尿病腎病腎功能是否進展及評估疾病進展程度及預后對于控制糖尿病腎病至關重要。目前常用于對DKD早期診斷的指標種類較多,包括腎小球損傷的生物學標志物、腎小管損傷的標志物、炎性指標及現在研究較熱的miRNA與蛋白組學等[1]。然而對DKD疾病進展的長期監測指標較少,臨床上常用預估腎小球濾過率(eGFR)及尿微量白蛋白(MAU)來規律監測DKD腎功能進展。但MAU的檢測結果容易受感染、運動、檢測方法等多因素影響,出現MAU的患者再次復查轉陰的現象也很常見,且很多DKD患者在出現MAU前便已有不同程度的腎損傷[2]。不同患者的血肌酐受多種腎外因素干擾,且年齡、血糖、糖尿病病程及蛋白質攝入等因素均會影響DKD患者的eGFR結果[3]。脂蛋白a[Lp(a)]是眾所周知的心血管危險因子,在心血管的粥樣硬化的評估中有重要意義[4]。但是,Lp(a)在DKD的疾病進展的預測作用目前研究較少。彩色多普勒超聲在糖尿病患者中具有重要價值,其中泌尿系彩超中的常用指標腎血流阻力指數(renal index,RI)可以評估腎血流的灌注情況,可用于DKD的早期診斷[5]。本實驗通過研究RI、Lp(a)和GFR三者之間的關系,探討RI聯合Lp(a)在評估糖尿病腎病腎功能進展及預后的價值。
對象與方法
1.研究對象:回顧性收集2016年6月~2018年6月間在筆者醫院腎內科住院的2型糖尿病腎病患者病例237例,其中男性144例(61.76%),女性93例(39.24%),患者年齡14~75歲。
2.資料收集:①基本資料:性別、初診時年齡及糖尿病病程;②臨床檢驗指標:糖化血紅蛋白、血紅蛋白、血尿酸、Lp(a)、甘油三酯、低密度脂蛋白、24h尿蛋白定量、血白蛋白、血肌酐、尿白蛋白肌酐比值(ACR)、尿α1微球蛋白、尿轉鐵蛋白、β2微球蛋白、尿IgG;③檢查資料:泌尿系彩超結果:雙腎血流阻力指數(本實驗統一由左腎血流阻力指數代替)、左右腎體積;④預估腎小球濾過率(eGFR):由血肌酐估算,使用改良MDRD公式計算。將研究開始第1次入院的檢查結果(包括住院病歷資料、查血結果及檢查資料)設置為基線資料。
3.DKD診斷標準:符合2007年《美國腎臟病預后質量指南(K/DOQI)》的糖尿病腎病診斷標準或2014年版《中國糖尿病腎病防治專家共識》中的診斷標準,包括尿蛋白正常但GFR下降的糖尿病腎病的患者[6]。排除標準:急性或慢性感染、惡性腫瘤性疾病、原發性心肌病、冠心病及長期口服調脂類藥物、腎血管狹窄等病例。
4.分組:(1)根據RI結果將入選的病例分為:①RI升高組:RI>0.7組;②RI正常組:RI≤0.7組。(2)按照基線Lp(a)結果將入選的病例分為:①Lp(a)升高組:Lp(a)≥500mg/L組;②Lp(a)正常組:Lp(a)<500mg/L組兩個亞組。(3)按照基線eGFR結果將入選的病例分為:①eGFR正常組:eGFR≥90ml/(min·1.73m2);②eGFR下降組:eGFR<90ml/(min·1.73m2)兩個亞組。RI及Lp(a)參考值范圍節點的選取根據臨床既往研究的結果及本試驗以Lp(a)300、400、500、600mg/L為節點分組后進行Logistic回歸分析的各臨床參數的風險差異不同及結合基線數據后選取的最適節點,文中不贅述[7]。
5.隨訪研究:自2016年6月開始在筆者醫院規律住院隨訪,對未進入透析前的患者進行隨訪,隨機隨訪病例113例,失訪5例,失訪率4.42%,實際隨訪108例;研究截止于2018年12月,至少每半年隨訪1次。研究終點設置為GFR減半或進入ESRD期。
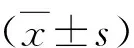
結 果
1.2型DKD患者中eGFR下降的相關危險因素分析:對2型糖尿病腎病患者生化及人口學數據進行單因素Logistic回歸分析,結果顯示,與eGFR下降的相關因素包括年齡、糖尿病病程、24h尿蛋白定量、Hb、Alb、RI、雙腎體積(P<0.05)。將這些因素作為協變量納入Logistic回歸方程進行多因素分析,結果提示糖尿病病程(OR=1.105)、24h尿蛋白定量(OR=1.370)、RI(OR=2.351)是eGFR<90ml/(min·1.73m2)的獨立危險因素(P均<0.05),RI的OR值比24h尿蛋白定量OR值更大,詳見表1。

表1 eGFR下降的相關因素分析(Logistic分析)
2.RI正常組與RI升高組臨床參數比較:兩組患者在Lp(a)、年齡、糖尿病病程、糖尿病分期高血壓患病率、Scr、TG、LDL、eGFR、ACR、雙腎體積比較,差異有統計學意義(P=0.05);兩組比較,RI升高組的患者年齡較正常組高(P=0.000),糖尿病病程更長(P=0.000),集中在CKD5期(49.4%),高血壓患病率更高(88.5% vs 76.7%,P=0.011),血紅蛋白、甘油三酯、低密度脂蛋白、eGFR及雙腎的體積水平偏低(P均<0.05),血肌酐、Lp(a)、ACR水平較高(P均<0.05),其中Lp(a)升高明顯(590.36mg/L vs 365.75mg/L,P=0.000);兩組之間性別比例、24h尿蛋白定量、糖化血紅蛋白、血白蛋白、血尿酸、尿α1微球蛋白、β2微球蛋白、尿轉鐵蛋白、尿IgG比較,差異無統計學意義,詳見表2。
3.RI與各臨床參數之間的相關性分析:通過比較總體數據資料,排除無關變量,進行Pearson分析顯示,RI與Lp(a)(r=0.663,P=0.000)、Scr(r=0.393,P=0.026)、ACR(r=0.222,P=0.043)呈正相關;RI與LDL(r=-0.26,P=0.021)、eGFR(r=-0.273,P=0.016)呈負相關。RI與24h尿蛋白定量、糖化血紅蛋白、血紅蛋白、血白蛋白、血尿酸、甘油三酯、尿α1微球蛋白、尿轉鐵蛋白、尿β2微球蛋白、尿IgG等比較差異無統計學意義,詳見表3。
4.RI升高的相關危險因素分析:以上通過對eGFR<90ml/(min·1.73m2)影響因素的Logistic回歸分析發現,RI是使腎功能下降的獨立危險因素,且對腎功能的影響較大。故進一步對RI進行Logistic回歸分析從而明確RI升高的獨立危險因素;將單因素分析中與RI升高有關的因素作為協變量納入回歸方程進行多因素分析,結果提示,Lp(a)、年齡、Scr是RI升高的獨立危險因素(P均<0.05),詳見表4。

表2 RI升高組與正常組臨床參數比較

表3 RI與臨床參數的相關性
5.RI并Lp(a)升高組與其余各組間臨床參數比較:(1)對于RI與Lp(a)升高組與Lp(a)升高RI正常組患者臨床參數比較提示RI并Lp(a)升高組糖尿病病程、Scr、β2-微球蛋白較Lp(a)升高RI正常組更高(P均<0.05);eGFR、尿α1微球蛋白、雙腎體積更低(P均<0.05)。(2)對于RI并Lp(a)升高組與RI升高Lp(a)正常組臨床參數比較提示RI并Lp(a)升高組Scr、24h尿蛋白定量、LDL、尿轉鐵蛋白、β2微球蛋白較RI升高Lp(a)正常組更高(P均<0.05);年齡、eGFR、尿α1微球蛋白、Hb、右腎體積更低(P均<0.05)。(3)RI并Lp(a)升高組與其余各組間臨床參數比較提示RI并Lp(a)升高組相較于其他組在eGFR、右腎體積、尿α1微球蛋白水平較低,尿β2微球蛋白水平較高,差異有統計學意義(P<0.05),詳見表5。

表4 RI升高的相關危險因素分析(Logistic分析)

表5 RI升高組與正常組患者Lp(a)升高與正常亞組間臨床參數比較
6.以eGFR為90ml/(min·1.73m2)與60ml/(min·1.73m2)分組后進行Logistic回歸分析進行各組間臨床參數比較:以eGFR為90ml/(min·1.73m2)值分界作為GFR下降組與正常組患者分組后進行Logistic危險因素分析提示糖尿病病程、24h尿蛋白定量、Hb、HbA1c、RI、Lp(a)比較,差異有統計學意義(P均<0.05);而以eGFR為60ml/(min·1.73m2)值分界作為GFR下降組與正常組的患者比較,DKD的臨床參數比較差異無統計學意義。以eGFR為90ml/(min·1.73m2)的分組,當開始GFR下降低于90ml/(min·1.73m2)時,即剛進入慢性腎臟病期時控制高Lp(a)血癥與RI的臨床意義較高,詳見表6。

表6 不同eGFR分組的臨床指標比較 (Logistic分析)
7.RI并Lp(a)升高對DN患者腎功能預后的影響:對108例患者的預后進行住院隨訪,以開始隨訪至進入研究終點的時間設置為生存時間,將是否進入研究終點設置為因變量,通過Kaplan-Meier生存分析比較RI合并Lp(a)升高組與非雙升組[RI或Lp(a)未升高組]的糖尿病腎病患者的腎功能預后情況,結果提示隨訪67例非雙升組DN患者的腎臟中位生存期為21個月,41例RI合并Lp(a)升高組DN患者腎臟中位生存期為16個月;共有54例患者進入終點,包括腎功能翻倍的患者36例,進入ESRD的患者18例;結果提示RI合并Lp(a)升高的患者組腎臟生存率低于非雙升組(Log-rank檢驗,P=0.000),見圖1。

圖1 2型糖尿病腎病患者RI并Lp(a)升高對腎功能預后影響的生存曲線(Kaplan-Meier生存分析)
討 論
DKD是糖尿病的嚴重并發癥之一,DKD 的發生與慢性高血糖所致的糖代謝異常、脂代謝異常、腎臟血流動力學改變、氧化應激和遺傳等因素有關[8]。DKD的臨床特點是尿白蛋白排泄率(UAER)升高,血壓(BP)升高,腎功能持續下降。在DKD的自然病程中,持續性蛋白尿發病后腎臟平均存活時間為5~7年[9]。盡管有更好的治療,包括血管緊張素轉換酶抑制劑(ACEI)血管緊張素受體拮抗劑(ARB)類藥物和透析,但是DKD仍然是終末期腎病(ESRD)的主要原因[10]。對于糖尿病腎病患者的管理,腎功能的進展軌跡比慢性腎病的發病階段更為重要[11]。在目前的前瞻性研究中很少有生物學標志物作為預測DKD進展過程的指標優于蛋白尿和eGFR[12]。彩色多普勒血流顯像作為一種非侵入性的檢測腎臟血流動力學變化的方法,可以通過直接檢測腎臟血流反映腎血管病變的RI值,來提供一種簡便又可靠的反映腎功能進展的方法。有文獻表明,在162例的前瞻性試驗中,與蛋白尿>1g/d或肌酐清除率<40ml/(min·1.73m2)比較,腎RI在指示腎功能惡化或死亡的優勢方面更具有優勢,且RI和蛋白尿>1g/d為獨立變量,提示進展[13]。本研究顯示,RI水平與蛋白尿及其他傳統危險因素無關,可獨立預測腎臟的進展;RI可提供對DN腎功能進展更高的預測價值(表1)。
有研究指出,RI可反映腎動脈阻力狀態[14]。但RI受系統血流動力學的影響,并不是單純受腎血管阻力的影響[15]。RI不是血流阻力的及時變量,但RI卻至少能反映腎臟的血流阻力動態變化趨勢。還有觀點表明,RI和腎小動脈硬化相關[16]。RI與動脈粥樣硬化標志物脈搏波傳播速度(PWV)相關,在糖尿病腎病中增加程度更大[17]。因此,通過RI無創評估腎血管阻力的變化可能為評估動脈粥樣硬化和糖尿病腎病以及腎功能提供重要信息。但臨床上對PWV的檢測沒有普及,臨床上是否還有其他指標來反映血管動脈粥樣硬化在糖尿病腎病中的影響,且臨床指標又是否與RI和腎功能改變獨立相關,相關的研究并不多。Lp(a)是公認的心血管危險因子,又是動脈粥樣硬化重要的檢測指標[18]。有研究表明,血清Lp(a)水平與2型糖尿病腎病發病呈正相關[19]。
糖尿病可以改變脂質和脂蛋白的利用,是動脈粥樣硬化發生的重要危險因素之一,最終導致糖尿病誘導的動脈粥樣硬化性血脂異常[20]。并且糖尿病患者病死率的增加主要發生在DKD患者,主要死因是由于心血管疾病(CVD)[21,22]。即使是透析患者,高Lp(a)水平也可預測不良的心血管事件[23]。單純監測腎功能進展的指標對DKD患者心血管事件的預測不足,無法預估患者的死亡風險。
對于糖尿病腎病與Lp(a)的關系而言,有回顧性研究指出:血液中高Lp(a)水平與糖尿病腎病的進展相關[24]。在另一個臨床試驗中,研究者比較了糖尿病腎病組、T2DM組與正常空白對照組患者的血脂的改變,與對照組比較,T2DM合并腎病和未合并腎病的患者中,均存在Lp(a)、TC等血脂異常,但并沒有發現T2DM與糖尿病腎病之間Lp(a)的明顯差異,可能與樣本量小有關[25]。本研究中結果顯示Lp(a)與RI有顯著的相關性(P=0.000),在以RI>0.7與否分組后,Lp(a)仍與RI表現顯著相關性(P=0.000),RI并Lp(a)升高組與其余各組間臨床參數比較提示RI并Lp(a)升高組相較于其他組在eGFR、右腎體積、尿α1微球蛋白水平較低,尿β2微球蛋白水平較高,差異有統計學意義(P<0.05)。另外,研究中還發現,對eGFR<90ml/(min·1.73m2)影響因素的Logistic回歸分析提示RI的升高是eGFR<90ml/(min·1.73m2)的獨立危險因素(P均為0.000),風險是正常人的2.907倍,這一結論與國外的研究也是相符的[7]。本研究并未發現Lp(a)升高是糖尿病腎病腎功能下降的獨立危險因素,但是Lp(a)升高是2型糖尿病腎病患者RI升高的獨立危險因素。出現這一現象的原因可能是源于回歸分析中選擇腎功能下降的納入因素時,納入的RI水平改變的影響因素來自于Lp(a),且RI本身對腎功能下降有影響,所以這一結果可能受RI干擾。因此推測Lp(a)和RI的升高可以預測腎臟的損害,Lp(a)及RI加重腎血流的粥樣硬化,增加腎臟血管的狹窄程度,影響腎血流阻力程度,進一步導致腎功能的進展。相關研究顯示,腎小球的毛細血管的阻力增高引起腎小球的高濾過、高灌注、高壓力改變,刺激內皮細胞和系膜細胞分泌各種促纖維化的因子,造成腎小球的硬化,造成腎功能惡化[26]。
另外,本研究還對以eGFR為90ml/(min·1.73m2)與60ml/(min·1.73m2)分組后進行了Logistic回歸分析,而結果提示以eGFR為90ml/(min·1.73m2)患者分組后臨床檢驗參數統計學差異更顯著,說明當開始GFR下降<90ml/(min·1.73m2)時,即剛進入慢性腎臟病期時控制高Lp(a)血癥與RI的臨床意義較高,伴隨蛋白尿加重、粥樣斑塊的形成、腎功能進展后,RI與Lp(a)的控制意義會顯著降低,此時進行降脂脂蛋白a治療效果也會相應下降。
綜上所述,在2型糖尿病腎病中監測RI與Lp(a)對明確糖尿病腎病是否進展具有重要意義。Lp(a)與RI水平升高獨立相關。RI與2型糖尿病腎病腎功能進展獨立相關,RI可作為預測腎功能下降的預測因素;在慢性腎臟病早期控制RI與Lp(a)效果更明顯,有助于減少糖尿病心血管并發癥的風險。但是降Lp(a)治療的必要性與收益需要臨床大規模的實驗來驗證。由于RAS阻斷劑是DN的基礎治療,因此在未來的研究中可以了解RAS阻斷劑是否會影響Lp(a)與RI水平[27]。

