三氮唑類α-葡萄糖苷酶抑制劑研究進展
張子沛,薛婉瑩,熊德彩,吳艷芬
(北京大學醫學部藥學院,北京 100191)
α-葡萄糖苷酶抑制劑(AGIs)是一類重要的口服類2型糖尿病用藥,其通過抑制位于小腸黏膜細胞表面刷狀緣微絨毛上的α-葡萄糖苷酶活性,降低餐后血糖水平[1]。α-葡萄糖苷酶抑制劑與α-葡萄糖苷酶上的活性位點結合,競爭性地抑制底物與酶活性位點接觸。AGIs-糖苷酶復合物之間的親和力常常強于糖底物-糖苷酶復合物。因此,AGIs可以顯著抑制α-葡萄糖苷酶活性,減少攝入體內的淀粉降解為葡萄糖,進而直接降低餐后血糖水平[2]。α-葡萄糖苷酶抑制劑的優勢是作用機制獨特,可用于單獨用藥、聯合用藥,并且不會出現低血糖等副作用[3]。但目前已上市的AGIs藥物僅4種:阿卡波糖、伏格列波糖、米格列醇和乙格列酯[4]。三氮唑是藥物化學研究中重要的結構單元,常見于許多藥物分子和活性分子中,是藥物化學中快速偶聯和結構修飾的有效策略[5]。由于氮原子的強偶極矩,三氮唑可以積極地參與氫鍵形成、偶極-偶極相互作用和范德華力等多種非共價鍵作用。此外,三氮唑類化合物對水解、氧化、還原等條件都有很好的耐受性[6]。因此,三氮唑類化合物在α-葡萄糖苷酶抑制劑的研究中引起了廣泛的關注。近年來,藥物化學家對三氮唑類化合物在α-葡萄糖苷酶抑制劑領域的應用進行了系統深入地研究,得到了許多具有良好α-葡萄糖苷酶抑制活性的化合物。本文將重點介紹近年來,三氮唑類化合物在α-葡萄糖苷酶抑制劑領域的研究,并對其構效關系進行總結。根據其核心結構不同,可將其分為三種類型:糖-1,2,3-三氮唑雜合體,芳基-1,2,3-三氮唑雜合體和1,2,4-三氮唑衍生物。
1 糖-1,2,3-三氮唑雜合體
糖骨架和三氮唑結構融合在糖苷酶抑制劑研究中有很多相關報道。Perion等[7]構建了一系列1,4,5-三取代的1,2,3-三氮唑化合物,其中三氮唑一位和α-甲苷-6-脫氧-D-葡萄糖四位碳偶聯的化合物1表現出對酵母α-葡萄糖苷酶最好的抑制活性(IC50=73 μmol·L-1),是陽性對照阿卡波糖的兩倍(IC50=148 μmol·L-1)。而化合物2的6-脫氧葡萄糖一位替換為β-甲苷時,抑制活性消失。通過延長糖鏈或在三氮唑四位羥甲基上進行糖基化修飾的其他化合物均沒有表現出對α-葡萄糖苷酶的抑制活性。Zhou等[8]將5-芳基-1,2,3-三氮唑和氮雜糖1-野尻霉素雜合合成了3個不同長度連接臂的化合物3。活性評價結果顯示,抑制活性隨鏈長增長而增強,相隔8個碳原子的化合物表現出最強的抑制活性(IC50=1.15 μmol·L-1),活性強于三氮唑修飾前的野尻霉素。而不含氮雜糖結構的1,2,3-三氮唑-甲氧基苯雜合體對α-葡萄糖苷酶沒有抑制活性。Ferreira等[6]合成了一系列4-取代的糖-1,2,3-三氮唑化合物,其中1-環己烯基取代的核糖-三氮唑雜合物4對酵母麥芽糖酶表現出最好的抑制活性(IC50=3.8 μmol·L-1),強于阿卡波糖25倍。當化合物四位是其他取代基團,如苯基、苯氧甲基、乙酯基和1-環己醇基也表現出較好的抑制活性(IC50分別為14.9,5.7,15.1,5.2 μmol·L-1)。研究也發現其他糖型衍生物,如D-木糖、D-半乳糖、D-阿洛糖等抑制活性低于D-核糖衍生物4。在以酵母麥芽糖酶為模型的分子對接研究中,其結合模式和過渡態模擬理論一致。進一步的,作者通過小鼠模型驗證了這系列化合物體內的降糖效果,可能為新型的降糖藥提供潛在的化學結構。在后續的工作中[9],Ferreira在這一系列化合物糖環的三位引入苯基,得到了一系列新的1,2,3-三氮唑糖衍生物5,其中只有1-環乙烯基取代(IC50=247.4 μmol·L-1)和苯基取代(IC50=119.5 μmol·L-1)的化合物表現出與阿卡波糖相當的抑制活性,而其他基團取代的化合物均未表現出明顯的抑制活性。這類化合物的抑制活性較未引入苯基時有一定幅度的減弱,因此在糖環上引入苯基并非成功的修飾策略。Ajish等[10]通過鈀催化和click反應合成了一系列亞烷基環戊烯糖-1,2,3-三氮唑雜合體,在活性評價中,半乳糖雜合體6表現出對α-葡萄糖苷酶最好的抑制活性(IC50=0.075 μmol·L-1)。其他糖型的化合物如葡萄糖、甘露糖型雜合體則只表現出中等或較差的抑制活性。另外,與亞烷基相連的環己基也是優勢基團,當替換為二苯甲基時,抑制活性明顯降低。Thakur等[11]通過銅催化的Click反應合成了一類含有雙堿(嘧啶和1,2,3-三氮唑)和糖的核苷類似物。在這一系列的化合物中,化合物7表現出最好的抑制活性,在10 μmoL·L-1的濃度下對α-葡萄糖苷酶的抑制率達到47.4%。構效關系顯示,對于這類化合物,脫除糖環上的乙酰基的化合物活性高于乙酰基保護的化合物。葡萄糖型的化合物活性高于其他糖型,如半乳糖、甘露糖、呋喃糖。另外,在嘧啶兩個氮原子上都引入三氮唑-糖支鏈得到的化合物,如8抑制活性也較弱。Zamoner等[12]以1,2,3-三氮唑作為連接臂,將糖和氮雜糖偶聯成偽二糖。這類化合物中,化合物9表現出最好的抑制活性,但大部分偶聯的偽二糖抑制活性都不理想,甚至沒有明顯的抑制活性。化合物抑制活性和三氮唑與糖環的連接位置有關,此外,當氮雜糖環擴大為七元環或環上沒有羥甲基時活性明顯減弱。分子對接研究發現這些偽二糖氮雜糖保留了一部分典型的氮雜糖類化合物和酶之間的結合模式,三氮唑基團通過與酶Phe-444之間產生疏水作用增加親和力。Chavan等[13]設計了一類螺環氮雜糖-1,2,3-三氮唑雜合體10和11,兩者均表現出較好的抑制活性(IC50= 0.075 μmol·L-1和0.036 μmol·L-1,羥甲基有利于提高抑制活性。在氮雜位進行烷基化修飾,如乙基、正丁基等,都可以明顯提高其抑制活性。但相對化合物10和11來說,取代后的化合物對酶的抑制選擇性下降(即對其他不同類型的糖苷酶的抑制活性也提高,如β-葡萄糖苷酶、α-半乳糖苷酶、β-半乳糖苷酶和α-甘露糖苷酶等)。Shinde等[14]合成了一類含有二茂鐵的噻唑烷二酮糖-1,2,3-三氮唑化合物,這是將無機金屬元素引入糖苷酶抑制劑研究領域的有益嘗試。其中,糖環三位為芐基取代的化合物12表現出較好的α-葡萄糖苷酶抑制活性(IC50=0.85 mg·mL-1),而裸露的羥基或者乙酰基、苯甲酰基等其他基團取代時,抑制活性消失。Santhanam等[15]設計了一類并環結構的1,2,3-三氮唑-五元環氮雜糖雜合物,通過內酰胺鍵形成三個并環。其中化合物13對酵母α-葡萄糖苷酶較好的抑制活性(IC50=112 μmol·L-1)。當在化合物13的三氮唑四位引入羥甲基,活性消失。其活性也與氮雜糖環上羥甲基的立體構型密切相關,與化合物13羥甲基的構型翻轉的化合物14不能表現出明顯的抑制活性。分子對接研究進一步揭示了這類分子中內酰胺羰基氧可以與酶Asp-212形成氫鍵,對于抑制活性非常重要。化合物1~14的化學結構式見圖1。
2 芳基-1,2,3-三氮唑雜合體
近年來,一些不含糖類或類糖結構的芳基-1,2,3-三氮唑雜合體在α-葡萄糖苷酶抑制劑的研究中表現出較好的活性。Chinthala等[16]合成了一系列噻唑烷二酮-1,2,3-三氮唑雜合體衍生物,其中對異丙基和鄰硝基取代的化合物15和苯乙基取代的化合物16表現出最好的抑制活性(IC50=0.1、0.3、0.3 μg·mL-1)。Gonzaga等[17]參照糖-1,2,3-三氮唑型抑制劑,設計合成了一系列1-苯、2-苯取代的4-取代1,2,3-三氮唑衍生物17和18,對苯環的取代基和4取代的基團進行了系統的研究。對氟代苯基的化合物,2-取代的化合物18活性略高于1-取代的化合物17。對于R2基團,醛基、亞胺、苯腙和肟等取代基有利于提高抑制活性。此后,1,4-雙取代的芳基-1,2,3-三氮唑雜合體作為α-葡萄糖苷酶抑制劑引起了廣泛的研究興趣。Jabeen等[18]通過一價銅催化的click反應構建了一系列1,4-雙取代的1,2,3-三氮唑,其中1-環己醇取代的化合物19表現出最好的抑制活性(IC50=49.7 μmol·L-1)。在苯環區域,2′-氯原子,2′-乙酰基, 3′-甲氧基,4′-硝基等單取代化合物已知活性均低于2′-氰基和4′-硝基雙取代化合物。另外,三氮唑四位基團換為苯基時,活性也大幅降低。通過分子對接研究發現,這類化合物與酶的結合模式主要為氫鍵和疏水作用。Wang等[19]合成了一系列新型的2,4,5-三芳基咪唑-1,2,3-三氮唑雜合體,其中鄰溴代苯基和2-氧乙基取代的化合物20表現出最好的抑制活性(IC50=15.16 μmol·L-1)。3-溴苯基是這類化合物的最優取代基團,如果將3-溴苯基替換為氟代苯基、氯代苯基、甲氧基苯基或者噻吩環都會導致活性降低。分子對接研究揭示了化合物20的乙氧基苯基在酶口袋的底部通過范德瓦爾斯力緊密結合,而在酶口袋頂部的三苯基咪唑則貢獻較弱的結合力。Wang等[20]也合成了一系列三嗪-三氮唑衍生物,并評價了其α-葡萄糖苷酶抑制活性。其中,含有2.5-二氯苯基取代的化合物21表現出最好的抑制活性(IC50=37.44 μmol·L-1)。這類化合物中,在苯環上引入給電子基團如甲基、甲氧基、乙氧基等,相較于未取代的苯環活性略微提高,但鄰位甲基取代例外。Gong等[21]合成了一系列苯并噻唑-1,2,3-三氮唑雜合體22,其中R為對位叔丁基的化合物表現出最強的抑制活性(IC50=20.7 μmol·L-1)。這類化合物中,在苯環的對位引入吸電子基團,活性明顯提高,而在鄰位引入吸電子基團則會使活性下降。此外,將苯并噻唑環上的氯原子換成氫原子也會使活性略微減弱。分子對接的研究發現,苯并噻唑基團位于疏水口袋,被Phe-157,Phe-310 和 Phe-311殘基包圍,4-叔丁基苯基部分與Phe-157,Phe-177 和 Phe-300形成了穩定的疏水結合。Iqbal等[22]設計并合成了一類咔唑-三氮唑雜合體衍生物23,研究苯環上取代基團對抑制活性的影響。其中,3′-溴、4′-羥基雙取代的化合物表現出最好的抑制活性(IC50=1.0 μmol·L-1)。當將苯環換為3-吡啶基時,活性進一步提高,達到0.8 μmol·L-1。Avula等[23]設計并合成了一系列1,4-雙取代的芳基-1,2,3-三氮唑雜合體24,首先對四位苯基上的取代基團進行研究,發現三氟甲基、氟原子取代都有較好的活性。隨后,以三氟甲基取代的化合物24為底物合成一系列芳基取代的化合物25。其中,當Ar為對甲氧基苯基時,化合物表現出最好的抑制活性(IC50=14.2 μmol·L-1)。構效關系顯示,在苯環對位引入甲氧基、硝基和三氟甲基等可以提高抑制活性,或與氫鍵形成有關。Saeedi等[24]融合前人工作的優勢骨架,設計合成了一類新穎的喹唑啉酮-1,2,3-三氮唑雜合體26,對苯環上取代基團R1和R2進行構效關系的探究。構效關系顯示,苯環上取代基團R1為氫原子或甲氧基時,活性差異不大,甲氧基取代的活性略低于不取代的化合物。苯環上取代基團R2為對位取代的溴原子時,抑制活性最高(IC50=181.0 μmol·L-1)。分子對接結果顯示喹唑啉酮部分和His-279之間形成氫鍵和π-π相互作用,苯基和硫原子與Arg-312相互作用,三氮唑環和Pro-309之間則存在疏水作用。化合物15~26的合學結構式見圖2。
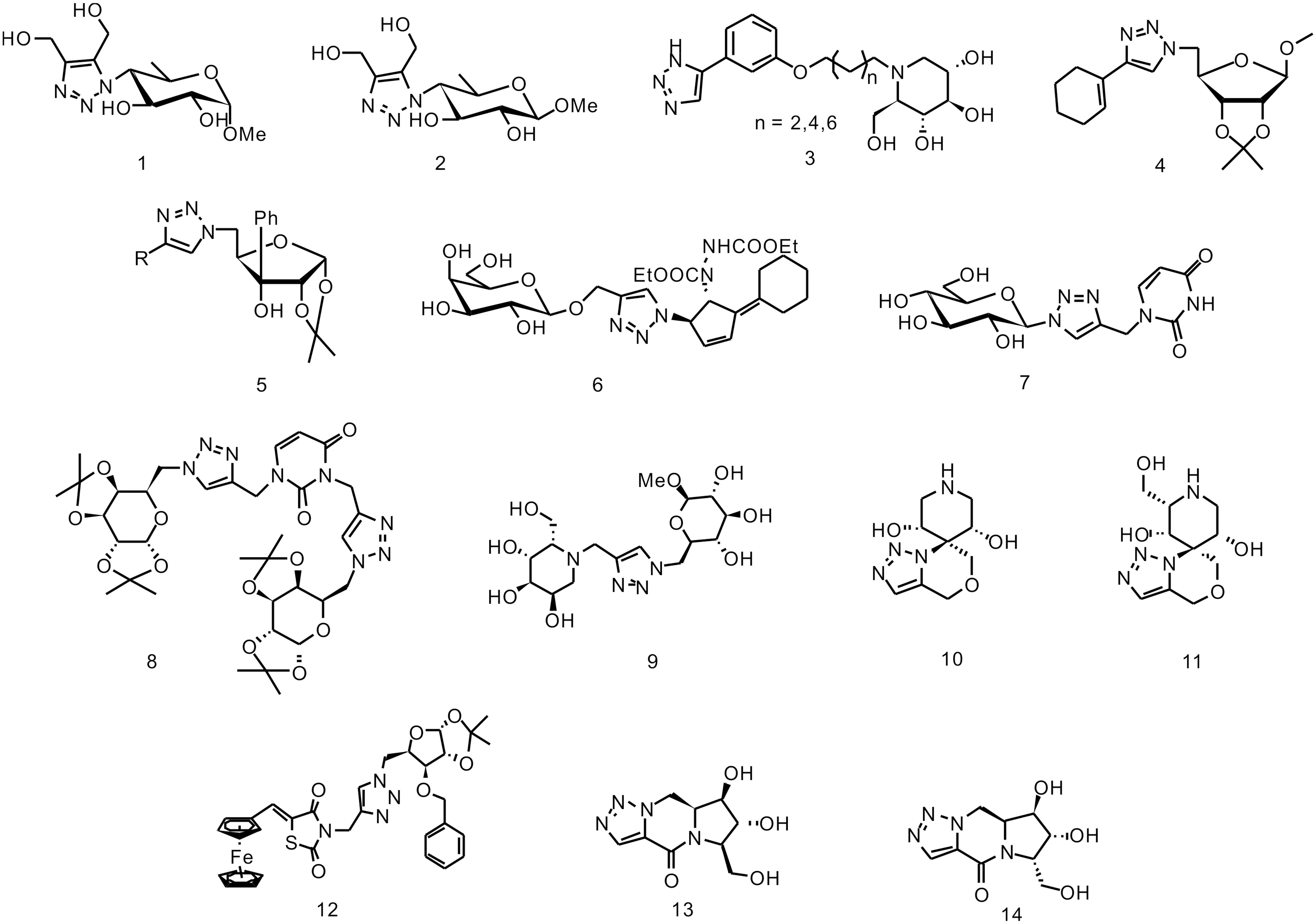
圖1 糖-1,2,3-三氮唑雜合體
3 1,2,4-三氮唑衍生物
1,2,4-三氮唑結構在α-葡萄糖苷酶抑制劑的研究也有很多應用。Balba等[25]合成了4,5-二苯基-1,2,4-三氮唑-3-硫醇27和4-苯基-5-(2-羥基苯基)-1,2,4-三氮唑-3-硫醇28,化合物27可競爭性抑制α-葡萄糖苷酶和α-淀粉酶(兔肝臟來源),具有很好的親和力,Ki值達到10-5數量級。與此同時,化合物28對α-淀粉酶并不表現出抑制活性,但對α-葡萄糖苷酶是一種與化合物27活性水平相當的競爭性抑制劑,其Ki值也達到10-5數量級。Bekircan等[26]設計合成了一類1,2,5-三取代的1,2,4-三氮唑衍生物,化合物29表現出最好的α-葡萄糖苷酶抑制活性(IC50=4.36 μmol·L-1)。將與哌嗪相連的甲基換成苯基,抑制活性略微下降。Aziz等[27]構建了一系列哌啶-1,2,4-三氮唑雜合體30和31,在三氮唑三位引入不同的烷基或芳基進行修飾。在化合物30中,優勢取代基有異丙基和仲戊基,抑制活性高于乙基、正丙基、正丁基、正戊基等基團。在化合物31中,優勢取代基有對甲苯基、鄰乙苯基、對乙苯基和對乙氧苯基。分子對接研究解釋了這類化合物與酶之間通過氫鍵、π-π、π-陽離子相互作用。其中磺酰基氧原子和Lys-422之間形成很強的氫鍵作用。Mermer等[28]合成了一系列含有哌嗪的1,2,4-三氮唑衍生物,并對其進行了α-葡萄糖苷酶抑制活性評價。化合物32表現出最好的抑制活性(IC50=64.56 μmol·L-1),將硫原子連接部分的羥基變為羰基或在其上引入芳基化修飾,活性均下降。此外,硫原子連接部分的苯環上2′-氯原子也會提高抑制活性。三氮唑四位的苯基變為芐基,抑制活性消失。Channar等[29]合成了一系列噻唑并1,2,4-三氮唑雜合物,其中間硝基苯基和間甲苯基取代的化合物33對α-淀粉酶表現出最好的抑制活性(IC50=1.1 μmol·g-1)。構效關系研究顯示,噻唑環相連的苯環上,間位取代的硝基增加了電子分布,有利于提高活性。與三氮唑環相連的苯環上的鹵素原子對提高α-葡萄糖苷酶抑制活性有利。Pillai等[30]合成了兩種新型結構的席夫堿-1,2,4-三氮唑雜合體34和35,其分別對α-葡萄糖苷酶36.76和43.38 μmol·L-1的半抑制濃度。苯對位為甲氧基的化合物活性略高于二甲氨基取代的化合物。化合物27~35的化學結構式見圖3。
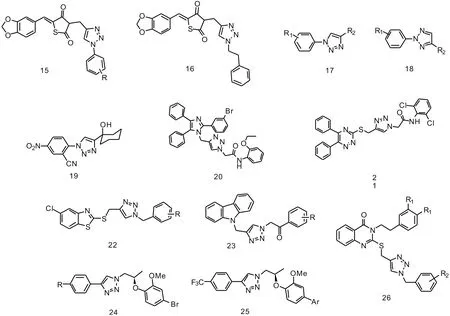
圖2 芳基-1,2,3-三氮唑雜合體
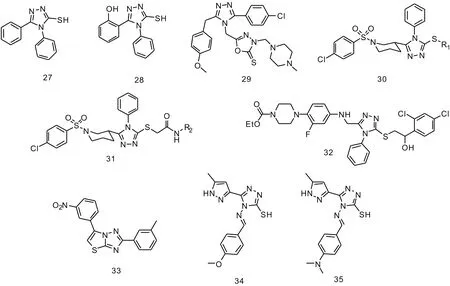
圖3 1,2,4-三氮唑衍生物
4 結語
本文對截至2019年5月前三氮唑類α-葡萄糖苷酶抑制劑的研究進展和構效關系進行了綜述。可以看出,三氮唑作為藥物化學研究中一種重要的結構單元,以糖-1,2,3-三氮唑雜合體、芳基-1,2,3-三氮唑雜合體和1,2,4-三氮唑衍生物這三類形式,在α-葡萄糖苷酶抑制劑的研究領域中發展了許多具有良好抑制活性的抑制劑。這些研究為進一步探究與α-葡萄糖苷酶相關的生理過程提供了分子工具,同時也可能成為下一代新型降糖藥的候選分子。我們相信,以三氮唑為骨架進行結構修飾改造有望得到更多新的高效安全的α-葡萄糖苷酶抑制劑。

