HOTAIR上調miR-152靶向調控HLA-G的生物信息作用預測與驗證
李曉娟 ,周芝熠 ,王玨,錢源 ,3,4△
子癇前期(preeclampsia,PE)是嚴重威脅母兒健康的妊娠相關疾病,目前全世界發病率為3%~17%[1]。子癇前期病理學機制尚未完全闡明,研究表明子癇前期患者胎盤及外周血中人類白細胞抗原-G(human leucocyte antigen-G,HLA-G)的表達水平低于正常孕婦[2]。HLA-G屬于非經典HLA-Ⅰ分子,主要表達于母胎界面絨毛外滋養層細胞,是重要的免疫耐受分子。HLA-G通過多種機制維持正常妊娠,如抑制妊娠期子宮蛻膜內自然殺傷(natural killer,NK)細胞和細胞毒性 T淋巴(cytotoxic T-lymphocyet,CTL)細胞的細胞毒性發揮免疫抑制作用[3]。
HOX轉錄反義RNA(HOX transcript antisense RNA,HOTAIR)是一種典型的反義長鏈非編碼RNA(long non-coding RNA,lncRNA),也是第一個被發現的具有反式轉錄調控作用的長鏈非編碼RNA。目前研究發現HOTAIR可作為內源競爭性RNA(ceRNA)與某些靶miRNA競爭性結合,從而解除miRNA對靶信使RNA(mRNA)的抑制作用,進而發揮特 定 的生 物 學功能[4-5]。Song 等[6]研究認 為HOTAIR作為miR-152的ceRNA發揮生物學功能,誘導HLA-G表達增加,參與胃癌的逃逸過程。同時Zhu等[7]研究表明miR-152-3p通過靶向3'-非翻譯區(UTR)的結合位點抑制HLA-G的表達,并且miR-152-3p可能通過上調NK細胞介導的人絨毛膜癌細胞JEG-3細胞溶解,發揮免疫增強劑的作用。這些研究提示HOTAIR可作為miR-152-3p的ceRNA調控HLA-G的表達。
人類白細胞抗原HLA-G在胎盤中的低表達被認為與子癇前期的發病相關,但其異常表達的機制尚未完全闡明。為進一步研究HOTAIR、miRNA-152-3p及HLA-G與子癇前期發病機制的關系,我們通過雙熒光素酶實驗驗證三者在HTR-8/SVneo細胞中靶向調控的關系,為進一步研究具體的下游調控機制提供理論依據,從而發現子癇前期潛在的診斷、治療靶點。
1 材料與方法
1.1實驗材料 HTR-8/SVneo細胞購自BioVector質粒載體菌種細胞基因保藏中心。RPMI-1640培養基(美國Gibco公司),胎牛血清(FBS,以色列BI公司),HOTAIR、HLA-G的目標序列和突變序列、miR-152-3p mimics及mimics-NC(上海吉瑪公司),限制性內切酶SacⅠ、XhoⅠ(美國Fermentas公司),DNA凝膠回收試劑盒,質粒小提試劑盒(北京天根生化有限公司),中量抽提試劑盒(杭州愛思進生物技術有限公司),LipofectamineTM2000(美國Invitrogen),雙熒光素酶報告基因檢測系統試劑盒(美國Promega公司)。
1.2方法
1.2.1生物信息學預測 采用DIANA在線預測網站diana.imis.athena-innovation.gr/DianaTools/及PITA軟件對miR-152-3p與HOTAIR和HLA-G的3'-UTR區域結合位點進行分析,預測miR-152-3p與HOTAIR及HLA-G的潛在結合位點。
1.2.2雙熒光素酶報告載體構建 根據靶基因與miR-152-3p結合的序列,設計野生型及突變型PCR擴增引物序列,見表1。化學合成以上序列,合成時在序列兩端加上SacⅠ和XhoⅠ酶切位點,用退火的方法得到目的序列雙鏈模板。為將目的序列片段克隆到GP-miRGLO載體中,先采用SacⅠ和XhoⅠ對GP-miRGLO載體進行酶切,酶切產物經1%瓊脂糖凝膠電泳,用DNA凝膠回收試劑盒回收雙酶切后的載體條帶,然后采用T4 DNA連接酶連接目的片段與雙酶切后的GP-miRGLO載體。將連接產物轉化入感受態細胞,并將培育后的細胞接種于含50 mg/L氨芐青霉素的LB平板上,置37℃培養箱培養16 h。篩選陽性克隆,質粒小提試劑盒抽提質粒。重組質粒送上海吉瑪公司測序,測序結果與目的基因序列比對后,篩選出構建成功的目的基因表達質粒,并對篩選出的陽性克隆進行超純去內毒素抽提,得到足夠量的重組質粒。

Tab.1 The primers for HOTAIR wild-type,mutant and HLA-G wild-type,mutant表1 HOTAIR野生型、突變型及HLA-G野生型、突變型引物序列
1.2.3細胞培養及轉染 人工合成miR-152-3p mimics及mimics NC序列,見表2,以LipofectamineTM2000為轉染試劑。轉染前1 d收取處于對數生長期的HTR-8/SVneo,按5×105細胞/孔接種于12孔板,使轉染時的細胞融合度能夠達到70%~80%。共設置8個組:HOTAIR野生型+mimics NC、HOTAIR野生型+miR-152-3p、HOTAIR突變型+mimics NC、HOTAIR突變型+miR-152-3p、HLA-G野生型+mimics NC、HLA-G野生型+miR-152-3p、HLA-G突變型+mimics NC、HLA-G突變型+miR-152-3p,每組3個平行孔。按照LipofectamineTM2000試劑盒說明書進行轉染,轉染后搖勻,置于37℃、5%CO2培養箱溫育5 h后,將孔里的培養液移去,更換為含10%FBS的培養基,24 h后收取細胞。

Tab.2 The sequences of miR-152-3p mimics and mimics NC表2 miR-152-3p mimics及mimics NC序列
1.2.4熒光素酶活性測定 轉染24 h后棄培養基,加入細胞裂解液裂解細胞,取每孔100μL細胞裂解液加入10μL的LARⅡ試劑,酶標儀上檢測螢火蟲熒光素酶活性。取出測試板,加入10μL Stop&Glo試劑,酶標儀檢測海腎熒光素酶活性。以海腎熒光素酶為內參,將每個樣品螢火蟲熒光素酶活性進行均一化處理,比較相對熒光素酶活性。
1.3統計學方法 采用SPSS 17.0進行統計學分析,計量數據以均數±標準差(±s)表示,2組間比較采用獨立樣本t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1結合位點預測 預測結果顯示miR-152-3p與HOTAIR有3個潛在結合位點,miR-152-3p與HLAG的3'-UTR區域有1個潛在結合位點,見圖1。

Fig.1 Potential binding sites of miR-152-3p to HOTAIR and HLA-G 3'-UTR圖1 miR-152-3p與HOTAIR和HLA-G的3'-UTR區域潛在結合位點
2.2測序及序列對比分析 含有與miR-152-3p結合位點及缺失結合位點的熒光素酶報告載體HOTAIR野生型、HOTAIR突變型、HLA-G野生型、HLA-G突變型測序結果見圖2~5。對比結果表明,目標序列和突變序列均成功地克隆入雙螢光報告載體GP-miRGLO,可以用于后續螢光素酶檢測實驗。2個克隆測序方向為標準序列的互補鏈,與SNP數據庫結果互補。
2.3雙熒光素酶活性分析 HOTAIR野生型+miR-152-3p組相對熒光素酶活性(0.308±0.013)與HOTAIR野生型+mimics NC組(1.002±0.051)相比較,差異有統計學意義(n=3,t=22.531,P<0.001),HOTAIR野生型+miR-152-3p組熒光素酶活性受到明顯的抑制。HOTAIR突變型+miR-152-3p組(1.004±0.061)與 HOTAIR突變型+mimics NC組(1.003±0.022)相比差異無顯著變化(n=3,t=0.119,P=0.911),見圖6。HLA-G野生型+miR-152-3p組相對熒光素酶活性(0.621±0.033)與HLA-G野生型+mimics NC組(1.003±0.040)相比較差異有統計學意義(n=3,t=12.596,P<0.001),HLA-G野生型+miR-152-3p組熒光素酶活性受到明顯的抑制。HLA-G突變型+miR-152-3p組(1.050±0.039)與HLA-G突變型+mimics NC組(1.002±0.042)相比差異無顯著變化(n=3,t=1.521,P=0.203),見圖7。
3 討論
3.1HLA-G低表達促進子癇前期發生 子癇前期發病機制尚未闡明,HLA-G低表達增加母體對半抗原胎兒的免疫不耐受與子癇前期的發生密切相關[8]。HLA-G作為非經典主要組織相容性復合體(MHC)Ⅰ類抗原,可通過調節細胞因子的釋放誘導免疫耐受,調控滋養層細胞的侵入能力,促使子宮螺旋動脈重塑,維持正常妊娠[9]。HLA-G還可抑制NK細胞和T淋巴細胞的細胞毒作用,減弱母體對胎兒的免疫不耐受[10]。同時HLA-G能夠以抗原呈遞的身份參與免疫識別,誘導母胎界面的免疫耐受[11]。HLA-G低表達與子癇前期的發生密切相關。
Fig.2 Map for partial sequences of the wild type HOTAIR圖2 HOTAIR野生型部分測序結果
Fig.3 Map for partial sequences of the mutant type HOTAIR圖3 HOTAIR突變型部分測序結果

Fig.4 Map for partial sequences of the wild type HLA-G圖4 HLA-G野生型部分測序結果
Fig.5 Map for partial sequences of the mutant type HLA-G圖5 HLA-G突變型部分測序結果

Fig.6 Expression of relative luciferase activity of HOTAIR group圖6 HOTAIR組熒光素酶活性相對表達量
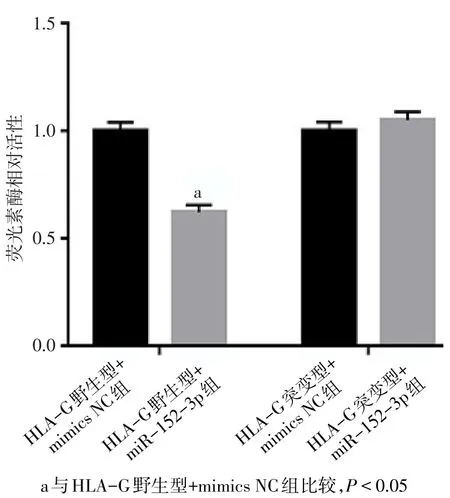
Fig.7 Expression of relative luciferase activity of HLA-G group圖7 HLA-G組熒光素酶活性相對表達量
3.2microRNA可調控HLA-G的表達 Sun等[12]通過生物信息學分析和熒光素酶分析,對HOTAIR作為ceRNA的作用機制進行了探討,采用過表達和RNA干擾方法對宮頸癌細胞HeLa、ME-180、SiHa和CasKi進行研究,結果表明HOTAIR通過競爭性結合miR-148a調節HLA-G的表達進而參與宮頸癌的發生。Luo等[13]研究發現,miR-148a在HTR-8/SVneo細胞中通過抑制DNA甲基轉移酶1(DNMT1)的水平調節HLA-G的表達而參與子癇前期的發生機制。以上研究表明microRNA可通過多種機制調控HLAG的表達。
3.3HOTAIR對miR-152-3p負向調控作用 研究表明,在癌癥患者中HOTAIR與miR-152-3p表達之間呈負相關關系,且HOTAIR對miR-152-3p表達有潛在負調控作用[14]。Luan等[15]在人黑色素瘤細胞系A375、A875中證實HOTAIR作為miR-152-3p的ceRNA,通過激活PI3k/Akt/mTOR信號通路調控肝細胞生長因子受體c-MET的表達,促進惡性黑色素瘤的進展。這些研究表明HOTAIR與miR-152-3p之間存在靶向關系。
3.4HOTAIR通過miR-152-3p調控HLA-G的表達 Song等[6]研究證實在胃癌細胞系SGC7901和MGC-803中,HOTAIR通過抑制miR-152的表達上調HLA-G參與胃癌的免疫逃逸。但HOTAIR、miR-152-3p、HLA-G是否參與子癇前期發病機制尚鮮見報道。本研究通過生物信息學分析發現miR-152-3p在HOTAIR轉錄本中存在3個潛在的結合域,通過熒光素酶報告系統在HTR-8/SVneo細胞中進行驗證,預測miR-152-3p對HOTAIR及HLA-G存在作用靶點。提示在滋養細胞中HOTAIR、miR-152-3p、HLA-G之間存在相互調控的可能性,但三者在子癇前期患者中是否存在相互關系未進行驗證,具體下游調控機制有待進一步研究。

