長鏈非編碼RNA核仁小分子RNA宿主基因1對胃癌細胞增殖和侵襲的影響
武秋林 張建
(河南衛生干部學院,河南 鄭州 450008)
胃癌發病率居于第4位〔1〕,在由癌癥引起的死亡中排名第2,且隨著年齡的增長其發病率呈上升趨勢,在65歲以上人群中發病率高達28.5%〔2〕。由于缺乏有效的早期診斷工具,多數胃癌患者一經發現即已處于晚期狀態,同時伴隨轉移發生,預后不容樂觀〔3〕。長鏈非編碼(lnc)RNA是一類長度超過200個核苷酸,但無編碼蛋白功能的RNA〔4〕。lncRNA常被認為是基因轉錄時的“噪音”,隨著研究的深入,越來越多的研究證實異常表達的lncRNA和腫瘤的發生、遷移及預后密切相關〔5~7〕。lncRNA參與多種生物功能活動,如細胞分化、自噬、凋亡等。最新的研究發現lncRNA在一些惡性腫瘤中異常表達,甚至可作為原癌基因或抑癌基因而發揮作用〔8〕。核仁小分子RNA宿主基因(SNHG)1是一種新型的lncRNA,主要定位于細胞質。研究顯示,SNHG1在腫瘤發生發展中發揮重要的作用,在肺癌、肝癌、前列腺癌、結直腸癌等多種腫瘤中高表達并發揮著潛在的致癌基因角色〔9~11〕。SNHG1在胃癌中的表達情況及對胃癌細胞生物學行為的影響目前仍缺少相關報道。本研究探討SNHG1在胃癌細胞中的表達情況及對胃癌細胞增殖、侵襲能力的影響。
1 材料和方法
1.1細胞系 人胃癌細胞株SGC7901和BGC823及人正常胃上皮細胞NGEC購自中國科學院上海生命科學院細胞資源中心。復蘇SGC7901和NGEC細胞,采用含10%胎牛血清(FBS)及100 U/ml青霉素和0.1 mg/ml 鏈霉素的RPMI1640培養基培養;復蘇BGC823細胞,采用10% FBS及100 U/ml 青霉素和0.1 mg/ml鏈霉素的DMEM培養基培養。細胞置于含5%二氧化碳、37℃細胞培養箱中擴增培養,生長至培養瓶底面覆蓋率80%~90%(即細胞處于對數生長期)時,使用0.25%胰酶-乙二胺四乙酸(EDTA)消化液消化傳代,用于后續實驗。
1.2主要試劑 RPMI1640、DMEM和無血清培養基(opti-MEM)購于美國Gibco公司,FBS購于美國GIMINI公司;胰酶、青-鏈霉素雙抗購于碧云天生物技術有限公司;對照序列的小干擾RNA(si-NC)和SNAG1的小干擾RNA(si-SNHG1)等所引物均由上海生工生物工程有限公司設計并合成;Trizol試劑購于美國Invitrogen公司;RNA逆轉錄試劑盒和熒光定量試劑盒購于美國Applied Biosystems公司;噻唑藍(MTT)購于Sigma公司;Transwell小室購于BD公司;基質金屬蛋白酶(MMP)-2、MMP-9和ki67購于美國Affinity公司。蛋白提取試劑盒、電化學發光(ECL)試劑盒及二喹啉甲酸(BCA)蛋白定量試劑盒購于Thermo公司;β-actin鼠多克隆抗體購于Santa Cruz公司。
1.3胃癌細胞中SNHG1的敲除 si-SNHG1序列:CUUAAAGUGUUAGCAGACATT;si-NC序列:GCG-ACGAUCUGCCUAAGAUTT。待細胞生長至融合度約90%時,消化細胞并計數,將細胞分別接種至6孔板,2×105個/孔。每孔加入2 ml含10% FBS的RPMI1640培養基過夜。轉染參照Lipofectamine 2000說明書進行,將lipofectamine 2000和si-RNA分別加入250 μl的opti-MEM中,室溫靜置5 min后,將兩者混在一起并輕輕混勻,室溫靜置20 min形成siRNA/lipofectamine 2000混合物。棄6孔板中的舊培養基,每孔加入1.5 ml的opti-MEM。吸取500 μl siRNA/lipofectamine 2000混合物逐滴加入孔中,置于細胞培養箱中孵育4~6 h更換為RPMI1640完全培養基。繼續培養48~72 h后進行轉染后續實驗。
1.4細胞中RNA的提取 將SGC7901、BGC823和NGEC細胞分別接種于6孔板中,待細胞處于對數生長期時棄去培養基,用預冷的無菌磷酸鹽緩沖液(PBS)清洗2遍。棄凈PBS,每孔加入1 ml TRIZOL試劑,反復吹吸數次使細胞脫落并裂解。將液體收集至無RNA酶的1.5 ml離心管中,室溫放置5 min。加入200 μl氯仿,劇烈晃動15 s,室溫放置3 min。4℃、12 377 r/min離心15 min,將上層水相中的RNA小心吸取轉移至另一干凈試管。加入0.5 ml異丙醇,室溫靜置10 min。4℃、12 377 r/min離心10 min后,棄上清,加入1 ml 75%乙醇洗滌沉淀1次,4℃、7 500 r/min離心5 min,棄上清,室溫靜置干燥沉淀,加入50 ml無RNA酶水,55℃水浴10 min使RNA充分溶解。取2 ml液體用紫外分光光度計測定RNA光密度值(OD),當A260/A280比值處于1.8~2.0時,表明RNA純度合適,可進行后續實驗。
1.5逆轉錄及實時熒光定量-聚合酶鏈反應(qRT-PCR) 以上提取的RNA按高容量cDNA逆轉錄試劑盒(Biosystems,Foster City,CA,USA)說明書,逆轉錄成cDNA。隨后,以cDNA為模板,用SYBR綠熒光染料法(Biosystems,Foster City,CA,USA)檢測SNHG1表達水平,SNHG1引物序列為5′-AGGCTGAAGTTACAGGTC-3′(正義)和5′-TTGGCTCCCAGTGTCTTA-3′(反義)。β-actin為內參,引物序列為5′-ACCAACTGGGACGAT-3′(正義)和5′-TACGACCAGAGGCATACAGGGACAA-3′(反義)。選擇Ct值處于18~30之間的數據,以2-ΔΔCt計算相對表達量。
1.6MTT法檢測細胞增殖能力 收獲對數生長期的轉染細胞,制備成合適濃度的細胞懸液,分別接種2 500個/孔于96孔板中,設置6個復孔。接種后24 h、48 h、72 h每孔分別加入20 μl 5 mg/ml的MTT,混勻后繼續孵育4 h。棄掉培養基,加入二甲基亞砜150 μl/孔,震蕩10 min,酶標儀490 nm下檢測每孔OD值。
1.7Transwell檢測細胞侵襲能力 收獲轉染48 h的細胞,用opti-MEM制成濃度為2×105個/200 μl的細胞懸液。水化Transwell小室后,在小室下部加入500 μl 10%的FBS培養基,上部加入200 μl細胞懸液,細胞培養箱中培養24 h取出,去除未穿過基質膠的細胞。室溫下4%多聚甲醛中固定約30 min,隨后置于0.1%結晶紫溶液中染色30 min。PBS清洗2次,室溫晾干。顯微鏡下計數細胞,每個小室5個視野,取平均值。
1.8Western印跡法檢測增殖和侵襲標志蛋白 收獲轉染si-SNHG1和si-NC 72 h的細胞,加入適量RIPA/PMSF裂解液,置于冰上裂解30 min。4℃,12 000 r/min離心15 min,取上清。蛋白上清經十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離轉移至聚偏氟乙烯(PVDF)膜,10%脫脂奶粉室溫下封閉1 h,加入1∶1 000鼠抗人β-actin、ki67、MMP-2、MMP-9。4℃孵育過夜,TBST洗膜10 min,共3次。加入1∶2 000稀釋的二抗,37℃孵育約1 h,TBST洗膜3次;ECL發光檢測,曝光成像。
1.9統計學方法 采用SPSS16.0軟件進行t檢驗、單因素方差分析。
2 結 果
2.1SNHG1在胃癌細胞中表達 SNHG1在NGEC細胞中的表達水平(1.00±0.19)顯著低于在SGC7901、BGC823細胞中的表達水平(4.16±0.44、6.22±0.65,P<0.05)。
2.2轉染si-SNHG1能夠下調胃癌細胞SGC7901和BGC823中SNHG1的表達水平 si-SNHG1轉染SGC7901、BGC823細胞后,SNHG1的表達量SGC7901細胞(0.37±0.09)和BGC823細胞(0.44±0.09)顯著低于空白組(SGC7901細胞為1.00±0.18,BGC823細胞為1.00±0.17)及轉染si-NC的細胞(SGC7901細胞為0.96±0.19,BGC823細胞為1.01±0.16,P<0.05)。
2.3下調SNHG1對胃癌細胞增殖的影響 與si-NC組相比,siSNHG1組SGC7901和BGC823細胞在48 h、72 h的增殖能力均顯著下降(P<0.05)。見表1。
2.4下調SNHG1對胃癌細胞侵襲的影響 si-SNHG1組SGC7901、BGC823細胞侵襲能力顯著低于si-NC組(P<0.05),見表1,圖1。
2.5下調SNHG1對胃癌細胞增殖和侵襲標志蛋白的影響 與si-NC組相比,si-SNHG1組SGC7901、BGC823細胞的增殖標記物ki67和侵襲相關蛋白MMP-2、MMP-9表達量均顯著下降。見圖2。
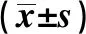
表1 敲除SNHG1對胃癌細胞增殖和侵襲能力的影響
與si-NC組比較:1)P<0.05

圖1 敲除SNHG1抑制SGC7901和BGC823細胞侵襲(結晶紫,×100)
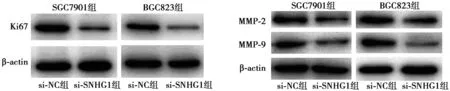
圖2 敲除SNHG1抑制SGC7901和BGC823細胞中Ki67、MMP-2和MMP-9蛋白表達
3 討 論
在哺乳類動物基因組中,無蛋白編碼功能的基因(ncRNAs)約占90%。在這些ncRNAs中約18%的lncRNAs與人類腫瘤疾病有關,而具有蛋白編碼功能的基因僅占9%〔12〕,表明lncRNAs在人類腫瘤疾病發生和發展中扮演重要角色。研究顯示,lncRNAs表達失調可對多種腫瘤疾病的進程產生影響,如腫瘤細胞增殖、浸潤及轉移等過程〔13〕。最新研究顯示,lncRNAs SNHG1表達水平與多個類型腫瘤發生有關〔9,11~13〕。lncRNAs SNHG1在腫瘤中表達上調往往預示著病人預后較差。本研究表明SNHG1在胃癌細胞中高表達且促進了胃癌細胞的增殖和侵襲。
研究表明〔7,10〕,lncRNA參與了基本的生物過程,主要通過與蛋白質、DNA或RNA等相互作用發揮重要的調控功能,如基因組轉錄、轉錄后修飾、干擾、核內運輸等。研究發現lncRNA的正常表達在個體發育如胚胎干細胞干性、細胞周期等過程中發揮十分重要的作用,而異常表達則會導致細胞發生惡性轉化,影響著腫瘤的發生和發展〔14〕。Li等〔14〕研究發現lncRNA H19在胃癌中高表達,并且影響著胃癌細胞的增殖和遷徙,其機制可能與H19競爭性結合其他RNA進而發揮促癌功能。Cui等〔10〕研究發現,SNHG1通過影響下游基因表達和信號通路進而影響肺癌的進展。Sun等〔12〕研究發現,結腸癌中SNHG1表達水平的提高預示著不良預后情況,并且SNHG1促進結腸癌的發生發展。
MMP與腫瘤血管形成、侵襲及轉移密切相關〔15〕。MMP2與MMP9主要通過消化基底膜中Ⅳ型膠原纖維從而介導血管侵襲和轉移。MMP2可作為胃癌早期診斷標志物,MMP9表達可用于預測黏膜內胃癌淋巴結轉移。增殖相關標志物Ki67定位于細胞核、半衰期短,其表達高低反映了細胞增殖的程度,是判定腫瘤惡性程度及侵襲力的重要標志之一〔16〕。研究證實,ki67在胃癌中的表達率較高,具有重要的臨床意義〔17〕。本研究顯示,下調SNHG1表達,ki67、MMP2和MMP9表達水平均下降。由此可推斷,SNHG1可能通過影響ki67、MMP2和MM9的表達在胃癌的侵襲轉移中發揮重要作用。
綜上,SNHG1在胃癌細胞中高表達,且與腫瘤細胞的增殖、侵襲能力密切相關。降低SNHG1表達的同時也可降低ki67、MMP2和MMP9的表達,使腫瘤細胞的增殖、侵襲轉移能力降低。

