二甲雙胍作用于3T3-L1前脂肪細胞誘導階段對v-SNAREs蛋白家族mRNA表達的影響
任 毅,楊 霞2,侯敬天,呂 欣3,王建紅4,劉云峰,楊 靜
糖尿病是當今人類致死致殘的主要原因之一,給社會發展和家庭帶來了沉重經濟負擔,對于糖尿病采取降糖等有效管理,可以預防心血管疾病和糖尿病微血管并發癥的發生[1]。根據國際糖尿病聯盟統計,2015年全球的糖尿病患病人數已達4.15億人,如不采取有效措施,預估到2040年糖尿病患病人數將達6.42億人[2],因而防治糖尿病是當前國內外醫學領域急迫解決的重要任務。2型糖尿病占糖尿病總人群90%以上,胰島素抵抗是其主要的病理特征[3]。葡萄糖轉運子4(GLUT4)胞吐與胞吞之間的動態平衡是葡萄糖保持正人億,糖尿病相關的醫療費用將突破 8 020 億美常攝取及血糖維持穩定的重要因素。GLUT4轉運障礙以及GLUT4的表達或活性下降是導致機體胰島素抵抗的重要分子機制[4]。囊泡相關可溶性N-乙酰基亞胺敏感因子附著蛋白受體(vescical-souble N-ethymaleimide sensitive factor attachment proteins receptor, v-SNAREs)在GLUT4囊泡的轉運過程中起著非常關鍵的作用。
二甲雙胍(Met)是2型糖尿病治療的基石藥物,但其作用機制尚未完全闡明。研究證實,Met可以促進GLUT4的表達,也可以調控GLUT4的轉位和內吞[5-10]。主流觀點認為Met是AMPK的天然激活劑,研究表明,Met主要經由AMPK信號途徑對GLUT4轉運進行調控,進而改善胰島素抵抗[9-11]。深入的研究表明,Met對脂肪細胞GLUT4轉運的調控可通過某些v-SNAREs介導完成[12-13]。v-SNAREs的主要蛋白為囊泡相關膜蛋白(vesicle associated membrane proteins,VAMPs)亞家族,目前共鑒定了7種亞型即VAMP1、VAMP2、VAMP3、VAMP4、VAMP5、VAMP7、VAMP8[14]。本課題組前期研究也觀察到在人網膜成熟脂肪細胞,Met可以通過調節VAMPs的表達而參與調控GLUT4 轉運[15]。心肌細胞經Met長時間作用下(18 h)可以通過AMPK途徑顯著改善GLUT4的轉運,提示延長作用時間可以更有效地發揮Met的作用[10]。因此推斷將Met長時間作用于3T3-L1前脂肪細胞的誘導分化過程,也可以改善脂肪細胞GLUT4的轉運,且v-SNAREs在這一過程中扮演著重要角色。本研究將Met作用于3T3-L1前脂肪細胞的誘導分化階段,比較脂肪細胞成脂分化成熟后GLUT4、AMPK、VAMPs的mRNA表達水平,旨在探索Met在誘導分化階段對v-SNAREs的影響。
1 材料與方法
1.1 實驗試劑 美國Gibco公司的DMEM高糖培養基、雙抗;賽業生物科技有限公司的小鼠脂肪間質干細胞成脂誘導培養基A液和B液、油紅O染料;上海博士德的磷酸鹽緩沖液(PBS)、胰酶;美國Sciencell公司的胎牛血清(FBS);美國Sigma公司的Met;上海生物工程技術服務有限公司的PCR試劑盒;美國Invitrogen公司的Trizol RNA提取液。
1.2 實驗方法
1.2.1 3T3-L1前脂肪細胞的培養及傳代 購買3T3-L1前脂肪細胞(中國科學院的上海細胞庫);將3T3-L1前脂肪細胞培養于DMEM高糖培養基(含10%FBS、1%雙抗),置于細胞培養箱(37 ℃、5%CO2)內,間隔2~3 d換培養液,待細胞長滿80%時進行傳代。傳代時棄掉原培養基,用PBS沖洗2次,然后加入胰酶(1 mL),2 min后終止消化,吹打均勻后移至離心管離心3 min(離心1 000 r/min)。離心后棄上清,加入1 mL完全培養基,吹打均勻,依照2×104個/cm2的密度于新培養瓶內接種,重復上述培養步驟。
1.2.2 3T3-L1前脂肪細胞的成脂誘導 3T3-L1前脂肪細胞在培養瓶內培養,待細胞生長的融合度達80%~90%時,依照上述步驟,6孔板中以2×104個/cm2的密度接種,繼續培養。待6孔板的細胞融合度達到100%或過融合時,開始加入小鼠脂肪間質干細胞成脂誘導培養基誘導,交替給予A液2 mL誘導培養72 h(3 d),和B液2 mL誘導培養24 h(1 d),共交替3個周期(12 d)。
1.2.3 油紅O鑒定 6孔板中成脂誘導結束后,吸棄培養基,予以PBS沖洗2次,每孔加4%甲醛液(2 mL)固定,30 min。吸棄甲醛液,予以PBS沖洗2次,每孔加油紅O染液(1 mL)染色,30 min。吸棄油紅O染液,予以PBS沖洗2次,將6孔板置于相差顯微鏡下觀察成脂情況。成熟的脂肪細胞可見細胞質內染紅的脂滴,呈串珠狀排列,提示誘導成功。
1.2.4 分組與干預方法 依照加入的Met終濃度分為0 mmol/L、0.5 mmol/L、1 mmol/L、2 mmol/L 4組,每組3個復孔。將3T3-L1前脂肪細胞于6孔板接種培養,待細胞融合度達到100%或過融合時,分別在誘導分化階段(12 d)持續加入成脂誘導培養基(A液或B液)1 960 μL和與終濃度相對應的Met液40 μL。
1.2.5 細胞mRNA的收集 將待測定細胞吸棄原培養基,每孔中加入TrizolRNA提取液0.5 mL,使細胞充分裂解后,移入2 mL的凍存管,置于液氮中凍存(-196 ℃),以備后續檢測。
1.2.6 RT-PCR檢測
1.2.6.1 引物設計 所有引物均由上海生工設計,軟件使用Primer Premier 5.0,β-actin為內參基因。詳見表1。

表1 基因引物序列
1.2.6.2 cDNA的合成 11 μL總RNA(1 μg),1 μL Random Primer p(dN)6(0.2 μg/mL),65 ℃孵育5 min;4 μL 5×Reaction Buffer,3 μL dNTP(10 mmol),1 μL RNA酶抑制劑(20 U/μL)和1 μL逆轉錄酶(20 U/μL),孵育:25 ℃10 min,42 ℃60 min,72 ℃15 min。
1.2.6.3 熒光定量PCR檢測 10 μLSYBR Green Master (ROX),0.5 μL Forward引物(15 μmol), 0.5 μL Reverse 引物(15 μmol),2 μL cDNA,7 μL DNase/RNase-free的ddH2O,共合計20 μL。反應條件:95 ℃10 min,活化Tag酶;95 ℃15 s,60 ℃60 s,共循環40次。
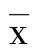
2 結 果
2.1 不同濃度Met對成脂分化的影響 在誘導分化過程中持續給予0 mmol/L、0.5 mmol/L、1、2 mmol/L Met,經3周期誘導分化成脂后,經油紅O染色后,經Met干預后,0 mmol/L、0.5 mmol/L、1 mmol/L 3組無明顯變化,2 mmol/L染色明顯變淺。詳見圖1~圖4。

圖1 Met 0 mmol/L組(×250)

圖2 Met 0.5 mmol/L組(×250)

圖3 Met 1 mmol/L組(×250)

圖4 Met 2 mmol/L組(×250)
2.2 不同濃度Met對AMPK、GLUT4、VAMPs、mRNA表達的影響 比較不同組間AMPK、VAMP4、VAMP7 mRNA水平,差異無統計學意義(P>0.05)。4組間GLUT4 mRNA存在差異,進一步行LSD檢驗,1 mmol/L組較0 mmol/L組升高,且差異有統計學意義(P<0.05),2 mmol/L組較1 mmol/L組降低有統計學意義(P<0.05)。4組間VAMP2、VAMP3、VAMP5、VAMP8 mRNA比較差異有統計學意義(P<0.05),進一步行LSD檢驗:①與0 mmol/L組相比,0.5 mmol/L組VAMP2、VAMP 3、VAMP 8 mRNA水平比較差異無統計學意義(P>0.05);②與0 mmol/L組相比,1 mmol/L組VAMP2、VAMP3、VAMP8 mRNA水平升高,差異有統計學意義(P<0.05);③與1 mmol/L組相比,2 mmol/L組VAMP2、VAMP3、VAMP5、VAMP8 mRNA水平降低,差異有統計學意義(P<0.05);④與0 mmol/L組相比,0.5 mmol/L組、2 mmol/L組VAMP5 mRNA表達水平降低(P<0.05)。詳見表2。
3 討 論
多個國家的糖尿病診治指南中均推薦Met作為2型糖尿病病人控制血糖的一線用藥和聯合用藥中的基本用藥[1, 16]。充分的證據表明Met增強胰島素敏感性的作用是通過激活AMPK實現的,Met實際上是一種天然的AMPK激活劑[12-13]。既往研究表明,Met可以通過AMPK途徑調節GLUT4轉運[11],但是至今尚未完全闡明GLUT4轉運各步驟的具體分子調控機制。
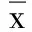
表2 不同濃度Met對脂肪細胞AMPK、GLUT4、VAMPs mRNA表達的影響(±s)
與0 mmol/L組比較,1)P<0.05; 與1 mmol/L組比較,2)P<0.05
近年來的研究證實VAMPs為GLUT4轉運過程中所必不可少的v-SNAREs蛋白家族,但VAMPs家族中各亞型在調控過程的具體作用頗有爭議,各亞型之間的作用是相對獨立還是可以相互替代,各實驗結論并不一致,可能與在不同模型、不同刺激條件下的探索有關[17-18]。研究表明,VAMP2是介導GLUT4轉運的主要v-SNAREs蛋白,對胰島素刺激下的GLUT4儲存囊泡胞吐過程尤為重要[19-22]。多數研究支持VAMP2在GLUT4轉運過程中是不可或缺的[17, 23],但也有研究發現VAMP2可以被VAMP3或VAMP8所取代[18, 23]。在L6肌細胞中也觀察到VAMP2參與調節胰島素刺激下的GLUT4內吞過程[22]。VAMP3主要定位于不同階段的內體,通常觀點認為VAMP3介導了非胰島素刺激下的GLUT4轉運[24-25],但是在胰島素抵抗模型中發現,VAMP3也參與了胰島素刺激下的GLUT4轉運,然而此作用必須持續依賴于VAMP2介入[26]。VAMP3可能調控GLUT4從早期內體向反面高爾基體網絡(TGN)的轉運[27]。VAMP8作用廣泛,在多種細胞器上均可發現,研究表明,VAMP8的作用是介導了GLUT4的內吞[20, 28],基因敲除VAMP8的脂肪細胞,明顯減弱GLUT4的內吞作用[20],從而使保留在細胞膜上的GLUT4增多,對葡萄糖攝取有促進作用。
脂肪組織是調控整體能量代謝的重要器官,脂肪細胞GLUT4轉運的調控是機體控制葡萄糖的重要機制[29]。本實驗在3T3-L1前脂肪細胞的誘導分化過程中分別持續給予不同濃度的Met干預,研究結果顯示Met可以作用于前脂肪細胞的誘導分化過程,1 mmol/L可能是Met在3T3-L1前脂肪細胞調控GLUT4的最大作用濃度,在1 mmol/L濃度范圍內,隨著Met濃度增加,可以上調脂肪細胞中GLUT4 mRNA的表達,呈現出一定的劑量依賴效應。同時,Met呈劑量依賴性的上調脂肪細胞中VAMP2、VAMP3、VAMP8 mRNA的表達,提示Met可以促進脂肪細胞GLUT4轉運,v-SNAREs可能參與了Met對GLUT4轉運的調控。然而當Met濃度達到2 mmol/L時,反而下調GLUT4、VAMP2、VAMP3、VAMP5、VAMP8 mRNA的表達,推測與成熟脂肪細胞數量相對不足有關。因為油紅O染色的結果提示高濃度的Met可能抑制3T3-L1前脂肪細胞的成脂分化,這與王慧等[30]的研究相類似。VAMP2、VAMP3、VAMP8在GLUT4存儲囊泡上均有發現,脂肪細胞同時敲除 VAMP2、VAMP3、VAMP8 的3個亞型基因,可完全抑制胰島素誘導的 GLUT4轉運[18],提示VAMP2、VAMP3、VAMP8在調節GLUT4囊泡胞吐時具有至關重要的地位。當然VAMP3、VAMP8 亦介導非胰島素刺激下的GLUT4轉運。觀察到Met在3T3-L1脂肪細胞誘導成熟階段可以促進VAMP2、VAMP3、VAMP8的表達,但調控GLUT4轉運的具體意義有待進一步明確。
在本研究中,不同濃度的Met并未影響AMPK的mRNA表達量,提示Met在誘導分化過程中可能通過促進AMPK的磷酸化,或者通過AMPK以外的其他途徑影響v-SNAREs調控GLUT4轉運。
在成脂誘導階段持續予以Met處理,可以促進脂肪細胞GLUT4 mRNA的表達,Met對GLUT4轉運的調控可能與其對v-SNAREs亞家族成員表達的調節相關,1 mmol/L可能為最大作用濃度,在1 mmol/L內其作用效果呈一定的濃度依賴性。此研究將為Met在調控GLUT4轉運中的具體作用機制提供理論依據。

