新型PPARα激動劑(E)-4-氯苯氧苯丙烯酸衍生物的合成及降血脂活性研究
陳小兵,黃麗蕓,許 軍,袁章林,凌志杰,林麗娟,彭 紅
(1.贛南衛生健康職業學院,江西 贛州 341000;2.江西中醫藥大學 藥學院,江西 南昌 330004)
PPARα是過氧化物酶體增殖激活受體( peroxisome proliferator-activated receptors,PPARs)家族中重要的亞型之一,PPARs包括PPARα、PPARβ 和 PPARγ 3 種亞型[1]。PPARα激動劑是目前臨床上常用的降血脂藥物,其生理功能的發揮主要是依靠調節靶基因的啟動子來實現基因轉錄[2],其降血脂機制是主要參與肝臟、腎臟以及心肌等組織器官中游離脂肪酸的氧化[1]。當PPARα被激動劑激活,可導致高密度脂蛋白水平增加,同時增加脂蛋白脂酶的表達,減少載脂蛋白C Ⅲ的表達,以降低血漿中低密度脂蛋白和甘油三酯水平等生理功能[3-4]。本研究從對新型PPARα激動劑對氯苯氧丁酸甲氧基苯丙酸酯的結構改造與降血脂活性的關系出發,通過整合組合化學策略以及運用CADD輔助新藥開發的計算機虛擬篩選技術,設計出新型的PPARα激動劑(E)-4-氯苯氧苯丙烯酸衍生物。
新藥對氯苯氧丁酸甲氧基苯丙酸酯是阿魏酸的衍生物,是具有降血脂活性的全新化合物[5],其降血脂的機制是通過降低大鼠體內的極低密度脂蛋白的生物合成,促使極低密度脂蛋白的生物降解導致甘油三酯的減少以及促使大鼠體內膽固醇的水解與轉移[6]。中藥阿魏酸具有降血脂、延緩衰老、抗炎、抗血栓形成以及調節人體免疫功能等作用[7-11]。但由于阿魏酸分子結構中含有烯烴且烴鏈較短,其親水性較強,親酯性弱難以深入脂質雙層發揮生理作用,故將阿魏酸結構中的酚羥基和羧基進行設計與活性口袋互補進行結構改造和活性篩選,改變阿魏酸難于通過膜的脂質雙分子層的局限性。新藥對氯苯氧丁酸甲氧基苯丙酸酯由中藥活性成分阿魏酸和化學降血脂藥對氯苯氧異丁酸通過酯化反應而成[5],其結構也通過各種波譜數據進行了確證報道[12]。但在前期研究中,筆者發現對氯苯氧丁酸苯丙烯酸以阿魏酸為原料合成的收率不高且其降血脂的活性并不是很強,故打算改變合成路徑以及將它作為先導化合物,將其結構再進行修飾,將結構中羧基轉化成酯類和酰胺類,期望得到活性更高、毒性更低的(E)-4-氯苯氧苯丙烯酸衍生物。課題組通過化合合成的方式,將先導化合物分別與飽和醇、脂環醇、芳香醇和雜環醇成酯,與脂肪胺、脂環胺、芳香胺和雜環胺成酰胺總共合成了10個未見文獻報道的(E)-4-氯苯氧苯丙烯酸衍生物,并對這10個不同類型的衍生物進行了降血脂活性考察,發現目標化合物2b,2e,3b,3d,3e具有明顯的降血脂活性。
1 實驗
1.1 儀器
FTIR-650傅里葉變換紅外光譜儀(KBr壓片,天津港東科技股份有限公司),ARX-300型核磁共振儀(內標物:TMS,瑞士Bruker公司),LCMS-IT-TOF質譜儀(SHIMADZU/島津),電熱數顯恒溫水浴鍋(HH-6,常州蒙特儀器制造有限公司),ZF-20D暗箱三用紫外分析儀(上海越眾儀器設備有限公司),JC-JJ-WS數顯增力電動攪拌器(青島聚創環保設備有限公司),101-4數顯鼓風干燥箱(上海滬粵明科學儀器有限公司),X5顯微熔點測定儀(溫度計讀數未校正,鞏義市科瑞儀器有限公司),循環水真空泵(鄭州市亞榮儀器有限公司)。
1.2 試劑
香草醛、3-胺乙基氧雜環丁烷(分析純,中國醫藥(集團)上海化學試劑公司),對氯苯氧異丁酸、2-茴香胺(分析純,上海邦成化工有限公司),苯磺酰氯、環丙基甲胺(分析純,上海久山化工有限公司),吡啶(分析純,汕頭市西隴化工有限公司),苯胺(分析純,汕頭市西隴化工有限公司),乙醇、乙胺(分析純,中國醫藥(集團)上海化學試劑公司),金剛烷醇、金剛烷胺(分析純,上海冠導生物工程有限公司),苯氧乙醇、3-吡咯烷醇(分析純,湖北信康醫藥化工有限公司)。
1.3 試驗用大鼠及其他試劑
SD種大鼠,SPF級,雌雄各半,體重110~120 g,由江西中藥大學實驗動物中心提供,動物合格證號:SCXK(贛)2017-0003。其他試劑為分析純,市售。
1.4 合成實驗
先導化合物(1)以對氯苯氧異丁酸、香草醛為原料采用酰氯法、酸酐法、Doebner反應等將先導化合物中羧酸基團與苯磺酰氯生成酰氯,然后再與酚醇反應生成酯,再經Doebner反應[13-15]合成得到。通過先導化合物對氯苯氧異丁酸甲氧基苯丙烯酸酯(1)制備10個酯類和酰胺類新型的PPARα激動劑(E)-4-氯苯氧苯丙烯酸衍生物,所有化合物的結構經1HMNR、元素分析及 MS分析確證,目標化合物的理化常數見表1。目標化合物的合成路線見圖1。

表1 目標化合物理化性質及元素分析

圖1 目標化合物合成路線
1.4.1 先導化合物對氯苯氧異丁酸甲氧基苯丙烯酸酯(1)的制備 將對氯苯氧異丁酸10.7 g(50 mmol)溶于100 mL無水吡啶中,加入到安裝有冷凝回流器和廢氣處理的三口燒瓶中。在冰浴(0~5 ℃)條件下,緩慢滴加6.4 mL(17.7 g,50 mmol)的苯磺酰氯,滴畢,室溫條件下繼續反應1 h后,繼續向反應器中滴加30 mL溶有7.6 g(50 mmol)香草醛的無水吡啶溶液,滴畢,滴加幾滴苯胺溶液。室溫條件下反應4 h后,再加入丙二酸5.2 g(50 mmol)于80~90 ℃條件下回流8 h,反應完成后將反應液倒入含50 mL濃鹽酸的200 g冰水中,溶液顯現為淡黃色,靜置片刻,燒杯內壁及底部出現淡黃色結晶狀物質。靜置2 h后,抽濾,濾餅用體積分數4%的NaOH水溶液洗滌5次(每次100 mL),再用蒸餾水洗滌5次(每次100 mL)至中性,干燥后的粗品先后用體積分數70%和95%的乙醇重結晶,得到淡白色結晶體狀化合物。烘干,研碎得到白色粉末11.4 g,收率58.5%。測其熔點為143~144 ℃。化合物結構的光譜數據與文獻報道基本一致[12],確證為對氯苯氧異丁酸甲氧基苯丙烯酸酯(1)。
1.4.2 對氯苯氧異丁酸甲氧基苯丙烯酸酯(2a-2e)的制備 將對氯苯氧異丁酸甲氧基苯丙烯酸酯(1)7.8 g(20 mmol)溶于50 mL無水吡啶中,加入到安裝有冷凝回流器和廢氣處理的三口燒瓶中。在冰浴(0~5 ℃)條件下,緩慢滴加2.6 mL(20.3 g,20 mmol)的苯磺酰氯,滴畢,室溫條件下繼續反應1 h后,繼續向反應器中滴加5 mL溶有25 mmol乙醇(金剛醇、吡咯烷醇、環氧醇、苯氧乙醇)的無水吡啶溶液,滴畢,滴加幾滴苯胺溶液。室溫條件下反應4 h后,將反應液倒入含20 mL濃鹽酸的100 g冰水中,溶液顯現為淡黃色,靜置片刻,燒杯內壁及底部出現淡黃色結晶狀物質。靜置2 h后,抽濾,濾餅用體積分數4%的NaOH水溶液洗滌5次(每次100 mL),再用蒸餾水洗滌5次(每次100 mL)至中性,干燥后的粗品用體積分數70%和95%的乙醇重結晶,得到目標化合物2a-2e。
2a:收率:35.9%。分子式:C23H25ClO6,mp130~131 ℃。IR (KBr)光譜顯示:C=O的吸收峰在1 609、1 658 cm-1處。苯環吸收峰:1 621、1 515、1 439、1 207、1 054、911、821、807 cm-1。EI-MS:m/z 432[M]+。1H-NMR(CDCl3,300 MHz)δ:1.01(d,3 H),1.58(s,6 H,J=7.8 Hz),1.65(m,2 H),3.89(s,3 H,J=7.8 Hz),4.31(d,2 H),6.42(d,1 H,J=7.9 Hz),6.77(dd,2 H),6.81(s,1 H,J=7.8 Hz),6.91(d,1 H),7.25(d,2 H,J=7.9 Hz),7.93(d,1 H)。
2b:收率:41.8%。分子式:C30H33ClO6,mp211~212 ℃。IR (KBr)光譜顯示:在1 609、1 712 cm-1處有兩個C=O吸收峰。苯環吸收峰:1 796、1 711、1 659、1 581、1 168、955、856、754 cm-1。其中,在856、754 cm-1的C-H彎曲振動提示分子中存在苯環的 1,4-二取代。EI-MS:m/z 524[M]+。1H-NMR(CDCl3,300 MHz)δ:1.21~2.01(d,12 H),1.45(m,3 H),1.63(s,6 H,J=7.9 Hz),3.91(s,3 H,O-H),6.68~7.04(d,6 H),7.23(d,2 H,J=7.9 Hz),7.72(d,1 H)。
2c:收率:22.1%。分子式:C24H26ClNO6,mp175~177 ℃。IR (KBr)光譜顯示:在1 611、1 663 cm-1處有C=O的吸收峰。苯環吸收峰:1 638、1 621、1 545、1 530、1 328、1 209、1 043、956、804 cm-1。EI-MS:m/z 459[M]+。1H-NMR(CDCl3,300 MHz)δ:1.63(s,6 H,J=8.0 Hz),1.98(m,2 H),2.18(s,1 H,N-H,J=8.0 Hz),2.75(d,2 H),2.91(d,2 H),3.89(s,3 H,J=7.8 Hz),4.08(dd,1 H),6.39(d,1 H,J=8.0 Hz),6.75(d,2 H),6.79(s,1 H,J=8.0 Hz),6.84(d,1 H),6.89(d,1 H),7.22(d,2 H,J=7.8 Hz),7.89(d,1 H)。
2d:收率:30.8%。分子式:C23H23ClO7,mp112~113 ℃。IR (KBr)光譜顯示:在1 606、1 682 cm-1處有C=O的吸收峰。苯環吸收峰:1 644、1 619、1 539、1 528、1 325、1 218、1 051、955、805 cm-1。EI-MS:m/z 446[M]+。1H-NMR(CDCl3,300 MHz)δ:1.69(s,6 H,J=7.8 Hz),3.95(s,3 H,O-H),4.91(d,2 H),5.11(d,2 H),5.31(m,1 H),6.45(d,1 H),6.81(d,2 H),6.71(d,1 H,J=8.0 Hz),6.74(d,2 H),6.98(d,1 H),7.22(d,2 H,J=8.0 Hz)。
2e:收率:37.6%。分子式:C23H23ClO7,mp230~232 ℃。IR (KBr)光譜顯示:在1 612、1 691 cm-1處有C=O的吸收峰。苯環吸收峰:2 945、1 761、1 691、1 651、1 595、904、856、771 cm-1。其中,在856、771 cm-1的C-H彎曲振動提示分子中存在苯環的 1,4-二取代。EI-MS:m/z 510[M]+。1H-NMR(CDCl3,300 MHz)δ:1.67(s,6 H,J=8.0 Hz),3.89(s,3 H,O-H),4.34(d,2 H),4.63(d,2 H,J=8.0 Hz),6.41(d,1 H),6.72(d,1 H),6.79(d,2 H),6.82(d,1 H,J=7.8 Hz),6.89(d,1 H),7.19(d,2 H,J=7.8 Hz),7.83(d,1 H,J=8.0 Hz)。
1.4.3 對氯苯氧異丁酸甲氧基苯丙烯酸酰胺(3a-3e)的制備 將對氯苯氧異丁酸甲氧基苯丙烯酸酯(1)2.5 g(6.4 mmol)溶于10 mL無水吡啶中,加入到安裝有冷凝回流器和廢氣處理的三口燒瓶中。在冰浴(0~5 ℃)條件下,緩慢滴加0.8 mL(2.2 g,6.4 mmol)的苯磺酰氯,滴畢,室溫條件下繼續反應1 h后,繼續向反應器中滴加5 mL溶有6.4 mmol乙胺(環丙胺、環氧乙胺、金剛烷胺、茴香胺)的無水吡啶溶液。常溫下反應12 h后,將反應液倒入100 g冰水中,溶液顯現為淡黃色,靜置片刻,燒杯內壁及底部出現淡黃色結晶狀物質。靜置2 h后,抽濾,濾餅用體積分數1%的鹽酸溶液洗滌3次,再用蒸餾水洗滌3次至中性,干燥后的粗品用乙醇、丙酮混合液重結晶,得到目標化合物3a-3e。
3a:收率:26.4%。分子式:C23H26ClNO5,mp185~186 ℃。IR (KBr)光譜顯示:在1 608、1 715 cm-1處有C=O的吸收峰。苯環吸收峰:1 758、1 689、1 657、1 591、1 211、911、847、789 cm-1。其中,在847、789 cm-1的C-H彎曲振動提示分子中存在苯環的 1,4-二取代。EI-MS:m/z 431[M]+。1H-NMR(CDCl3,300 MHz)δ:1.09(d,3 H,J=7.8 Hz),1.57(m,2 H),1.63(s,6 H,J=7.8 Hz),2.99(m,2 H),3.76(s,3 H,O-H),6.73(d,2 H),6.79(s,1 H),6.85(d,1 H,J=8.0 Hz),6.88(d,1 H),7.08(d,1 H),7.21(d,2 H,J=8.0 Hz),7.61(d,1 H,J=7.8 Hz),8.24(d,1 H,N-H,J=7.8 Hz)。
3b:收率:10.2%。分子式:C23H24ClNO5,mp163~165 ℃。IR (KBr)光譜顯示:在1 613、1 709 cm-1處有兩個C=O吸收峰。苯環吸收峰:1 785、1 701、1 664、1 589、1 208、906、852、781 cm-1。其中,在852、781 cm-1的C-H彎曲振動提示分子中存在苯環的1,4-二取代。EI-MS:m/z 429[M]+。1H-NMR(CDCl3,300 MHz)δ:0.31~0.61(m,4 H),1.66(s,6 H,J=8.0 Hz),2.42(m,1 H),3.85(s,3 H,O-H),6.71~6.99(d,6 H),7.21(d,2 H,J=7.8 Hz),7.66(d,1 H,J=8.0 Hz),8.22(d,1 H,N-H,J=8.0 Hz)。
3c:收率:21.8%。分子式:C25H28ClNO6,mp151~152 ℃。IR (KBr)光譜顯示:在1 616、1 711 cm-1處有兩個C=O吸收峰。苯環吸收峰:1 796、1 689、1 657、1 586、1 211、911、856、775 cm-1。其中,在856、775 cm-1的C-H彎曲振動提示分子中存在苯環的 1,4-二取代。EI-MS:m/z 473[M]+。1H-NMR(CDCl3,300 MHz)δ:1.51(m,2 H),1.67(s,6 H,J=7.8 Hz),2.82(m,1 H),3.11(d,2 H),3.81(s,3 H,O-H,J=7.8 Hz),4.62(d,2 H),5.02(d,2 H),6.69~7.11(d,6 H),7.19(d,2 H,J=8.0 Hz),7.68(d,1 H,J=7.8 Hz),8.19(d,1 H,N-H,J=7.8 Hz)。
3d:收率:49.5%。分子式:C30H34ClNO5,mp201~202 ℃。IR (KBr)光譜顯示:在1 612、1 711 cm-1處有兩個C=O吸收峰。苯環吸收峰:1 789、1 707、1 662、1 575、1 191、953、848、755 cm-1。其中,在848、755 cm-1的C-H彎曲振動提示分子中存在苯環的 1,4-二取代。EI-MS:m/z 523[M]+。1H-NMR(CDCl3,300 MHz)δ:1.41~2.19(d,12 H),1.47(m,3 H),1.64(s,6 H),3.85(s,3 H,O-H),6.59~7.01(d,6 H,J=7.9 Hz),7.18(d,2 H,J=8.0 Hz),7.59(d,1 H),8.15(d,1 H,N-H,J=7.9 Hz)。
3e:收率:39.5%。分子式:C27H26ClNO6,mp255~256 ℃。IR (KBr)光譜顯示:在1 612、1 708 cm-1處有兩個C=O吸收峰。苯環吸收峰:1 796、1 689、1 657、1 586、1 211、911、856、775 cm-1。其中,在856、775 cm-1的C-H彎曲振動提示分子中存在苯環的 1,4-二取代。EI-MS:m/z 473[M]+。1H-NMR(CDCl3,300 MHz)δ:1.65(s,6 H,J=8.0 Hz),3.78(s,6 H,O-H,J=8.0 Hz),6.58~7.03(d,10 H),7.25(d,2 H,J=8.0 Hz),7.59(d,1 H,J=8.0 Hz),8.24(d,1 H,N-H)。
2 結果與討論
2.1 反應時間、介質及催化劑對產率的影響
考察先導化合物對氯苯氧異丁酸甲氧基苯丙烯酸酯的合成試驗中反應時間、介質以及催化劑等三方面因素對產率的影響,以得到最佳的反應條件。通過參照相關文獻[16],選出4種合成工藝進行考察。分別為:(1)催化劑苯胺和介質二氯甲烷,反應時間6 h;(2)催化劑哌啶及介質吡啶和苯,反應時間3 h;(3)催化劑苯胺及介質吡啶和苯,反應時間6 h;(4)催化劑哌啶及介質吡啶和苯,反應時間12 h。通過工藝考察發現,堿性介質對催化反應的產率影響較大,苯作為帶水劑除去反應過程中形成的水,也可大副提高產率。哌啶與苯胺做催化劑,反應都能發生,但哌啶作為催化劑,反應時間對產率影響不大,產率比苯胺低好多。故在實驗方法中選擇工藝3。考察結果見表2。

表2 反應時間、介質及催化劑對產率的影響
2.2 目標化合物的降血脂活性
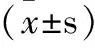


化合物TC mmol·L-1TG mmol·L-1LDL-C mmol·L-1HDL-C mmol·L-1111.28±0.242.63±0.432.18±0.191.54±0.38BG1.89±0.242.15±0.361.05±0.471.14±0.292a11.32±0.75??2.68±0.44??△△2.21±0.47△△1.55±0.12△△2b9.51±0.38??2.18±0.48??△1.94±0.16△△1.21±0.14??2c11.37±0.55??2.71±0.38??△2.24±0.21△△1.61±0.11△2d12.01±0.56??2.68±0.21??△2.25±0.45△△1.71±0.28△2e9.81±0.52??2.23±0.24??△2.09±0.64△△1.34±0.23?△△3a12.15±0.53??2.84±0.25??△2.25±0.46△△1.57±0.18△3b10.08±0.42??2.34±0.45??△2.05±0.71△△1.26±0.24??3c12.09±0.41??3.12±0.38??△2.54±0.18△△1.61±0.31△3d9.75±0.16??2.21±0.42??△1.97±0.22△△1.22±0.47?△△3e9.84±0.18??2.24±0.29??△2.11±0.34△△1.33±0.29??
注:與1組比較,*P<0.05,**P<0.01;與空白對照組(BG)相比△P<0.05,△△P<0.01。
由表3可看出,與先導化合物組比較,2b,2e,3b,3d,3e組高脂血癥模型大鼠血清中TC、TG、LDL-C和HDL-C的含量均降低,差異具有統計學意義(P<0.01)。其他5個化合物則與先導化合物降血脂活性相當,差異無統計學意義(P>0.05)。結果表明,目標化合物2b,2e,3b,3d,3e在降血脂活性上比先導化合物強,其降血脂機制可能通過對先導化合物的結構修飾得到的新型PPARα激動劑增加了藥物的脂溶性,并通過減少肝臟極低密度脂蛋白(VLDL)的合成和分泌來有效降低血中的LDL-C、TG和TC水平。課題組將進一步對這5個目標化合物的降血脂機制深入研究,以獲取降脂活性更好的化合物。
3 結論
設計合成了10個新型的PPARα激動劑(E)-4-氯苯氧苯丙烯酸衍生物,合成實驗結果表明,該設計合成方法適合用于由小分子的有機酸合成大分子酯類化合物和酰胺胺類,且改進后的合成工藝實驗條件溫和,收率較高。目標化合物降血脂活性研究表明:合成得到的化合物2b,2e,3b,3d,3e比先導化合物的降脂活性更強,其降血脂機制可能與這5個化合物增加了先導化合物的脂溶性有關,今后將進一步深入研究其降脂活性的機制。

