學(xué)生“離子觀”淡薄成因分析以及解決策略
張瑋 張軍
摘要:離子是構(gòu)成物質(zhì)的微粒之一,形成“離子觀”是學(xué)生建立“微粒觀”的重要輔助,學(xué)生“離子觀”淡薄,難以以“離子”的視角去分析解決一些問題,所以很難將“離子反應(yīng)”“化學(xué)鍵”等知識(shí)作為背景知識(shí)去解決化學(xué)中的其他一些問題。作者以“電離”“離子反應(yīng)”“化學(xué)鍵”為知識(shí)栽體逐步建立學(xué)生的“離子觀”。
關(guān)鍵詞:離子觀;宏微結(jié)合;證據(jù)推理;符號(hào)表征
文章編號(hào):1008-0546(2019)10-0039-03 中圖分類號(hào):G632.41 文獻(xiàn)標(biāo)識(shí)碼:B
doi:10.3969/j.issn.1008-0546.2019.10.010
一、提出問題
在《必修二》教學(xué)化學(xué)鍵后,一次課上讓學(xué)生判斷構(gòu)成物質(zhì)的微粒類別,很多同學(xué)脫口而出NaCl分子,其判斷的依據(jù)就是只要能寫出化學(xué)式的物質(zhì)就是分子,這說(shuō)明學(xué)生“離子觀”很淡薄。在后續(xù)教學(xué)中發(fā)現(xiàn)學(xué)生“離子觀”淡薄還體現(xiàn)在:認(rèn)為在CH3COOH溶液中,加入NaOH固體會(huì)使CH3COOH的電離平衡逆向移動(dòng),原因就是NaOH和CH3COOH反應(yīng),消耗CH3COOH使電離平衡逆向移動(dòng);對(duì)于多電解質(zhì)溶液中,難以以電解質(zhì)在溶液中反應(yīng)的本質(zhì)去分析反應(yīng)過程,所以對(duì)一些基于真實(shí)情境的工藝流程、原電池相關(guān)的問題很難順利解決。
多方求證,現(xiàn)總結(jié)原因如下:1.初中教學(xué)微粒時(shí),更多關(guān)注的是分子、中性原子,中考中也更多考查由分子形成的物質(zhì),所以學(xué)生形成思維定勢(shì),看到化學(xué)式就認(rèn)為是分子;一些化合物的導(dǎo)電性實(shí)驗(yàn)在大多數(shù)學(xué)校并沒有做,沒有抓住由宏觀現(xiàn)象探析微觀結(jié)構(gòu)的契機(jī),從而錯(cuò)過了形成“離子觀”萌芽的良好時(shí)機(jī);初中化學(xué)教學(xué)使學(xué)生形成一個(gè)深刻觀念:分子是保持物質(zhì)化學(xué)性質(zhì)的最小粒子,但初中教學(xué)沒有強(qiáng)化這應(yīng)該是針對(duì)由分子構(gòu)成的物質(zhì)。2.高中階段離子反應(yīng)、化學(xué)鍵教學(xué)中沒有將養(yǎng)成學(xué)生的“離子觀”作為重點(diǎn)之一,而將教學(xué)重點(diǎn)更多放在離子方程式書寫、正誤判斷、離子共存、化學(xué)鍵概念、電子式書寫等應(yīng)試內(nèi)容上,沒有形成相應(yīng)觀念,造成后續(xù)很多知識(shí)只能靠死記硬背。
二、“離子觀”建立的條件
化學(xué)研究的對(duì)象是物質(zhì),是從微觀的角度認(rèn)識(shí)物質(zhì)及其變化的科學(xué),“微粒觀”是中學(xué)化學(xué)的核心觀念。離子是組成物質(zhì)的微粒之一,與原子、分子同屬于微觀粒子,建立學(xué)生的“離子觀”是形成學(xué)生“微粒觀”的重要輔助,我認(rèn)為學(xué)生只要能達(dá)到兩點(diǎn)即可認(rèn)為具備了“離子觀”:1.理解電解質(zhì)在溶液中的行為,包括認(rèn)可部分溶液中存在離子、知道離子來(lái)源于哪里Ⅲ、理解電解質(zhì)在溶液中反應(yīng)的本質(zhì)過程;2.能理解離子化合物的微觀結(jié)構(gòu),且能以一些宏觀現(xiàn)象作為證據(jù)推理該物質(zhì)為離子化合物。“離子觀”貫穿高中化學(xué)學(xué)習(xí)全過程,在高中教學(xué)中涉及到“離子觀”的知識(shí)有:離子反應(yīng)、化學(xué)鍵、弱電解質(zhì)的電離平衡、電化學(xué)等,在必修階段離子反應(yīng)、化學(xué)鍵對(duì)離子觀的建立起著承上啟下的作用。
1.《離子反應(yīng)》教學(xué)建立學(xué)生溶液中的離子觀
《離子反應(yīng)》教學(xué)是離子觀建立的重中之重,《離子反應(yīng)》教學(xué)如何來(lái)建立學(xué)生的離子觀呢?教學(xué)中必須強(qiáng)化兩點(diǎn):①電離;②離子反應(yīng)的本質(zhì)。
(1)《電離》教學(xué)初步建立溶液中的“離子觀”
[過程1]通過生活案例建立溶液中存在離子的初步印象
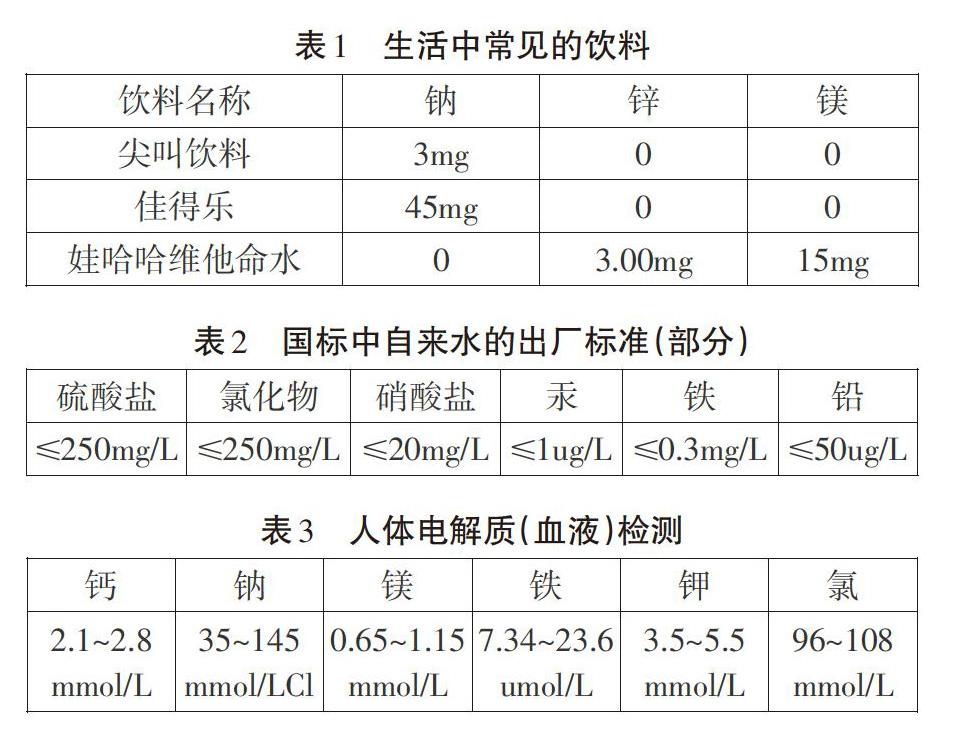
在《電離》教學(xué)中首先展示生活中的一些實(shí)際案例(表1-3)。
在離子反應(yīng)教學(xué)前,學(xué)生對(duì)于“離子”的認(rèn)識(shí)很少,主要來(lái)源于初中對(duì)部分化合物的機(jī)械記憶,如NaCl由Na+和C1-組成,但是換成KCl可能就行不通了,所以在教學(xué)中首先選擇生活中真實(shí)存在的案例,多數(shù)學(xué)生能意識(shí)到表中元素以離子的形式存在于溶液中,這種“從生活中來(lái)”的“前知識(shí)”很容易被接受、被提取,便于與后續(xù)的教學(xué)內(nèi)容建立有機(jī)的聯(lián)系,通過對(duì)生活常見溶液中元素的存在形式的認(rèn)識(shí),無(wú)形地激發(fā)學(xué)生對(duì)于離子已有的意識(shí),也能從宏觀的世界肯定離子的存在。
[過程2]通過化學(xué)史帶領(lǐng)學(xué)生重走“電離”路,感性認(rèn)識(shí)電解質(zhì)在溶液中的行為
[環(huán)節(jié)一]展示歷史上不同階段對(duì)電離的認(rèn)識(shí)。
[環(huán)節(jié)二]展示法拉第的“電化學(xué)理論”在當(dāng)時(shí)的影響。
[環(huán)節(jié)三]展示阿倫尼烏斯對(duì)電離的研究及“電離學(xué)說(shuō)”的提出,并且體會(huì)該學(xué)說(shuō)為什么能解釋當(dāng)時(shí)的一些科學(xué)事實(shí)。
[環(huán)節(jié)四]展示阿倫尼烏斯提出“電離學(xué)說(shuō)”后遇到的阻力,及其最終取得勝利的故事,體會(huì)科學(xué)的精神。
重讀化學(xué)史,讓學(xué)生沿著科學(xué)的發(fā)展道路認(rèn)識(shí)電離,感受科學(xué)的方法、感悟科學(xué)的精神、體會(huì)科學(xué)的態(tài)度,可以加深學(xué)生對(duì)電離的感性認(rèn)識(shí),能對(duì)溶液中離子哪里來(lái)、怎么來(lái)的問題有一個(gè)更深刻的印象。一個(gè)學(xué)說(shuō)的建立必然推動(dòng)社會(huì)的進(jìn)步,化學(xué)史素材還可以激發(fā)學(xué)生的社會(huì)責(zé)任,所以教學(xué)中引入化學(xué)史素材是培養(yǎng)學(xué)生社會(huì)責(zé)任等學(xué)科核心素養(yǎng)的重要法寶之一。
[過程3]通過實(shí)驗(yàn)內(nèi)化學(xué)生對(duì)“電離”的認(rèn)識(shí)
通過上述兩個(gè)教學(xué)步驟,使學(xué)生在感性上認(rèn)識(shí)到電解質(zhì)在溶液中的存在形式,初步領(lǐng)會(huì)了電解質(zhì)在溶液中的電離過程,能感受到溶液中存在的離子。更進(jìn)一步還應(yīng)該讓學(xué)生實(shí)實(shí)在在地“看到”離子,溶液導(dǎo)電性實(shí)驗(yàn)是經(jīng)典的理陛認(rèn)識(shí)溶液中存在離子的方式。
[演示實(shí)驗(yàn)1]用數(shù)字實(shí)驗(yàn)儀器檢測(cè)純凈水、自來(lái)水、尖叫飲料的導(dǎo)電性。
[演示實(shí)驗(yàn)2]磁力攪拌下,在蒸餾水中逐漸加入NaCl固體測(cè)定溶液的導(dǎo)電性。
[演示實(shí)驗(yàn)3]磁力攪拌下在NH3水溶液中逐漸加入水,并測(cè)定導(dǎo)電性。
導(dǎo)電性是溶液性質(zhì)的宏觀展示,是溶液中存在陰陽(yáng)離子的實(shí)證,所以通過不同溶液的“導(dǎo)電性”實(shí)驗(yàn),不僅僅能讓學(xué)生實(shí)實(shí)在在地體會(huì)到溶液中的陰陽(yáng)離子,更能將前面兩個(gè)教學(xué)環(huán)節(jié)中的外部實(shí)踐活動(dòng)轉(zhuǎn)化為內(nèi)部心理活動(dòng)的過程,即內(nèi)化,從而真正感受到溶液中“離子”的存在。
電離是電解質(zhì)在溶液中行為的基礎(chǔ),所以學(xué)生理解了電離,當(dāng)然也就理解了溶液中離子哪里來(lái)的問題。學(xué)習(xí)電離后,學(xué)生看到電解質(zhì)溶液就清楚里面存在陰陽(yáng)離子,這其實(shí)就已經(jīng)初步具備“離子觀”了。
(2)《離子反應(yīng)》教學(xué)借用數(shù)字化技術(shù)鞏固溶液中的“離子觀”
電解質(zhì)、電離是離子反應(yīng)的知識(shí)鋪墊,而離子反應(yīng)的本質(zhì),是進(jìn)一步鞏固溶液中“離子觀”的重要知識(shí)點(diǎn)。教學(xué)中進(jìn)行如下實(shí)驗(yàn):
[演示實(shí)驗(yàn)1]磁力攪拌下,一定濃度的HCl溶液中逐漸加入一定量的Na2CO3固體并實(shí)時(shí)測(cè)定溶液導(dǎo)電性、pH。
[演示實(shí)驗(yàn)2]磁力攪拌下,一定濃度的NaOH酚酞溶液,逐漸加入一定濃度的HCl。
[演示實(shí)驗(yàn)3]磁力攪拌下,一定濃度的H2S04溶液中緩慢加入Ba(OH)2溶液并實(shí)時(shí)測(cè)定電導(dǎo)率。
實(shí)驗(yàn)中既有沉淀、氣體、指示劑顏色變化等宏觀可見的實(shí)驗(yàn)現(xiàn)象,也有通過數(shù)字實(shí)驗(yàn)儀器展示出反應(yīng)微觀原理的實(shí)際證據(jù),如pH的改變、電導(dǎo)率的變化。宏觀現(xiàn)象說(shuō)明溶液里微觀粒子問相互作用,發(fā)生反應(yīng)生成難溶、難電離、易揮發(fā)的物質(zhì),由此可以認(rèn)識(shí)到水溶液中的反應(yīng)是某些離子間相互作用,離子的結(jié)合和重組是構(gòu)成物質(zhì)及其變化的根本原因,從而形成離子反應(yīng)概念,并總結(jié)出離子反應(yīng)的本質(zhì):反應(yīng)前后離子進(jìn)行了重組、離子的種類和數(shù)量發(fā)生了變化。
教學(xué)中引導(dǎo)學(xué)生用離子符號(hào)表征離子反應(yīng)的本質(zhì),即離子方程式,呈現(xiàn)出微粒相互作用的“本質(zhì)過程”,通過離子方程式的書寫,學(xué)生可以從微觀角度表征物質(zhì)在水溶液中的反應(yīng),輔助認(rèn)識(shí)離子反應(yīng)的實(shí)質(zhì),形成學(xué)生的“離子觀”。學(xué)生在正確認(rèn)識(shí)了溶液反應(yīng)實(shí)質(zhì)的基礎(chǔ)上,不僅會(huì)用“寫、改、刪、查”來(lái)書寫離子反應(yīng),更能為學(xué)生在面對(duì)多電解質(zhì)溶液的復(fù)雜環(huán)境中,以“離子”的視角來(lái)分析、解決問題奠定堅(jiān)實(shí)基礎(chǔ)。
2.通過《化學(xué)鍵》教學(xué)進(jìn)一步完善“離子觀”
通過以上述方式對(duì)電離、離子反應(yīng)的教學(xué),學(xué)生能形成溶液中的“離子觀”,但是僅僅如此學(xué)生可能形成迷思概念,HCl、H2SO4在溶液中電離產(chǎn)生H2、Cl-、SO42-,那么HCl、H2SO4也是陰陽(yáng)離子形成的嗎?這就需要在離子鍵的教學(xué)中,進(jìn)一步明確如何形成離子化合物、離子化合物的微觀結(jié)構(gòu)組成、離子化合物的宏觀特征。
(1)感性認(rèn)知
活潑金屬原子與活潑的非金屬原子易形成的化合物如NaCl、KCl、MgCl2、CaO等,都屬于離子型化合物,則組成此類物質(zhì)的微粒是陰陽(yáng)離子,離子鍵存在于部分鹽、強(qiáng)堿、活潑金屬氧化物中。
(2)微觀探析
查閱文獻(xiàn)有很多優(yōu)秀的關(guān)于“離子鍵”的教學(xué)案例,如林美鳳老師在文章《基于“宏觀一微觀一符號(hào)”有機(jī)融合的離子鍵教學(xué)》中,設(shè)計(jì)采用“從宏觀角度感受離子鍵的存在”“從微觀角度進(jìn)一步認(rèn)識(shí)離子鍵”等方法來(lái)學(xué)習(xí)離子鍵及其離子化合物,采用這種宏微結(jié)合的方式從不同的角度去認(rèn)識(shí)“離子鍵”,對(duì)形成“離子鍵”“離子化合物”觀念的建構(gòu)有著重要作用;楊莎老師在《情境教學(xué)在離子鍵教學(xué)中的應(yīng)用》中設(shè)置游戲情境、實(shí)物情境、實(shí)驗(yàn)情境等,將離子鍵、離子化合物知識(shí)融入切實(shí)情境中,學(xué)生親身體驗(yàn)來(lái)獲得知識(shí),從而突破概念教學(xué)中的抽象思維;孫安龍老師在《基于建構(gòu)與表征打造概念教學(xué)的高效課堂——以“離子鍵”為例》一文中,從學(xué)生已有的知識(shí)經(jīng)驗(yàn)出發(fā),多角度幫助學(xué)生建構(gòu)離子鍵、離子化合物特點(diǎn)并為學(xué)生提供表征離子鍵的多種方法,并且在教學(xué)中滲透類比、探究等方法,加深學(xué)生對(duì)觀念的理解、建構(gòu)。
以上老師的設(shè)計(jì)都值得在教學(xué)中借鑒,深究各位老師的設(shè)計(jì),不論采用什么樣教學(xué)策略,其目的都是為了讓學(xué)生能有效地建構(gòu)“離子鍵”“離子化合物”等微觀觀念。“化學(xué)鍵”是從微觀的角度認(rèn)識(shí)物質(zhì)的組成,離子鍵和化學(xué)鍵的形成方式迥然不同,一個(gè)是得失電子、一個(gè)是電子共用,自然產(chǎn)生了形成物質(zhì)的不同微粒。教學(xué)中為了能增進(jìn)學(xué)生對(duì)離子鍵、共價(jià)鍵的認(rèn)識(shí),需要借助原子結(jié)構(gòu)示意圖、電子式等符號(hào)表征離子、原子間的相互作用,加深對(duì)離子鍵、離子化合物的理解。離子鍵教學(xué)補(bǔ)充強(qiáng)化學(xué)生的離子觀,最終消除HCI、H2S04等物質(zhì)也是離子形成的迷思概念。
(3)宏觀辨識(shí)
在一般情況下離子化合物具有較高的熔點(diǎn)和沸點(diǎn),教學(xué)中以表格的形式展示部分由分子形成的物質(zhì)和離子化合物的熔點(diǎn)對(duì)比。離子鍵是一種強(qiáng)烈的靜電作用,要破壞其作用力需要很高的能量,因此離子化合物通常具有高熔點(diǎn)、高沸點(diǎn)等宏觀性質(zhì),所以可以初步地從熔點(diǎn)判斷是否為離子化合物:通常情況下,熔點(diǎn)高于450℃的化合物,被視為離子化合物;熔點(diǎn)低于450℃的化合物被看作共價(jià)化合物。如NaCl的熔點(diǎn)為801℃,顯著高于450℃,所以NaCl是典型的離子化合物。而A1C13的熔點(diǎn)為190℃(2.5個(gè)標(biāo)準(zhǔn)大氣壓下),沸點(diǎn)為178℃(升華),遠(yuǎn)遠(yuǎn)低于450℃,即通常認(rèn)為A1C13為典型的共價(jià)化合物。誠(chéng)然這種經(jīng)驗(yàn)方法比較粗糙和局限,但在適宜的階段是學(xué)生判斷離子化合物的重要證據(jù)之一。
三、總結(jié)與反思
傳統(tǒng)離子反應(yīng)、化學(xué)鍵教學(xué)以離子方程式書寫、離子方程式正誤判斷、離子共存、化學(xué)鍵概念、電子式書寫、化合物種類等為知識(shí)重點(diǎn),然后學(xué)生經(jīng)過大量的練習(xí)可以解決相應(yīng)的應(yīng)試題目。但是從近些年高考試題發(fā)展趨勢(shì)來(lái)看,越來(lái)越注重將知識(shí)融合在真實(shí)的情境中,越來(lái)越重視用知識(shí)解決實(shí)際的問題,非常注重考查學(xué)生的分析、評(píng)價(jià)、創(chuàng)新能力,與平時(shí)的練習(xí)題大相徑庭,所以部分學(xué)生很難適應(yīng)一些新型的題目,更重要的是學(xué)生很難養(yǎng)成證據(jù)推理、宏微結(jié)合、社會(huì)責(zé)任、科學(xué)態(tài)度等學(xué)科核心素養(yǎng)。
在學(xué)科核心素養(yǎng)視域下,通過教學(xué)要使學(xué)生能對(duì)學(xué)科知識(shí)從最基本的學(xué)習(xí)理解過渡到應(yīng)用實(shí)踐,最后能對(duì)知識(shí)遷移創(chuàng)新。以這個(gè)過程為指導(dǎo)進(jìn)行教學(xué),不僅僅可以讓學(xué)生養(yǎng)成“離子觀”,使學(xué)生用“離子觀”作為工具去分析新情境、評(píng)價(jià)新過程、推測(cè)新問題,更可以在這個(gè)過程滲透學(xué)科核心素養(yǎng),逐步使學(xué)生形成適應(yīng)社會(huì)的必備品格和關(guān)鍵能力。
- 化學(xué)教與學(xué)的其它文章
- 借助《國(guó)家寶藏》提高學(xué)生化學(xué)學(xué)科素養(yǎng)的實(shí)踐研究
- “物質(zhì)制備”教學(xué)中化學(xué)核心素養(yǎng)培養(yǎng)的實(shí)踐與感悟
- 議高中化學(xué)教學(xué)中培養(yǎng)批判性思維的迫切性
- 情境性問題的層級(jí)結(jié)構(gòu)建構(gòu)及在美、英、新高中化學(xué)教材中的應(yīng)用
- 帶膜鋁片放入硫酸銅溶液的實(shí)驗(yàn)探究
- 金屬與酸反應(yīng)和氫氣爆炸的創(chuàng)新實(shí)驗(yàn)設(shè)計(jì)

