白介素10對人mDCs細胞骨架及其結合蛋白的影響
夏 雪,許筱莉,龍金華,2,王 赟,3,張世超,歐陽燕,朱貴明,胡祖權,曾 柱,3
樹突狀細胞(dendritic cells, DCs)是機體內功能強大的抗原呈遞細胞[1],臨床上利用DCs治療免疫相關疾病已經取得大量進展,在腫瘤治療領域的成功應用更是令人矚目[2-3]。研究[4-5]表明腫瘤微環境中高表達的抑制性細胞因子能夠影響DCs的免疫學功能,白介素10(interleukin-10, IL-10)在腫瘤患者體內的表達量較高,是一種具有免疫抑制特性的細胞因子,動物實驗顯示IL-10的活性能夠抑制DCs的分化成熟,并影響抗腫瘤免疫治療的效果[6-7]。從生物物理學的觀點來看,結構決定功能,細胞骨架重構在DCs的遷移和發揮免疫功能中起重要作用[7]。該文研究IL-10對人成熟樹突狀細胞(mature DCs, mDCs) 細胞骨架的影響,為研究腫瘤微環境中DCs的免疫學功能以及探索提高DCs腫瘤疫苗的治療效率提供理論依據。
1 材料與方法
1.1 主要試劑RPMI 1640培養基、胎牛血清購自美國Gibco公司;細胞裂解液、淋巴分離液均購自北京索萊寶公司;免疫磁珠分選試劑盒購自德國MACS公司;兔抗人絲切蛋白(Cofilin)、兔抗人磷酸化絲切蛋白(phosphorylation cofilin,p-Cofilin)購自美國CST公司;小鼠抗人肌動蛋白絲束蛋白(Fascin-1)購自美國Santa公司;小鼠抗人β-actin單克隆抗體購自北京全式金公司;重組人粒細胞巨噬細胞集落刺激因子(rhGM-CFS)、重組人白細胞介素4(rhIL-4)、腫瘤壞死因子α(rhTNF-α)、IL-10購自美國PeproTech公司;羅丹明標記的鬼筆環肽購自美國Thermo-Fisher Scientific公司。
1.2 方法
1.2.1CD14+單核細胞的分離 在50 ml離心管中加入15 ml淋巴細胞分離液,再緩慢加入30 ml的新鮮人外周血濃集白細胞,該新鮮人外周血濃集白細胞用2倍體積RPMI 1640培養基稀釋,2 600 r/min離心15 min;吸取白膜層,與等量RPMI 1640培養基混勻,1 000 r/min離心10 min,棄上清液,重復2~3次洗滌細胞。隨后,加入適量RPMI 1640培養基懸浮細胞,轉入細胞培養瓶,置于CO2培養箱37 ℃培養2~3 h,用0.25%胰蛋白酶消化收集外周血單核細胞。
1.2.2mDCs誘導培養 用含雞尾酒抗體的免疫磁珠陰性選擇獲得CD14+的單核細胞,加入150 ng/ml rhGM-CSF、100 ng/ml rhIL-4,培養5~7 d分化為未成熟樹突狀細胞(immature DCs, imDCs) 。然后,用RMPI 1640培養基漂洗imDCs 2次,加入含150 ng/ml rhGM-CSF、100 ng/ml rhIL-4和10 ng/ml TNF-α的細胞培養液,培養3 d獲得mDCs。
1.2.3IL-10處理mDCs 用RPMI 1640培養基將mDCs稀釋成1×106/ml,接種于24孔細胞培養板,加入含150 ng/ml rhGM-CSF、100 ng/ml rhIL-4和10 ng/ml TNF-α的細胞培養液,處理組再加入10 ng/ml IL-10,置于CO2培養箱37 ℃培養48 h。
1.2.4細胞骨架結構分析 取蓋玻片置于6孔細胞培養板中,每孔加入1 ml 0.1 mg/ml多聚賴氨酸,37 ℃培養箱中放置2 h,每孔加入1 ml PBS漂洗蓋玻片2次,去除多聚賴氨酸。加入細胞懸液,置于CO2培養箱中培養30 min,每孔加入1 ml 3.7%多聚甲醛固定細胞30 min。吸取上清液丟棄,加入1 ml 75 mg/ml甘氨酸室溫孵育10 min,再換1% Triton X-100室溫孵育10 min。隨后,每孔加入1 ml PBS置于搖床上晃動清洗5 min,吸棄上清液,重復操作3次,每孔加入100 μl 1%BSA溶液室溫封閉1 h;PBS漂洗3次,加入50 μl 150 U/ml羅丹明標記的鬼筆環肽,室溫下避光靜置40 min;PBS漂洗3次,加入50 μl DAPI溶液,室溫下避光靜置10 min。最后,PBS漂洗細胞3次,取出蓋玻片,加50 μl抗熒光淬滅劑固定在載玻片上。利用激光共聚焦顯微鏡在630倍物鏡下觀察mDCs的細胞骨架結構。
1.2.5Western blot實驗分析 用RIPA提取mDCs總蛋白,通過BCA法測定蛋白濃度后,取50 μg總蛋白進行SDS-PAGE電泳,轉印至硝酸纖維素膜上,置于5%脫脂奶粉中封閉1 h。TBST溶液洗3次后,分別加入抗Fascin-1、抗Cofilin、抗p-Cofilin和抗β-actin抗體,室溫2 h。TBST溶液洗滌3次,加入HRP標記的二抗,室溫輕搖1 h。最后,用TBST和TBS洗滌3次,在暗室中加入化學發光顯色試劑,曝光顯影后利用Image J軟件分析蛋白條帶。
1.2.6免疫熒光實驗 細胞處理同細胞骨架結構分析,在加入BSA溶液封閉后,分別加入抗Fascin-1、抗Cofilin、抗p-Cofilin抗體,37 ℃孵育2 h。用PBST和PBS洗滌3次后,加入500 μl熒光標記二抗,37 ℃培養箱放置1 h。隨后,PBST和PBS分別洗滌細胞3次,取出蓋玻片,加50 μl抗熒光淬滅劑固定在載玻片上,利用熒光顯微鏡分析細胞骨架結合蛋白在mDCs中的定位情況。
2 結果
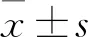
2.1 細胞形態觀察在培養過程中,外周血單核細胞分化為imDCs后,細胞體積比單核細胞略大,形態為多邊形,細胞表面伸出許多毛刺樣突起,細胞抱團,呈集落樣生長(圖1A)。當細胞成熟為mDCs后,變為不規則形狀,細胞表面伸出許多長短不一、粗細不等、疏密不同的樹枝狀、毛刺狀或絨線狀的突起(圖1B)。
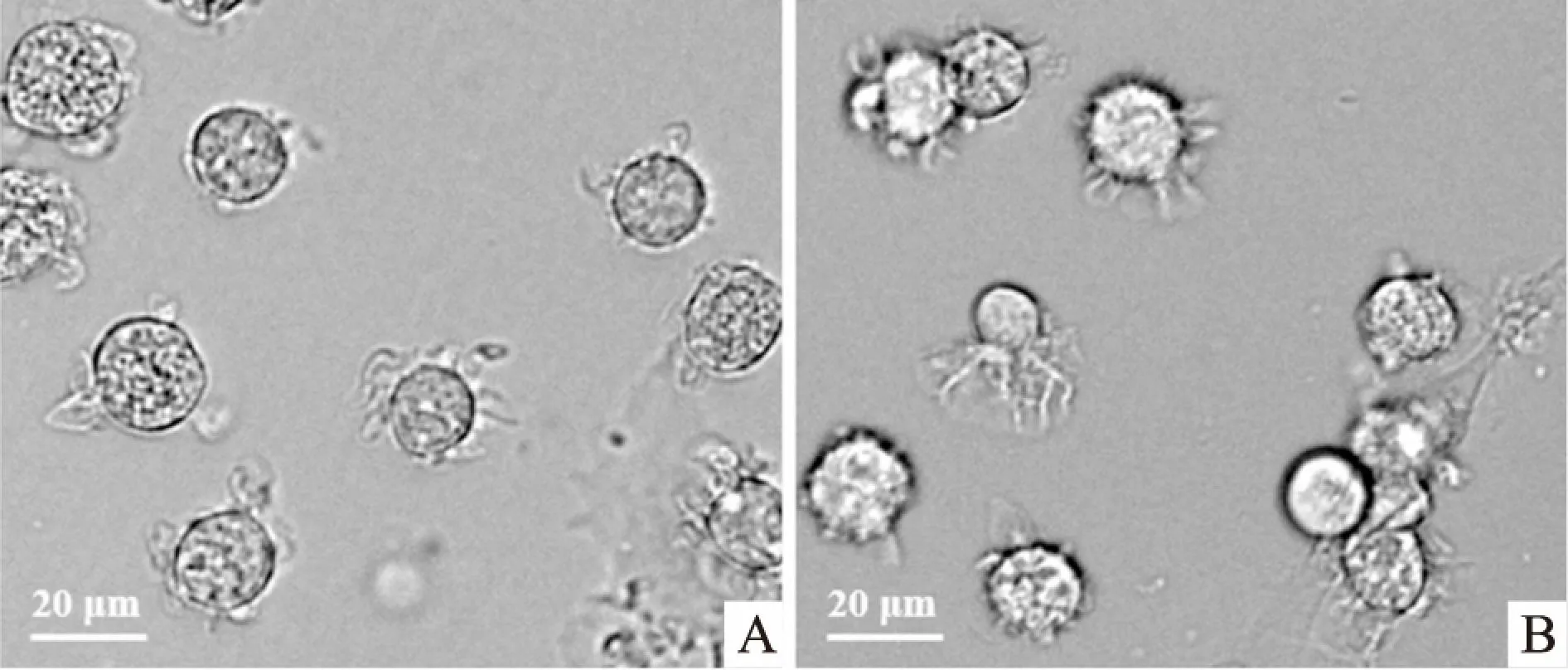
圖1 顯微鏡明場下imDCs和mDCs的形態 ×40A:imDCs;B:mDCs
2.2 細胞骨架纖維狀肌動蛋白(fibros actin,F-actin)結構的變化細胞經IL-10處理后,用羅丹明標記的鬼筆環肽特異性標記細胞內F-actin,通過激光共聚焦顯微鏡觀察其結構。結果如圖2所示,對照組mDCs的F-actin主要分布于細胞膜下,而IL-10處理后mDCs的F-actin多聚集于細胞表面的突起,提示細胞骨架結構發生了明顯的重組,說明IL-10能夠影響mDCs的細胞骨架重排。
圖2 mDCs細胞骨架F-actin結構的變化 ×630A:對照組;B:IL-10處理組
2.3 細胞骨架結合蛋白的表達細胞骨架結構及其結合蛋白的表達與細胞的生物物理學特性和運動能力密切相關。結合前期10 ng/ml的IL-10處理mDCs后基因芯片的結果,本實驗利用Western blot實驗分析IL-10對細胞骨架結合蛋白Fascin-1、Cofilin和p-Cofilin的表達影響(圖3)。IL-10處理后,DCs中Cofilin的表達變化不明顯,Fascin-1和p-Cofilin的表達上調,差異具有統計學意義(P<0.05),表明細胞骨架結合蛋白在mDCs的F-actin重排過程中的起到調節作用。

圖3 Western blot檢測細胞骨架結合蛋白的表達情況
A:Fascin-1;B: Cofilin; C:p-Cofilin;D:蛋白相對表達量分析結果;與對照組比較:*P<0.05
2.4 細胞骨架結合蛋白的定位分析細胞骨架結合蛋白在發揮其功能的過程中,除了表達量外,在細胞中的定位也起著重要作用。10 ng/ml的IL-10處理mDCs后,免疫熒光實驗分析Fascin-1、Cofilin和p-Cofilin在細胞中的定位情況。結果如圖4所示,3種細胞骨架結合蛋白的定位都發生了明顯的變化,其中Fascin-1定位于細胞張力纖維和細胞膜褶皺邊緣的絲狀偽足和微棘等細胞突起的核心肌動蛋白束上,而Cofilin和p-Cofilin位于質膜和胞質,與肌動蛋白絲共定位。
3 討論
DCs是機體免疫系統中功能最強的專職抗原提呈細胞,在體內直接激活初始T細胞,生成輔助性T細胞和殺傷性T細胞,也能誘使B細胞生成抗體,基于DCs的抗腫瘤免疫治療被認為是目前最有希望攻克癌癥的方法之一,但是該治療方法在臨床試驗的過程中還存在一些問題[2-3, 8],本實驗以腫瘤微環境中高表達的IL-10為研究對象,分析其對mDCs細胞骨架的影響,這對深入理解DCs的免疫學功能以及提高DCs腫瘤疫苗的臨床治療效率來說具有重要意義。
細胞骨架是細胞核骨架、細胞質骨架、細胞膜骨架和細胞外基質所形成的網絡體系,核骨架、核纖層與中間纖維在結構上互相連接,貫穿于細胞核和細胞質的網架體系,具有維持細胞形態,細胞內結構有序性的功能,在調控細胞運動、物質運輸、能量轉換、信號轉導、細胞分化、基因表達以及生物物理學特性等方面起著關鍵的作用[9-11],這些過程還受到細胞骨架結合蛋白的精密調控[9,12]。研究[13]表明,腫瘤微環境中高表達的IL-10能夠抑制DCs的分化成熟和免疫學功能,因此,研究IL-10對mDCs細胞骨架結構及其結合蛋白表達和定位的影響對于深入研究腫瘤細胞的免疫逃逸機理具有重要意義。
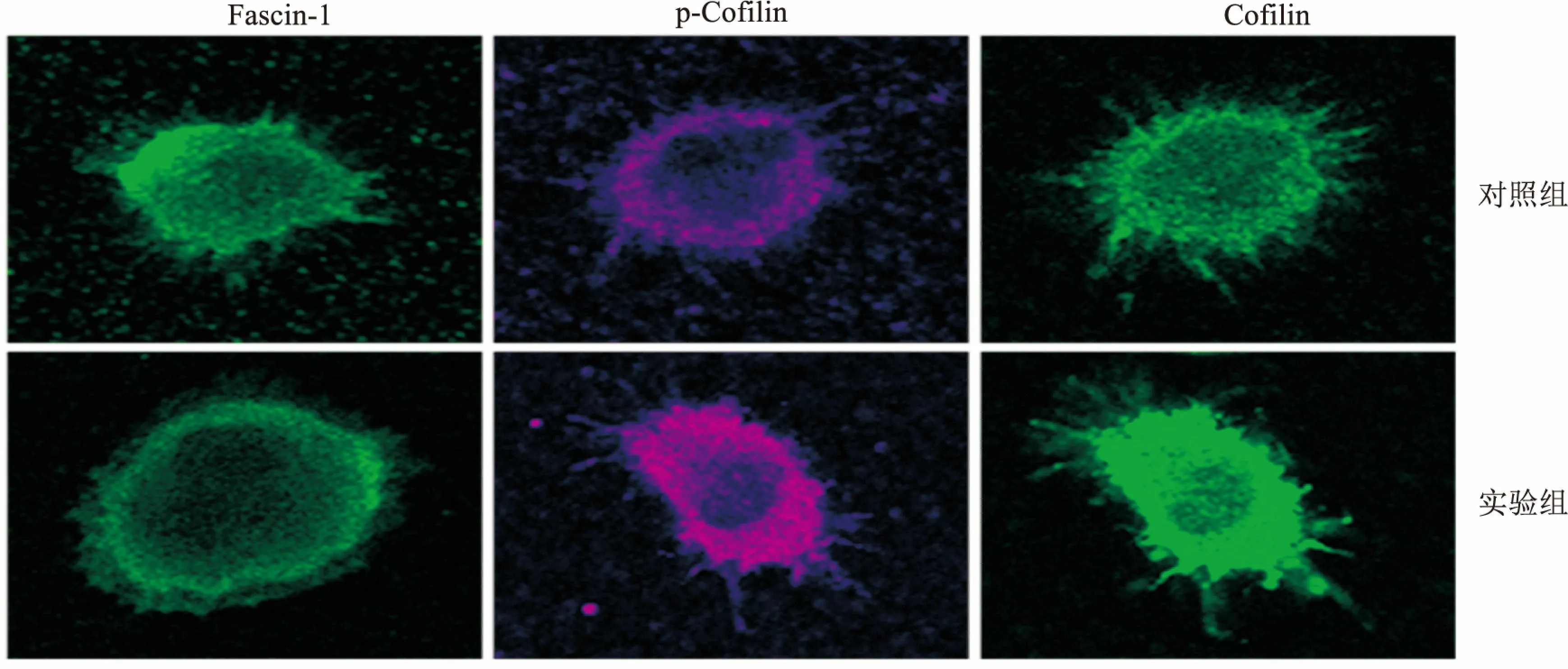
圖4 免疫熒光分析mDCs細胞骨架結合蛋白的定位情況 ×630
Fascin-1是一種結構獨特的細胞骨架結合蛋白,定位于肌動蛋白束的核心,通過與F-actin結合能夠使細胞形成絲狀、片狀偽足及微棘,參與細胞黏附、遷移以及信號轉導等,與細胞形態、遷移能力、應力纖維以及DCs的抗原提呈功能等具有密切聯系。絲切蛋白Cofilin是一種高度保守的蛋白,同樣能夠與F-actin結合,使磷酸化的Cofilin失去活性。Cofilin可結合在微絲的負端使微絲解聚,在微絲快速組裝和去組裝的結構中具有重要的作用,涉及細胞的黏附、遷移和內吞等功能。本實驗用IL-10處理mDCs 48 h后,DCs的F-actin表達量上升,絲狀偽足的數量和長度有增加的趨勢(圖2),而且細胞骨架結合蛋白Fascin-1和p-Cofilin的表達量上調,Cofilin的表達量略有降低(圖3),而且在細胞中的定位也發生明顯變化,表明細胞骨架在此過程中發生了重組。
DCs是免疫細胞中最活躍的成員之一,存在imDCs和mDCs兩種不同的功能狀態,imDCs表面的突起短小而稀疏,而當其捕獲抗原并成熟后,其細胞體積增大,突起變長且密度增加,細胞骨架發生了明顯的變化。本課題組的前期研究[14]結果表明,在DCs兩種不同的分化階段,其生物物理學特性存在明顯的差異:膜流動性、滲透脆性、電泳遷移率及細胞的變形能力均有所變化。由此可見,細胞骨架的重構與DCs的功能有著密切的關系。有研究[2,4,7,15]表明,細胞骨架的重構在DCs免疫作用過程中發揮了不可或缺的作用,包括吞噬、抗原提呈、遷移能力等。在腫瘤微環境中,DCs的運動能力下降,生物物理學特性受到損傷,其機制之一就是腫瘤微環境中的多種成分可以改變細胞骨架的結構[14-15]。因此,推測IL-10影響骨架結合蛋白的表達和定位,使細胞F-actin含量以及絲狀偽足的數量和長度發生改變。mDCs的細胞骨架發生重構,打破了細胞骨架結合蛋白的平衡,直接影響mDCs的免疫學功能,這也可能是腫瘤細胞逃脫免疫監視的一種重要方式。

