IGF-1對(duì)兔脂肪干細(xì)胞增殖和成骨分化的影響
朱思斌,張 雪,江 飛,許易誠(chéng),尹宗生
傳統(tǒng)上,治療骨折創(chuàng)傷主要有手術(shù)治療和復(fù)位外固定保守治療,骨組織工程是近期提出和快速發(fā)展的新的治療手段[1],相比舊的治療方法,骨組織工程治療過(guò)程中創(chuàng)傷的骨組織可以更快恢復(fù),骨組織修復(fù)過(guò)程加快,骨折預(yù)后功能可以更快接近之前的水平。不同種子細(xì)胞的增殖能力和多功能分化潛力各不相同,在不同骨科疾病中的治療效果差異巨大。現(xiàn)在常用的種子細(xì)胞有骨髓間充質(zhì)干細(xì)胞(bone marrow mesenchymal stem cells,BMSCs)和脂肪干細(xì)胞(adipose-derived stem cells,ADSCs)。ADSCs于2001年第一次被發(fā)現(xiàn),是從脂肪組織中提取的成體干細(xì)胞[2]。ADSCs起源于胚胎的中胚層,可以向多種細(xì)胞方向分化[3-4],最終分化成成骨、成脂、成軟骨細(xì)胞。胰島素樣生長(zhǎng)因子1(insulin like growth factor 1,IGF-1)是一種結(jié)構(gòu)類似于胰島素的生長(zhǎng)因子,在調(diào)節(jié)細(xì)胞生長(zhǎng)、促進(jìn)細(xì)胞分化、促進(jìn)骨與軟骨的合成代謝、創(chuàng)傷修復(fù)過(guò)程中起著重要的作用[5]。研究[6]表明IGF-1可以促進(jìn) BMSCs的增殖和成骨分化。目前,ADSCs在體外培養(yǎng)下仍有生長(zhǎng)增殖較慢,成骨分化所需時(shí)間較長(zhǎng)的缺陷,為研究培養(yǎng)方法,該實(shí)驗(yàn)通過(guò)在培養(yǎng)基中加入不同濃度的IGF-1,探尋IGF-1對(duì)體外培養(yǎng)下ADSCs的增殖和成骨分化能力的生物學(xué)影響。
1 材料與方法
1.1 實(shí)驗(yàn)動(dòng)物6月齡SPF級(jí)健康新西蘭白兔9只,雌雄不限,體質(zhì)量2.0~3.0 kg,由安徽醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心提供。飼養(yǎng)環(huán)境溫度18~29 ℃,相對(duì)濕度達(dá)40%~70%,新鮮空氣換氣次數(shù)10次/h,氣流速度≤0.18 m/s,壓差25 Pa,潔凈度一萬(wàn)級(jí),氨濃度15 mg/m3,噪音≤60 dB,照度150~300 Lux。
1.2 主要試劑與儀器低糖DMEM培養(yǎng)基購(gòu)自美國(guó)Hyclone公司;兔脂肪干細(xì)胞成骨誘導(dǎo)培養(yǎng)基、兔脂肪干細(xì)胞成脂誘導(dǎo)培養(yǎng)基購(gòu)自美國(guó)Cyagen公司;胎牛血清購(gòu)自美國(guó)Gibco公司;人重組IGF-1粉劑購(gòu)自美國(guó)R&D公司;CCK-8細(xì)胞增殖試劑盒為南京諾唯贊生物科技有限公司產(chǎn)品;Ⅰ型膠原酶、胰蛋白酶購(gòu)自美國(guó)Sigma公司;CD90單克隆抗體為北京博奧森生物技術(shù)有限公司產(chǎn)品;堿性磷酸酶(alkaline phosphatase,ALP)活性測(cè)定試劑盒為南京建成公司產(chǎn)品。CO2細(xì)胞恒溫培養(yǎng)箱、超速離心機(jī)為美國(guó)Thermofisher公司產(chǎn)品;倒置熒光顯微鏡為日本Olympus公司生產(chǎn);酶標(biāo)儀為美國(guó)BIO-TEK公司產(chǎn)品。
1.3 兔ADSCs的分離與培養(yǎng)取兔1只,戊巴比妥鈉麻醉,頸后術(shù)區(qū)剃毛備皮,俯臥位固定于手術(shù)臺(tái)上,消毒,鋪單,在無(wú)菌手術(shù)間,沿頸后正中切口逐層切開(kāi),分離出皮下脂肪,用添加1%含量雙抗的PBS沖洗3次,在超凈工作臺(tái)中,仔細(xì)剔除組織中的小血管,外包膜和其他組織。使用眼科剪將脂肪剪碎至乳糜狀,加入兩倍脂肪體積的0.1%Ⅰ型膠原酶,攪拌均勻,將離心管放置于37 ℃水浴中振蕩消化60 min,1 200 r/min 離心 10 min,去除上層油脂、殘余脂肪組織。沉淀重懸細(xì)胞后,放入200目細(xì)胞篩過(guò)濾,濾液1 200 r/min離心5 min。使用含10%胎牛血清的低糖DMEM重懸細(xì)胞沉淀,接種至細(xì)胞瓶,放入恒溫細(xì)胞箱中培養(yǎng),首次換液于24 h后,漂洗去除未貼壁細(xì)胞,每日鏡下觀察細(xì)胞形態(tài)和生長(zhǎng)情況,待細(xì)胞長(zhǎng)滿80%左右時(shí),用胰酶在37 ℃恒溫細(xì)胞培養(yǎng)箱中消化2 min左右,加入血清L-DMEM中和胰酶,設(shè)置離心機(jī)轉(zhuǎn)速為1 200 r/min,時(shí)間5 min,將細(xì)胞離心,離心后棄去上清液,將細(xì)胞按1 ∶3傳代。
1.4 ADSCs表面抗體的檢測(cè)初代ADSCs傳代至P2,細(xì)胞在培養(yǎng)皿增殖至80%融合時(shí),用胰酶消化細(xì)胞,再用含血清的低糖DMEM終止消化反應(yīng),消化后放入離心機(jī)1 200 r/min離心5 min,棄去上清液,用細(xì)胞培養(yǎng)基重懸, 調(diào)整細(xì)胞濃度為3×105/ml,接種于鋪好細(xì)胞爬片的24孔板上,每孔0.5 ml。待細(xì)胞貼壁后,用4%多聚甲醛固定,用PBS浸洗3次,加山羊血清等待30 min。再滴加山羊抗兔CD90一抗,放入濕盒,在4 ℃環(huán)境下過(guò)夜。第2天用PBST沖洗爬片,重復(fù)3次,滴加熒光二抗,濕盒孵育1 h,PBST沖洗爬片3次。滴加DAPI,孵育5 min對(duì)ADSCs細(xì)胞核染色。染色后在熒光顯微鏡下觀察并拍照。
1.5 兔ADSCs向脂肪細(xì)胞誘導(dǎo)分化取P2代ADSCs,細(xì)胞生長(zhǎng)至80%~90%融合時(shí),用0.25%胰酶消化細(xì)胞,調(diào)整細(xì)胞密度為5×104/ml,以每孔2 ml接種于6孔板中,2 d后,待細(xì)胞生長(zhǎng)完全融合,依照兔ADSCs成脂誘導(dǎo)培養(yǎng)基說(shuō)明書(shū),使用兔成脂誘導(dǎo)培養(yǎng)基A液培養(yǎng)3 d,3 d后換為兔成脂誘導(dǎo)培養(yǎng)基B液培養(yǎng)1 d,A液和B液相互交替培養(yǎng)3~5次,每日鏡下觀察細(xì)胞形態(tài),待脂滴足夠大,足夠圓,用油紅O染色,在倒置顯微鏡下觀察并拍照。
1.6 兔ADSCs向成骨細(xì)胞誘導(dǎo)分化取80%融合的P2代ADSCs,加入濃度為0.25%的胰酶消化,調(diào)整細(xì)胞密度為5×104/ml,以每孔2 ml接種于6孔板中,傳代后第2天,待細(xì)胞貼壁,換用兔成骨誘導(dǎo)培養(yǎng)基培養(yǎng)4周,鏡下觀察細(xì)胞形態(tài)轉(zhuǎn)變后,用茜素紅染色,在倒置顯微鏡下觀察并拍照。
1.7 CCK-8法檢測(cè)IGF-1對(duì)ADSCs增殖活性的影響取P2代ADSCs,以2×104/cm2的密度分別接種于96孔板中培養(yǎng),每孔加入100 μl培養(yǎng)基。依據(jù)說(shuō)明書(shū),將重組人IGF-1粉劑溶于無(wú)菌PBS中,加入成骨誘導(dǎo)培養(yǎng)基,配置成0、5、10、20 ng/ml四種濃度。設(shè)置為A組(對(duì)照組,0 ng/ml IGF-1)、B組(5 ng/ml IGF-1)、C組(10 ng/ml IGF-1)、D組(20 ng/ml IGF-1),每組設(shè)置3個(gè)復(fù)孔,培養(yǎng)24 h后加入100 μl含10% CCK-8的低糖培養(yǎng)基,在37 ℃、5% CO2下反應(yīng)4 h,酶標(biāo)儀檢測(cè)450 nm波長(zhǎng)處各孔的吸收值。每日重復(fù)CCK-8增殖實(shí)驗(yàn),重復(fù)3次,檢測(cè)7 d。
1.8 茜素紅染色檢測(cè)鈣結(jié)節(jié)及定性分析取P2代ADSCs,以 5×104/cm2的密度分別接種于24孔板中培養(yǎng),每孔1 ml。細(xì)胞貼壁后,換用加入IGF-1的兔成骨誘導(dǎo)培養(yǎng)基,按每培養(yǎng)基IGF-1的濃度將24孔板設(shè)置為4組,A組(對(duì)照組,0 ng/ml IGF-1)、B組(5 ng/ml IGF-1)、C組(10 ng/ml IGF-1)、D組(20 ng/ml IGF-1),在培養(yǎng)21 d后,每組對(duì)鈣結(jié)節(jié)茜素紅染色,定性檢測(cè)鈣結(jié)節(jié)。
1.9 ALP與鈣離子含量的檢測(cè)及定量分析按上述實(shí)驗(yàn)分組在24孔板中培養(yǎng)ADSCs, 在第14天和第24天時(shí),每組取3個(gè)孔進(jìn)行鈣離子定量檢測(cè),每孔加入1%氯化十六烷基吡啶500 μl,在常溫下反應(yīng)10 min,選擇560 nm波長(zhǎng),用酶標(biāo)儀檢測(cè)鈣離子的含量。每組另外3個(gè)孔用胰酶消化后,用含血清的低糖DMEM中和反應(yīng),離心去除殘余的胰酶,用PBS沖洗細(xì)胞兩次,加入0.1% Trizon X-100裂解細(xì)胞后收集裂解液,在高速離心機(jī)中20 000 r/min離心10 min后取上清液,依據(jù)ALP檢測(cè)試劑盒說(shuō)明書(shū)的步驟進(jìn)行ALP定量檢測(cè)。
1.10 統(tǒng)計(jì)學(xué)處理使用SPSS 17.0軟件分析數(shù)據(jù),組內(nèi)比較采用獨(dú)立樣本t檢驗(yàn),組間比較使用單因素方差分析。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 兔ADSCs的形態(tài)原代培養(yǎng)后,兔ADSCs于48 h內(nèi)貼壁,原代細(xì)胞呈短梭形或小多角形,72 h后觀察,細(xì)胞增殖后密度增高時(shí)為長(zhǎng)梭形成纖維細(xì)胞樣外觀。見(jiàn)圖1A。原代培養(yǎng)7 d左右,細(xì)胞鋪滿圍繞各中心呈集落樣生長(zhǎng)。見(jiàn)圖1B。
2.2 ADSCs免疫熒光鑒定結(jié)果免疫熒光鑒定P2代脂肪干細(xì)胞,顯示結(jié)果為DAPI細(xì)胞核染色陽(yáng)性,見(jiàn)圖2A;FITC標(biāo)記的CD90染色陽(yáng)性,見(jiàn)圖2B。

圖1 倒置顯微鏡下兔脂肪干細(xì)胞的形態(tài)
A:ADSCs原代培養(yǎng)3 d,呈長(zhǎng)梭形成纖維樣外觀 ×200;B:ADSCs原代培養(yǎng)7 d,細(xì)胞鋪滿圍繞各中心呈集落樣生長(zhǎng) ×100

圖2 ADSCs免疫熒光染色 ×200
A:DAPI細(xì)胞核染色陽(yáng)性;B:FITC標(biāo)記的CD90染色陽(yáng)性
2.3 ADSCs成脂誘導(dǎo)分化結(jié)果P3代ADSCs成脂誘導(dǎo)后,培養(yǎng)皿中的細(xì)胞結(jié)構(gòu)變得不規(guī)則,細(xì)胞內(nèi)可見(jiàn)球形透亮脂肪滴,逐漸變大變圓,誘導(dǎo)培養(yǎng)3周后,進(jìn)行油紅 O染色,染色結(jié)果為陽(yáng)性,可見(jiàn)紅色球形脂肪滴,見(jiàn)圖3A,證明ADSCs成脂分化。
2.4 ADSCs成骨誘導(dǎo)分化結(jié)果P3代ADSCs成骨誘導(dǎo)后,細(xì)胞形態(tài)由細(xì)長(zhǎng)的梭形結(jié)構(gòu)逐漸變寬大,變成不規(guī)則的多角形或多邊形。誘導(dǎo)14 d后,可見(jiàn)細(xì)胞周圍分布小褐色結(jié)節(jié)。誘導(dǎo)28 d后,形成大量鈣結(jié)節(jié),茜素紅染色后可見(jiàn)鈣結(jié)節(jié)被染成深紅色,茜素紅染色陽(yáng)性,見(jiàn)圖3B,證明了體外培養(yǎng)的ADSCs有成骨分化的能力。

圖3 ADSCs的功能鑒定 ×100
A:ADSCs成脂分化后油紅O染色陽(yáng)性;B:ADSCs成骨分化后茜素紅染色陽(yáng)性
2.5 ADSCs的增殖活性曲線CCK-8法檢測(cè)結(jié)果:隨著培養(yǎng)基內(nèi)IGF-1濃度的增高,ADSCs增殖活性逐漸增強(qiáng),從第2天開(kāi)始,5、10、20 ng/ml IGF-1組的增殖活性均高于對(duì)照組,其中20 ng/ml IGF-1組高于10 ng/ml IGF-1組和5 ng/ml IGF-1組,10 ng/ml IGF-1組高于5 ng/ml IGF-1組,差異有統(tǒng)計(jì)學(xué)意義(F=141.675,P<0.05)。見(jiàn)圖4。
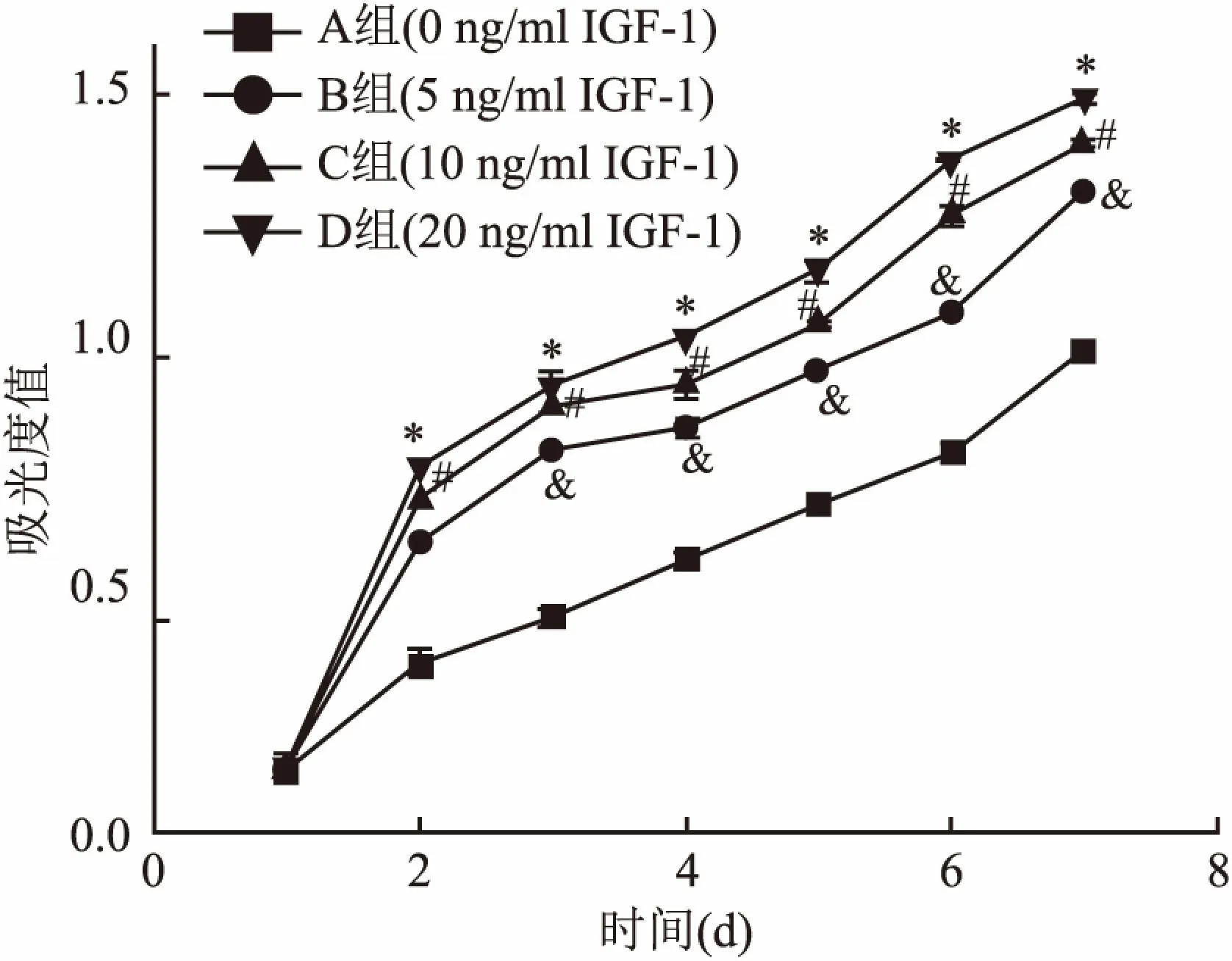
圖4 ADSCs增殖曲線
與A組比較:*P<0.05;與B組比較:#P<0.05;與C組比較:&P<0.05
2.6 鈣離子茜素紅染色的檢測(cè)結(jié)果成骨誘導(dǎo)分化3周后,ADSCs的茜素紅染色結(jié)果為陽(yáng)性,4組細(xì)胞鏡下均可見(jiàn)紅色鈣結(jié)節(jié)。見(jiàn)圖5。在鏡下觀察鈣結(jié)節(jié)密度,密度從大到小排列依次為D組、C組、B組和A組,A組密度最低。證明了IGF-1對(duì)ADSCs鈣離子的生成的促進(jìn)作用。

圖5 ADSCs鈣結(jié)節(jié)的定型鑒定 ×200
A:A組(0 ng/ml IGF-1)茜素紅染色;B:B組(5 ng/ml IGF-1)茜素紅染色;C:C組(10 ng/ml IGF-1)茜素紅染色;D:D組(20 ng/ml IGF-1)茜素紅染色
2.7 ALP和鈣離子的定量檢測(cè)ALP定量檢測(cè): ADSCs誘導(dǎo)培養(yǎng)14 d時(shí),D組、C組、B組中ALP活性均高于A組,且D組活性高于C組和B組,C組高于B組,差異有統(tǒng)計(jì)學(xué)意義(F=60.619,P<0.05)。培養(yǎng)21 d時(shí),D組、C組、B組中ALP活性均高于A組,且D組活性高于C組和B組,C組高于B組,差異有統(tǒng)計(jì)學(xué)意義(F=162.816,P<0.05),見(jiàn)圖6。鈣離子定量檢測(cè):誘導(dǎo)培養(yǎng)14 d時(shí),D組、C組、B組的鈣離子含量均高于A組,D組高于B組,C組高于B組,差異有統(tǒng)計(jì)學(xué)意義(F=142.931,P<0.05),而D組和C組鈣離子含量差異無(wú)統(tǒng)計(jì)學(xué)意義,誘導(dǎo)培養(yǎng)21 d時(shí),D組、C組、B組的鈣離子含量均高于A組,而且D組高于C組,D組高于B組,C組高于B組,差異有統(tǒng)計(jì)學(xué)意義(F=71.286,P<0.05),見(jiàn)圖7。

圖6 ALP定量檢測(cè)
與A組比較:*P<0.05;與B組比較:#P<0.05;與C組比較:&P<0.05

圖7 鈣離子定量檢測(cè)
與A組比較:*P<0.05;與B組比較:#P<0.05;與C組比較:&P<0.05
3 討論
骨科臨床上,股骨頭壞死是最常見(jiàn)的一種疾病,患病年齡多發(fā)于35~50歲,發(fā)病病因和機(jī)制非常復(fù)雜,受多種因素影響[7],在近年的研究中,利用BMSCs等干細(xì)胞治療早期股骨頭壞死是熱門(mén)的研究對(duì)象。BMSCs可在體外培養(yǎng),并向成骨方向和成軟骨方向分化,廣泛應(yīng)用于治療骨壞死等骨科疾病實(shí)驗(yàn)研究中[8]。但BMSCs體外培養(yǎng)需要從動(dòng)物的骨髓腔中取材,其來(lái)源少,取材困難,細(xì)胞增殖速度較慢。與BMSCs相比,ADSCs來(lái)源廣泛,取材和培養(yǎng)過(guò)程簡(jiǎn)單,細(xì)胞增殖和分化速度快[9]。有研究[10]表明,在體外環(huán)境下,ADSCs的增殖能力和向成骨細(xì)胞分化潛力強(qiáng)于BMSCs,是骨組織工程中更優(yōu)秀的種子細(xì)胞。
生長(zhǎng)因子是一種活性多功能肽物質(zhì),由特定細(xì)胞分泌,通過(guò)與靶細(xì)胞結(jié)合,可以調(diào)節(jié)細(xì)胞增殖和促進(jìn)細(xì)胞分化。IGF-1是一種生長(zhǎng)因子,來(lái)源于體內(nèi)肝細(xì)胞、腎細(xì)胞、脾細(xì)胞等十幾種細(xì)胞自分泌和旁分泌作用于周圍組織,但大部分來(lái)自于肝細(xì)胞。受垂體分泌的生長(zhǎng)激素調(diào)控,參與調(diào)節(jié)絕大部分器官的生長(zhǎng)和功能,對(duì)細(xì)胞的增殖、分化具有非常重要的作用[11-12]。骨質(zhì)疏松患者中,血清IGF-1水平下降,IGF-1可以促進(jìn)骨形成、抑制骨破壞、減少骨的吸收,對(duì)骨質(zhì)疏松具有改善作用[13]。IGF-1的結(jié)構(gòu)與胰島素相似,主要存在血液中,可以降低血糖、促進(jìn)糖異生、抑制脂肪分解、促進(jìn)組織利用葡萄糖,對(duì)糖尿病繼發(fā)骨質(zhì)疏松有著良好的治療效果。有研究[14]表明,IGF-1會(huì)影響骨細(xì)胞代謝,是骨形成和骨重建過(guò)程中的關(guān)鍵蛋白,又有研究[15]表明,IGF-1可以增強(qiáng)胰島素生長(zhǎng)因子結(jié)合蛋白5在成骨細(xì)胞中的表達(dá),對(duì)成骨細(xì)胞的增殖有促進(jìn)作用。本實(shí)驗(yàn)通過(guò)在培養(yǎng)基中加入不同濃度的IGF-1,觀察其對(duì)ADSCs的增殖和成骨分化的影響。本次實(shí)驗(yàn)證明,含有5~20 ng/ml IGF-1的成骨培養(yǎng)基,可以增加ADSCs的增殖活性和ALP及鈣離子含量,培養(yǎng)基中的IGF-1含量越高,ADSCs的增殖和成骨分化能力越強(qiáng),具有劑量反應(yīng)關(guān)系,IGF-1對(duì)ADSCs的生長(zhǎng)增殖和成骨分化具有促進(jìn)作用。有研究[16]表明,IGF-1通過(guò)efn-Eph信號(hào)通路和其他多種通路作用于ADSCs,刺激ADSCs的增殖和成骨分化。本實(shí)驗(yàn)在成骨培養(yǎng)基中加入的IGF-1最大濃度為20 ng/ml,但增強(qiáng)細(xì)胞成骨分化能力的最佳IGF-1濃度仍不能確定,有待進(jìn)一步實(shí)驗(yàn)。

