生物鐘基因Bmal1通過氧化應激信號通路調節(jié)胰島β細胞凋亡的研究
葉綠 許偉紅 薛靜 張婷 朱亮 杜燕 吳華香
生物鐘存在于機體內幾乎所有的細胞中,調節(jié)機體的行為和生理過程,包括能量代謝、內分泌激素的晝夜節(jié)律[1]。生物鐘包括正向調節(jié)作用的circadian locomotor output cycles kaput(Clock)、brain and muscle Arnt-like protein-1(Bmal1)和負向調節(jié)作用的 Period1-3(Per1-3)、Cryptochrome1-2(Cry1-2)。這些生物鐘基因相互作用,在轉錄和翻譯水平構成自主的反饋環(huán)路[2]。
生物鐘功能紊亂與代謝綜合征、糖尿病、心血管疾病密切相關。研究表明,睡眠障礙、輪班工作導致糖尿病發(fā)病率增加[3]。人群生物鐘基因的多態(tài)性和突變與心血管疾病、糖尿病和肥胖相關[4-6]。Per2基因缺失導致小鼠肥胖[7],Clock和Bmal1基因缺失引起小鼠血糖升高[8-9]。但目前多數(shù)動物模型為全身性基因敲除,除外環(huán)境和攝食行為等影響后,生物鐘基因異常導致β細胞功能障礙的機制不明確。有研究發(fā)現(xiàn),特異性敲除β細胞Bmal1基因比全身性敲除Bmal1基因的小鼠,胰島素分泌下降、糖耐量受損和血糖升高更明顯。特異性敲除小鼠β細胞Clock和Per2基因未導致胰島功能障礙[10]。這些研究證實Bmal1對維持胰島β細胞正常功能的重要作用。
β細胞功能障礙是糖尿病發(fā)病的中心環(huán)節(jié),細胞凋亡在胰島功能障礙起重要作用[11-13]。目前生物鐘基因對細胞凋亡的調控機制尚不明確。本研究應用RNA干擾,沉默胰島β細胞Bmal1基因表達,觀察Bmal1基因缺失對β細胞的影響及其機制,現(xiàn)報道如下。
1 材料和方法
1.1 細胞、主要儀器和試劑 大鼠胰島β細胞瘤株(insulinoma cell line,INS-1,武漢普諾賽生命科技有限公司,貨號:CL-0368)。全自動酶標儀(美國Thermo scientific公司,型號:Multiskan MK3),實時熒光定量PCR儀(美國 Applied Biosystems公司,型號:QuantStudio6),流式細胞儀(美國Beckman公司,型號:CytoFLEX),熒光顯微鏡(日本Olympus公司,型號:BX53),增強型ATP檢測試劑盒(上海碧云天公司,批號:S0027),ROS檢測試劑盒(上海碧云天公司,批號:S0033),RNA抽提試劑盒(美國Ambion公司,批號:15596-026),實時熒光定量PCR試劑盒(美國Vazyme公司,批號:Q111-02),TUNEL檢測試劑盒(美國Roche Applied Science公司,批號:12156792910)。
1.2 實驗方法
1.2.1 細胞培養(yǎng) 胰島β細胞培養(yǎng)于含5%CO2的37℃培養(yǎng)箱中,培養(yǎng)條件為含10%胎牛血清(美國Gibco公司,批號:10091-148)、2mmol/L左旋谷氨酰胺(美國Gibco公司,批號:25030-081)、青霉素-鏈霉素溶液(美國 Gibco 公司,批號:15070-063)、10 mmol/L HEPES(美國 Gibco公司,批號:15630-080)、50μmol/L 巰基乙醇(美國 Gibco公司,批號:21985023)、11.2mmol/L 葡萄糖、1mmol/L丙酮酸鈉的RPMI-1640培養(yǎng)液(美國Gibco公司,批號:11875-093)。
1.2.2 實驗分組 正常對照組(含5.5mmol/L葡萄糖,NC組)、高糖組(含33.3mmol/L葡萄糖)、正常糖濃度+無關RNA轉染組(含5.5mmol/L葡萄糖,NC+siRNA組)、正常糖濃度+Bmal1基因沉默組(NC+Bmal1-/-組)、高糖+無關RNA轉染組(含33.3mmol/L葡萄糖,高糖+siRNA組)、高糖+Bmal1基因沉默組(高糖+Bmal1-/-組)。
1.2.3 細胞轉染及沉默Bmal1基因 取對數(shù)生長期,生長狀態(tài)良好的INS-1β細胞,每孔2×105個接種于細胞培養(yǎng)6孔板,在37℃、5%CO2培養(yǎng)箱中培養(yǎng)過夜。細胞密度達到70%時進行轉染,在轉染前2h換成無血清1640培養(yǎng)基。取5μl LipofectamineTM2000(美國Invitrogen 公司,批號:11668-027)加至 100μl opti-MEM 中,室溫下靜置5min;混合LipofectamineTM2000和核酸的稀釋液,室溫下靜置20min。每個培養(yǎng)孔加混合液200μl。細胞于37℃、CO2培養(yǎng)箱中培養(yǎng),6h后換為正常培養(yǎng)基,37℃、5%CO2培養(yǎng)箱中培養(yǎng)過夜。
1.2.4 三磷酸腺苷(adenosine triphosphate,ATP)濃度測定 去除培養(yǎng)液,每孔加入200μl裂解液裂解細胞。裂解后4℃12 000r/min離心5min,收集上清液。加100μlATP工作液至檢測孔內,室溫靜置5min。在檢測孔內加入20μl樣品或標準品,迅速混勻,2s后用化學發(fā)光儀測定。
1.2.5 流式細胞儀檢測細胞活性氧 (reactive oxygen species,ROS)水平 使用0.25%胰酶消化細胞,終止消化后,1 500r/min離心5min收集細胞,去上清液。用PBS洗滌細胞2次,1 500r/min離心5min。根據DCFH-DA細胞ROS檢測試劑盒的說明進行操作:加入1ml DCFH;37℃培養(yǎng)箱孵育20min,每隔3min混勻1次;用無血清培養(yǎng)基洗滌細胞3次。隨后用流式細胞儀進行檢測。
1.2.6 TUNEL法檢測細胞凋亡 將爬有細胞的玻片用4%多聚甲醛溶液室溫固定25min,用PBS洗滌3次,每次5min。隨后,細胞爬片浸入0.1%TritonX-100溶液中10min進行冰上操作,PBS浸洗2次,每次5min。然后加入50μl TUNEL反應混合液,37℃避光孵育60min。隨后用PBS洗滌3次,每次5min。加入DAPI避光孵育5min,PBST洗滌4次,每次5min。使用抗熒光淬滅封片液封片,熒光顯微鏡觀察及采集圖像。
1.2.7 實時熒光定量PCR(qRT-PCR)檢測 根據RNA抽提試劑盒說明書提取細胞RNA,應用微量分光光度計測定波長為260、280nm的光密度值,計算RNA的純度和濃度。將RNA反轉錄為cDNA。目的基因Bmal1、去乙酰化酶sirtuin 1(Sirt1)以及管家基因GAPDH的引物序列由杭州擎科生物公司合成。PCR反應條件為95°C預變性10min;95℃ 變性 30s,60°C 退火延伸 30s,共 40個循環(huán)。2-ΔΔCt法計算Bmal1、Sirt1基因、管家基因 GAPDH mRNA表達。
1.3 統(tǒng)計學處理 采用 SPSS16.0統(tǒng)計軟件。測得計量資料采用±se表 示,多組間比較用單因素方差分析,兩兩比較采用LSD-t檢驗。P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 Bmal1沉默后對ATP生成的影響 見圖1。
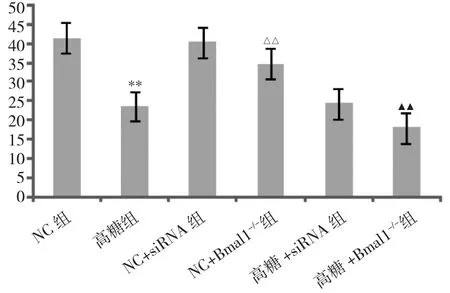
圖1 Bmal1沉默后對ATP生成的影響(與NC組比較,**P<0.01;與 NC+siRNA 組比較,△△P<0.01;與高糖 +siRNA組比較,▲▲P<0.01)
由圖1可見,與NC+siRNA組比較,NC+Bmal1-/-組ATP 含量下降(P<0.01);與 NC 組比較,高糖組 ATP 含量明顯下降(P<0.01);與高糖+siRNA 組比較,高糖+Bmal1-/-組 ATP 明顯下降(P<0.01)。
2.2 Bmal1沉默后對ROS生成的影響 見圖2。

圖2 Bmal1沉默后對ROS生成的影響(與NC組比較,**P<0.01;與NC+siRNA組比較,△△P<0.01;與高糖+siRNA組比較,▲▲P<0.01)
由圖2可見,與NC+siRNA組比較,NC+Bmal1-/-組ROS 水平升高,(P<0.01);與 NC 組比較,高糖組 ROS生成增加(P<0.01);與高糖+siRNA組比較,高糖+Bmal1-/-組 ROS 增加更明顯(P<0.01)。
2.3 Bmal1基因對Sirt1mRNA表達的影響 見圖3。
由圖3可見,與NC+siRNA組比較,NC+Bmal1-/-組Sirt1 mRNA 表達下降(P<0.01);與 NC 組比較,高糖組Sirt1 mRNA表達下降(P<0.01);與高糖+siRNA 組相比,高糖+Bmal1-/-組Sirt1 mRNA表達有下降趨勢,下降幅度為 20.7%,但差異無統(tǒng)計學意義(P >0.05)。
2.4 Bmal1基因對細胞凋亡的影響 NC組、高糖組、NC+siRNA組、NC+Bmal1-/-組、高糖+siRNA組、高糖+Bmal1-/-組 的 凋 亡 率 分 別 為 4.31%、10.26%、4.86% 、6.72%、13.21%、25.36%。與 NC+siRNA 組比較,NC+Bmal1-/-組凋亡率無明顯變化(P >0.05);與 NC 組比較,高糖組細胞凋亡增加(P<0.05);與高糖+siRNA組比較,高糖+Bmal1-/-組細胞凋亡率明顯增加(P<0.01),見圖 4(插頁)。
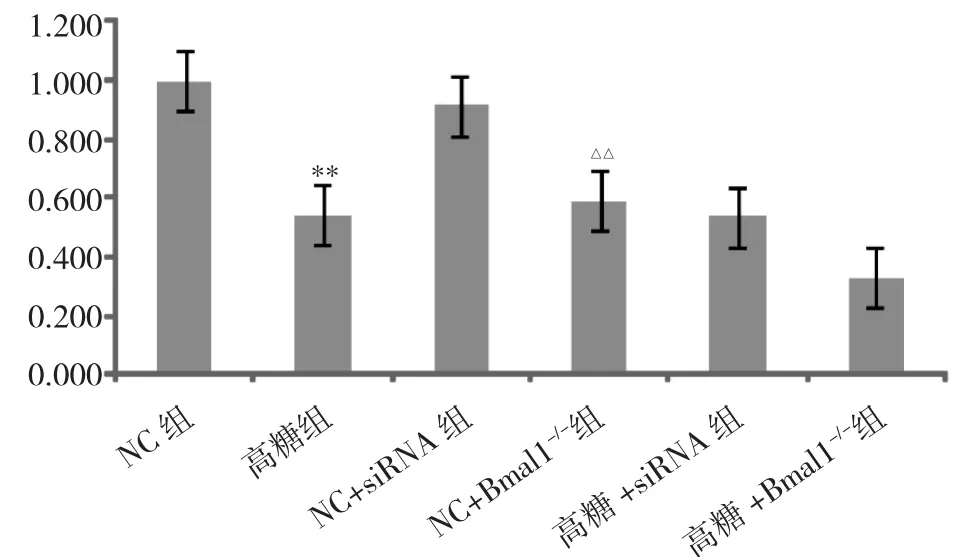
圖3 Bmal1基因對Sirt1mRNA表達的影響(與NC組比較,**P<0.01;與 NC+siRNA 組比較,△△P<0.01)
3 討論
糖尿病嚴重危害人類健康,β細胞功能障礙在糖尿病發(fā)病中起關鍵作用,其主要表現(xiàn)為胰島素分泌不足和分泌節(jié)律異常。研究表明,胰島素分泌節(jié)律主要由生物鐘調控[14-16],因此,生物鐘可能通過調控胰島β細胞功能影響糖尿病的發(fā)生、發(fā)展。有關胰島β細胞生物鐘基因的研究數(shù)據較少。有學者研究發(fā)現(xiàn),特異性敲除胰島β細胞Bmal1基因的小鼠比Bmal1-/-小鼠的胰島素分泌下降更明顯,盡管Bmal1-/-β細胞大小和增殖不受影響,其葡萄糖刺激的胰島素分泌下降近60%[10]。這些資料提示生物鐘基因Bmal1參與糖尿病發(fā)病,對維持β細胞正常功能有重要作用。
細胞凋亡在胰島β功能障礙起重要作用[11-13]。受凋亡信號刺激時,內源性ROS過量生成、細胞色素C及凋亡誘導因子等釋放入細胞質,激活半胱氨酸蛋白酶9(Caspase9),導致細胞DNA修復功能損傷、核酸內切酶活化,最終導致細胞凋亡[17]。此外,在糖尿病人群以及動物模型均發(fā)現(xiàn)氧化應激增強[18-19]。但生物鐘基因在胰島β細胞凋亡過程中的機制尚不明確。本研究對不同干預因素處理后的β細胞凋亡情況進行了檢測,結果發(fā)現(xiàn),高糖環(huán)境下,β細胞凋亡增加,這種作用在Bmal1基因沉默后更明顯。此外,結果顯示,Bmal1基因沉默后,ATP含量下降,ROS水平升高;在高糖環(huán)境下,Bmal1基因沉默組ATP水平明顯下降,ROS顯著增加。ROS氧化活性極強,其增加導致細胞結構損傷和代謝障礙。ATP是生物體各項生命活動最直接的能量來源。故ROS增加,ATP減少可導致相應器官組織功能障礙。有文獻報道,在Bmal1-/-小鼠的臟器如腎臟、心臟和脾臟等,均發(fā)現(xiàn)ROS明顯增加,導致相應組織細胞氧化應激反應增強,引起細胞功能障礙[20]。由于胰島β細胞內抗氧化酶基因表達水平較低,如超氧化物歧化酶含量僅為肝臟的30%,過氧化氫酶及谷胱甘肽過氧化物酶僅為肝臟的5%[21],因此,β細胞清除ROS和抗氧化能力較弱,對氧化應激損傷更敏感。Lee等[22-23]的研究顯示,Bmal1基因缺失使氧化應激增強,導致β細胞功能障礙,可能的機制是Bmal1基因缺失,導致線粒體解偶聯(lián)蛋白(uncoupling protein2,UCP2)上調和抗氧化反應基因表達改變(如調控抗氧化反應的關鍵因子核因子E2相關因子2及其調控的靶基因如Sestrin2,過氧化還原酶3,谷氨酸半胱氨酸連接酶催化亞基和谷氨酸半胱氨酸連接酶修飾亞基下降),最終導致β細胞功能衰竭。這些資料提示Bmal1基因參與維持胰島β細胞的正常功能。
本研究發(fā)現(xiàn),Bmal1基因沉默后,Sirt1基因表達下降;在高糖環(huán)境下,Sirt1基因表達下降;Bmal1基因沉默組更明顯,下降幅度為20.7%。去乙酰化酶Sirt1在細胞凋亡中起重要的調節(jié)作用,其主要通過組蛋白/非組蛋白去乙酰化作用影響基因轉錄,發(fā)揮抗氧化應激作用,減少細胞凋亡,增加細胞存活率。UCP2可使線粒體氧化磷酸化解偶聯(lián),ATP合成減少,影響ATP敏感的K+通道開放,導致細胞內Ca2+下降,抑制胞吐作用,減少胰島素的釋放;Sirt1可通過抑制UCP2間接促進胰島素分泌[24]。
本研究結果初步提示生物鐘基因Bmal1可通過調節(jié)氧化應激信號通路影響胰島β細胞功能和凋亡。國內外對胰島β細胞功能障礙進行了長期深入研究,但目前尚無有效保護和恢復胰島β細胞功能的治療措施。因此,進一步研究胰島β細胞功能障礙的發(fā)病機制及其信號傳導通路,對尋找有效的治療靶點具有重要意義和潛在的臨床價值。

