植絨轉運拭子聯合顯色培養基對鼻腔金黃色葡萄球菌定植的快速篩查
周 柯,孫 菲,陳曉棟,查定軍,劉家云,馬越云,郝曉柯,徐修禮
(空軍軍醫大學西京醫院 1. 檢驗科 全軍臨床檢驗醫學研究所; 2. 耳鼻咽喉頭頸外科,陜西 西安 710032)
金黃色葡萄球菌(Staphylococcusaureus,SA)為革蘭陽性菌,能產生多種毒素和酶,是引起社區感染和醫院感染的重要病原菌[1]。SA可長期或間斷定植在部分人群的前鼻孔(鼻前庭)內,與其他微生物一起構成鼻腔共生菌群,在一定條件下可轉化為機會致病菌并引起感染。當鼻腔定植的SA轉移到皮膚或身體其他部位,可引起皮膚軟組織、手術切口、呼吸道、骨關節、甚至血流等部位感染[2-3]。耐甲氧西林金黃色葡萄球菌(MRSA)是指含有mecA基因或者藥敏試驗對苯唑西林最低抑菌濃度(MIC)≥4 μg/mL的菌株,MRSA所致感染治療困難,并且在社區和醫療機構分離率有逐漸升高趨勢,已引起國內外學者的關注。國外醫療機構已常規開展住院患者鼻腔MRSA的定植篩查,在我國開展患者鼻腔SA定植篩查,對于預防和控制潛在的SA相關性感染和醫院感染都具有重要意義。通過對鼻前庭標本進行常規細菌培養、分離、鑒定和抗菌藥物敏感性試驗是鼻腔SA定植篩查的常規方法,但其耗時長、成本較高。如何快速、準確、簡便地進行鼻腔SA定植篩查是目前臨床研究者關注的熱點。
本研究采用植絨轉運拭子采集某院耳鼻喉頭頸外科門診患者鼻前庭標本,通過微生物自動化系統接種于血瓊脂培養基和MRSA/SA選擇性顯色培養基進行培養,快速篩查鼻前庭SA定植情況,并通過質譜鑒定、耐藥表型、mecA基因等方法對培養結果進行驗證,為鼻腔SA定植快速篩查提供新的方法和理論依據。
1 資料與方法
1.1 研究對象 選取2018年7月—11月空軍軍醫大學西京醫院耳鼻咽喉頭頸外科門診患者,所選對象均為急、慢性耳鼻咽喉疾病患者,有下列情況之一均予以排除:(1)近期1個月內使用抗菌藥物;(2)有上頜竇漏、牙源性鼻竇炎或真菌性變應性鼻竇炎;(3)有慢性呼吸系統疾病[慢性阻塞性肺疾病(COPD)、支氣管擴張]、免疫功能不全、慢性肉芽腫病、糖尿病和腫瘤等病史。本研究項目通過空軍軍醫大學西京醫院倫理委員會的批準,并與受試者簽署知情同意書。
1.2 材料與設備 eSwab植絨轉運拭子、WASPLabTM微生物自動化系統購于意大利Copan;羊血瓊脂培養基(簡稱血培養基)、水解酪蛋白(MH)藥敏瓊脂培養基購于鄭州安圖生物;ChromIDTMMRSA / ChromIDTMS.aureus選擇性顯色瓊脂培養基(簡稱為MRSA/SA顯色培養基)、Vitek-GP革蘭陽性菌鑒定卡片、AST-GP67革蘭陽性菌藥敏卡片、VITEK 2 Compact全自動微生物鑒定藥敏儀、VITEK MS微生物質譜鑒定儀、質譜靶板和基質液購于法國Biomerieux;頭孢西丁藥敏紙片購于英國Oxoid;Premix Taq DNA聚合酶、100 bp DNA Loading Marker購于大連寶生物工程有限公司;Sub-Cell Systems水平電泳系統、MJ Mini PCR 擴增儀、Gel Doc XR+化學發光凝膠成像系統購于美國BIO-RAD。質控菌株金黃色葡萄球菌ATCC 25923、29213(MSSA)、ATCC 43300(MRSA),糞腸球菌ATCC 29212購于國家微生物菌種保藏中心;VITEK MS質譜儀質控菌株大腸埃希菌ATCC 8739由儀器生產商提供。
1.3 標本采集 拆開eSwab植絨轉運拭子并打開含有轉運基的保存管螺旋蓋,用植絨拭子蘸取轉運培養基使拭子頭濕潤,將其依次插入患者雙側鼻前孔約3/4英寸(2 cm),分別以順時針和逆時針緩慢旋轉2~5次,應輕柔擦拭鼻黏膜組織以保證采集到黏膜上皮細胞[4]。采集完將拭子插入保存管,在拭子柄中部折斷并棄去手持部分,蓋好保存管螺旋蓋室溫下保存,24 h內送至微生物實驗室進行處理。
1.4 標本培養 植絨轉運拭子通過手工或WASPLab微生物自動化系統分別接種于血培養基和MRSA/SA顯色培養基,35 ℃孵箱培養16 h進行自動拍攝,并通過影像工作站軟件觀察菌落;如培養基無SA生長,則繼續培養至40 h后進行第二次拍攝,防止漏檢。
1.5 MALDI-TOF MS鑒定 根據VITEK MS檢測標準操作規程,用一次性1 μL接種環挑取單個菌落,均勻涂布在靶板檢測點制成厚度適中的菌膜,用微量移液器吸取1 μL基質液覆蓋于菌膜之上;ATCC 8739質控菌落涂布于靶板質控點;待所有菌落干燥后,靶板裝載入VITEK MS鑒定儀進行鑒定。
1.6 耐藥表型檢測 采用自動化儀器法和紙片擴散法藥敏試驗進行耐藥表型檢測。以一次性棉拭子挑取足量菌落,加入無菌生理鹽水配制成0.5標準麥氏濁度菌懸液,采用GP革蘭陽性菌鑒定卡片、AST-GP67革蘭陽性菌藥敏卡片通過VITEK 2 Compact系統進行藥敏試驗;同時,將菌懸液均勻涂布于MH藥敏平板,將頭孢西丁(30 μg/片)藥敏紙片貼于平板,35 ℃孵箱培養過夜檢測耐藥表型。藥敏結果判讀依據美國臨床實驗室標準化協會(CLSI)抗菌藥物敏感性試驗2018年M-100-28th標準:苯唑西林MIC≥4 μg/mL或頭孢西丁紙片抑菌圈直徑≤21 mm時判斷為MRSA,苯唑西林MIC≤2 μg/mL或頭孢西丁紙片抑菌圈直徑≥22 mm為MSSA。
1.7mecA 基因PCR檢測 選取血培養基上生長良好的待測菌株5~8個純菌落,以0.5 mL無菌水制備成菌懸液,95 ℃煮沸15 min,1 200 r/min離心10 min取上清為細菌基因組DNA模板。參考相關文獻[5]設計引物:mecA上游引物5’-TGGCTATCGTGTCACAATCG-3’,下游引物5’-CTGGAACTTGTTGAGCAGAG-3’,擴增片段長度310 bp。PCR反應體系共25 μL,包括Premix Taq酶緩沖溶液12.5 μL,上、下游引物和DNA模板各1 μL,雙蒸水9.5 μL。PCR反應條件為95 ℃預變性5 min,然后以95 ℃變性1 min,退火1 min,72℃延伸1 min,循環35次,72℃延伸10 min。取PCR 產物5 μL 進行瓊脂糖凝膠電泳,100 bp DNA Loading Marker作為參照,加入熒光染料染色后進行電泳,采用凝膠成像系統檢測電泳產物。MSSA(mecA-)ATCC 25923,MRSA(mecA+)ATCC 43300作為對照菌株。mecA檢測陰性為MSSA,mecA檢測陽性為MRSA。
2 結果
2.1 鼻腔SA定植快速篩查的陽性率和報告時間 共收集200份鼻前庭標本,通過培養初篩共檢出SA菌株48株,其中MSSA 23株(占47.9%),MRSA 25株(占52.1%);鼻腔SA定植率為24.0%,MRSA定植率為12.5%。SA平均報陽時間為(17.6±6.1) h(包含鑒定時間),其中45份標本均在第一次拍攝時發現,報陽時間為16 h;3份標本培養16 h未在顯色培養基上發現,僅在血培養基觀察到少量疑似SA菌落,經分離純化后鑒定為SA,報告時間為41 h;其余152份標本均未分離出SA菌落,陰性報告時間為16 h,為防止漏檢,延遲孵育至40 h仍未分離出SA菌落,結果與16 h相符合。
2.2 鼻腔SA篩查菌落生長情況 試驗可見以下四種菌落生長情況:(1)培養16 h顯色培養基SA分區分離出綠色菌落,MRSA分區無綠色菌落生長,血培養基可有β溶血SA菌落生長(圖1A),則可認定分離出MSSA;(2)16 h顯色培養基MRSA和SA分區均分離出綠色菌落(圖1B),血培養基可有β溶血SA菌落生長,則可認定分離出MRSA;(3)16 h顯色培養基MRSA和SA分區無綠色菌落生長,而血培養基有β溶血SA菌落生長,對其分純至顯色培養基延長培養至40 h進行判斷;(4)16 h血培養基未分離出β溶血SA菌落,顯色培養基未分離出綠色菌落,暫判斷為SA培養陰性,延長培養至40 h。

A: 鼻前庭標本接種于血培養基分離出β溶血SA菌株(左/右半圖分別為白色/暗色背景色拍攝,拍攝時間16 h);B: 鼻前庭標本接種于MRSA/SA顯色培養基,MRSA(右)和SA(左)分區均分離出綠色菌落(拍攝時間16 h)
圖1耳鼻喉頭頸外科患者鼻腔定植SA在培養基上的生長情況
Figure1Growth on culture medium for SA colonized in nasal cavity of patients in department of ORL-HNS
2.3 鼻腔SA定植快速篩查的準確性驗證 48株SA菌株MALDI-TOF MS質譜鑒定結果均為SA,培養初篩和質譜鑒定的符合率為100.0%。通過自動化藥敏試驗和頭孢西丁紙片篩選,初篩的23株MSSA苯唑西林MIC≤2 μg/mL,頭孢西丁紙片抑菌圈直徑≥22 mm;25株MRSA苯唑西林MIC≥4 μg/mL,頭孢西丁紙片抑菌圈直徑≤21 mm,培養初篩和耐藥表型檢測符合率為100.00%。經mecA基因檢測,初篩的23株MSSA均未檢出mecA基因,25株MRSA中24株檢出mecA基因,有1株未檢出mecA基因,初篩和mecA基因檢測的符合率為97.9%。見表1。
表1耳鼻喉頭頸外科患者鼻腔SA定植快速篩查的準確性驗證(株)
Table1Accuracy verification of rapid screening for SA colonized in nasal cavity of patients in department of ORL-HNS(No. of isolates)
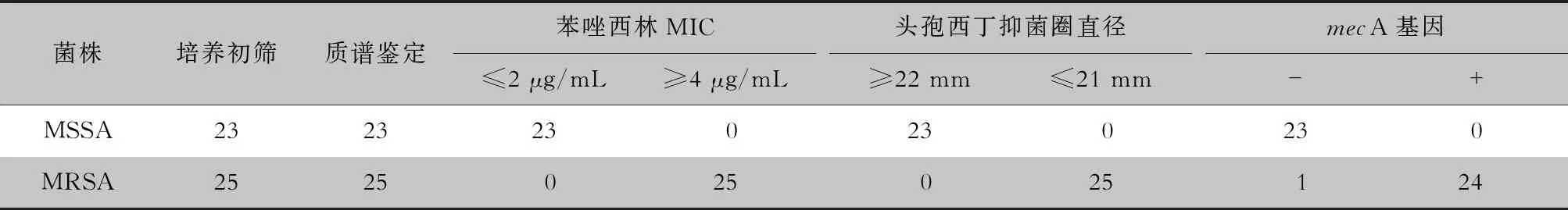
菌株培養初篩質譜鑒定苯唑西林MIC≤2 μg/mL≥4 μg/mL頭孢西丁抑菌圈直徑≥22 mm≤21 mmmecA基因-+MSSA2323230230230MRSA2525025025124
3 討論
SA屬于葡萄球菌屬,是一類無動力、無芽孢革蘭陽性球菌,可產生多種毒力因子,是對人類致病的重要病原體,大部分存在于哺乳動物鼻前庭、皮膚和黏膜中,約有50%人群長期或間斷攜帶。定植在鼻前庭的SA與其他細菌共同構成鼻腔共生菌群,是人體正常菌群的一部分,在維持宿主正常生理功能中具有重要作用,菌群的多樣性可以發揮免疫調節功能,抑制病原體入侵和增殖。當宿主免疫力低下,鼻腔共生菌群失衡,這些菌群可能成為致病菌和耐藥菌的儲存庫,可轉化為機會/條件致病菌并引起機體感染[2-3]。SA可以通過鼻前庭轉移到皮膚或身體其他部位引起化膿性感染,如皮膚軟組織感染、器官感染和全身性感染。MRSA所致感染治療困難,最近在社區和醫療機構人群的分離率呈增高趨勢,已成為重要的醫院感染多重耐藥菌。國外醫療機構已常規開展住院患者鼻腔MRSA的定植篩查和去定植干預,對于醫院感染控制具有重要意義[1]。
目前,微生物檢驗的常規工作大部分仍然依賴于手工操作,自動化水平不高,提高微生物工作的效率,縮短時間是目前亟待實現的關鍵問題。微生物檢驗流程中,標本接種、孵育,病原菌鑒定和藥敏試驗任一步驟都制約著報告的時效性。隨著檢驗技術的發展,目前有少數微生物實驗室引進全自動微生物系統,實現了實驗室自動化,該系統可實現自動化標本接種、培養基孵育、拍照、菌落觀察、標記和后續處理,具有生物安全性較高、標本接種和處理速度較快、分離質量優等優勢,有望提高檢出率并縮短標本周轉時間[6-7]。本院微生物實驗室于2012年引進意大利Copan WASPLab微生物自動化系統,該系統在微生物檢驗流程優化和病原體快速檢測工作中發揮舉足輕重的作用。
Copan eSwab植絨轉運拭子,其包裝內含有一支植絨拭子和一支存有液態轉運培養基的塑料保存管,與WASPLab系統匹配并可由其進行自動接種。植絨拭子由尼龍纖維制成,通過靜電制作工藝黏附在塑料棒上,相對于棉質或滌綸拭子,其拭子頭表面積更大,可吸附更多體積標本,其釋放/洗脫能力也較強,當浸入液態轉運培養基內,可將吸附的標本完全釋放。塑料保存管內含有1 mL液態Amies轉運培養基,可高效維持需氧菌、苛養菌、厭氧菌、真菌、病毒等病原體活性,室溫條件下可保存24~48 h,并不改變各種病原體的含量,可用于病原學涂片、培養和核酸檢測等多重檢測[8-9]。通過植絨轉運拭子采集鼻前庭分泌物,可提高鼻腔定植病原菌,特別是SA的檢出率。
MRSA/SA顯色培養基是目前臨床常用的MRSA/SA篩選培養基,市售的商品化培養基包括法國Biomerieux ChromIDTMS.aureus、ChromIDTMMRSA和ChromIDTMMRSA/ChromIDTMS.aureus,以及法國CHROMagarTMStaph aureus、CHROMagarTMMRSA顯色培養基。培養基中含有選擇性抑制劑,可抑制大部分非葡萄球菌和假絲酵母菌生長,在SA作用下產色底物α-葡萄糖苷酶使菌落呈現綠色,可以用來直接篩選并鑒定SA。在此基礎上,MRSA篩選培養基還含有頭孢西丁等多種抗菌藥物,可直接篩選并鑒定MRSA[10],具有較高的敏感性和特異性。ChromIDTMMRSA/ChromIDTMS.aureus為雙分區顯色培養基,可同時進行MRSA/SA篩選和鑒定,聯合血培養基進行菌落判讀能夠最大程度地排除耐甲氧西林凝固酶陰性葡萄球菌菌落的干擾。此顯色培養基篩選的特異性與孵育時間呈正相關,延長孵育至48 h可避免漏檢,但其他菌屬如產生相似的綠色菌落則會干擾結果判讀,并降低檢測特異性[11]。
本研究基于微生物自動化系統,通過植絨轉運拭子聯合顯色培養基進行鼻腔SA定植的初步篩查,并通過細菌鑒定、耐藥表型和mecA基因檢測等進行結果確證。200例患者鼻前庭標本初步篩查出48株SA菌株,質譜鑒定與顯色培養基初篩的符合率為100.0%,該人群鼻腔SA定植率為24.0%,MRSA定植率為12.5%,高于劉軍等[12](SA 10%)、董宏亮等[13](SA 5.16%,MRSA 1.72%)報道的臨床醫務人員的定植率,也高于張亞莉等[14]報道的臨床醫務人員和患者(SA平均15.5%)的定植率,可能與研究對象、采樣拭子和培養方法不同相關。耐藥表型檢測和初篩的符合率達100.0%,而mecA基因檢測與初篩結果絕大部分符合,符合率為97.9%。mecA基因編碼一種青霉素結合蛋白2a(PBP2a),其與β-內酰胺類抗生素親和力降低,從而產生耐藥性。盡管認為mecA基因介導SA對β-內酰胺類抗生素的耐藥性,mecA基因可作為MRSA 鑒定的“金標準”,但多個研究發現與本研究結果相似的耐藥表型和基因檢測結果不一致的情況,即存在少部分不攜帶mecA基因的MRSA菌株,以及攜帶mecA基因的MSSA菌株,可能是由于存在其他耐藥機制,如青霉素結合蛋白結合力改變導致β-內酰胺酶過度產生或其他未知機制等[5,15-16]。
傳統的鼻腔SA定植篩查方法,需要對鼻前庭標本進行常規細菌培養,并對分離的菌株進行鑒定和藥敏試驗,報告時間往往需要3 d左右。本研究借助微生物自動化系統完成自動標本接種、培養基孵育、拍攝和菌落觀察,對常規培養基和顯色培養基生長菌落進行初篩,能夠在早期快速篩查鼻腔定植的SA和其β-內酰胺類耐藥性,和mecA基因檢測相比準確性可以達到97.9%,并有望在16 h報告陰性篩查結果。與傳統培養和耐藥表型、mecA基因檢測等方法相比,本方法在檢測時間和成本上具有一定優勢,有望用于臨床鼻腔SA或MRSA定植篩查,但需考慮其與耐藥基因檢測存在差異的可能性。
綜上所述,基于微生物自動化系統的植絨轉運拭子聯合顯色培養基的快速檢測方法,可以優化患者鼻腔SA定植快速篩查的流程并縮短報告時間,有望為SA感染防治提供新的技術手段。

