不同胸壁補償膜在乳腺癌放療中的應用
盛成陽,梁恒波,程鵬,張賽,韓倩
(河南大學河南省人民醫院 放療科,河南 鄭州 450003)
隨著放射治療技術的快速發展,調強放射治療(intensity modulated radiotherapy,IMRT)已被廣泛應用于臨床[1]。但不同能量射線具有以下分布特性,隨著射線能量的增加,深度劑量增加而表面劑量下降,高能射線進入人體組織后,其最大劑量值不在人體組織表面,而是在距體表一定距離的組織內,劑量建成區為從皮膚表面到最大劑量點的深度[2],正由于這個特性導致乳腺癌調強放射治療時淺表靶區劑量不足且很不確定。組織等效補償膜的廣泛應用解決了臨床放療中這一問題[3]。一般計劃系統里默認的虛擬胸壁等效補償膜都是緊貼著皮膚,而市售胸壁補償膜尺寸大小固定,有一定硬度,不能很好地貼合于胸壁,實際應用中和皮膚存在一定間隙,容易造成胸壁淺表靶區劑量不足,從而減弱療效,腫瘤復發可能性增加。本文通過對比市售胸壁補償膜和根據患者自身設計的個體化3D打印補償膜[4]對IMRT計劃中腫瘤靶區劑量、重要器官劑量的影響,為乳腺癌根治術后患者行調強放療時使用個體化3D組織打印膜提供可靠的物理數據,以便更好指導及完善臨床放療實踐工作。
1 資料與方法
1.1 臨床資料與設備
1.1.1臨床資料 選取河南大學河南省人民醫院2018年5月至2019年5月收治的14例女性乳腺癌根治術后患者,年齡為26~66歲,中位年齡為46歲。14例患者均已行乳腺癌改良根治術,有明確病理證實,分期為ⅡB~ⅢC期,均已行8個周期全身化療。根據2019年乳腺癌NCCN指南給予術后放療,患者均簽署了知情同意書。
1.1.2設備 3D體膜打印機,飛利浦Pinnacle 9.2放射治療計劃系統,GE16排大孔徑CT膜擬定位機Discovery CT 590 RT,LAP激光燈系統,CIVCO定位坐標板。
1.2 方法
1.2.1模擬定位 患者取仰臥位平躺于碳纖維體部固定板上(患者體中線與碳纖維體部固定板中線基本重合,肩部與固定板上界基本平齊),雙手抱住肘關節放置于額頭,在體表確定激光定位點,應用GE16排螺旋CT行自由呼吸CT掃描,掃描層厚5 mm。對14例患者分別行CT定位,首先為覆蓋胸壁市售胸壁補償膜后的定位,其次先行不加補償膜的定位掃描,確定好皮膚輪廓后,制作出個體化3D打印補償膜,最后覆蓋在胸壁上再進行定位掃描,圖像經放療局域網傳輸至Pinnacle 9.2治療計劃系統。
1.2.2個體化3D補償膜的制作 分別對14例患者進行CT圖像掃描,把掃描圖像傳輸到放射治療計劃系統TPS中。在TPS中根據掃描圖像確定腫瘤靶區范圍,進行皮膚輪廓勾畫,確定定制補償膜的大小。從TPS中導出補償膜三維輪廓到三維數據軟件3D Slicer中,對補償膜三維模型進行平滑處理。從3D Slicer中導出3D打印文件,在打印之前對模型進行切片處理。運用3D打印機A3S打印個體化補償膜。
1.2.3計劃靶區(PTV)和危及器官(OAR)勾畫 定位后的14例患者胸壁靶區勾畫參考RTOG乳腺癌根治術后靶區勾畫標準,由同一高年資醫生進行勾畫。CTV范圍:上界為鎖骨頭的下緣(第一肋骨下沿處),下界為CT上對側乳腺消失的平面,內界為胸骨旁線(包括手術瘢痕,不應超過體中線),外界為腋中線(背闊肌前緣不包括背闊肌),前界為皮膚,后界為肋骨胸膜交界處(胸大肌筋膜、胸肌間淋巴結和乳房下的胸壁淋巴引流區)。計劃靶區(plan tumor volume,PTV)是在CTV基礎上內界、外界和后界各外擴0.5 cm(除外肺組織),前界仍在皮膚上,上界及下界各外擴1 cm。臨床醫生在靶區勾畫基礎上,于飛利浦Pinnacle 9.2放射治療計劃系統中,勾畫危及器官(organ at risk,OAR):患側肺、健側肺、心臟、肝臟及骨髓。
1.2.4計劃設計 于飛利浦Pinnacle 9.2放射治療計劃系統中進行IMRT計劃設計,采用6 MV-X線以等中心(SAD)方式照射,每日1次,每次2 Gy,每周5次,總量為50 Gy(5周),分4個主野調強,分別為兩切線野和兩斜角野,最小跳數為5 MU,最小子野面積為4 cm2。PTV靶區體積95%PTV劑量與處方劑量50 Gy相等。PTV接受55 Gy處方劑量的體積應低于5%,PTV接受53.5 Gy處方劑量的體積應低于10%。PTV區域之外,其劑量應比處方劑量的110%要低。
1.2.5靶區劑量學分布及均勻性評估 統計出PTV的D50%、D98%、D2%、VPTV、VPres、VPres-PTV。靶區均勻性指數(homogeneity index,HI)=(D2%-D98%)/D50%×100%。HI值越小表示靶區劑量的均勻性越好。適形度指數(conformity index,CI)=(VPres-PTV×VPres-PTV)/ (VPTV×VPres)。CI值取0~1,越接近于1適形程度越高[5]。
1.2.6OAR放射劑量及體積評估 患側肺V5、V10、V20、V30分別表示患側肺受照劑量5、10、20、30 Gy以上的體積,Dmean表示患側肺的平均劑量,心臟V30表示心臟受照劑量30 Gy以上的體積。OAR需對放射劑量加以限制,患側肺V5<50%、V10<40%、V20<25%、V30<20%分別表示患側肺受照劑量5 Gy以上的體積不超過50%,10 Gy以上的體積不超過40%,20 Gy以上的體積不超過25%,30 Gy以上的體積不超過20%,Dmean<15 Gy表示患側肺的平均劑量不超過15 Gy,心臟V30<40%表示心臟受照劑量30 Gy以上的體積不超過40%。
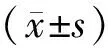
2 結果
2.1 OAR劑量及體積參數個體化3D打印膜計劃中患側肺的V20、V30、Dmean及心臟的V30均低于市售組織補償膜(均P<0.05)。見表1。
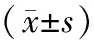
表1 個體化3D打印補償膜與市售胸壁補償膜的OAR劑量學比較
注:OAR—危及器官。
2.2 靶區劑量及體積參數(1)個體化3D打印補償膜PTV中的D98%、D95%、D5%、D2%低于市售胸壁補償膜(均P<0.05),HI相對于市售胸壁補償膜更具有優勢(P<0.05)。(2)個體化3D打印補償膜與市售胸壁補償膜的PTV在VPTV、VPres-PTV、CI間的差異有統計學意義(均P<0.05)。見表2。
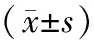
表2 個體化3D打印補償膜與市售胸壁補償膜的PTV劑量學比較
注:PTV—計劃靶區;HI—靶區均勻性指數;CI—適形度指數。
3 討論
放射治療已成為乳腺癌綜合治療中的重要組成部分,乳腺癌根治術后的患者接受輔助放療可提高局控率及總生存率[6]。雖然目前的放療技術在逐漸發展,但由于高能放射線具有劑量建成區的客觀特性[7],臨床上對乳腺癌根治術后的放射治療需要精準定位靶區,提高靶區劑量分布的均勻性,減少肺組織及心臟的照射容積和照射劑量,所以在制定乳腺癌根治術后放療計劃時往往都采取添加組織等效補償膜,以建成劑量效應補償,從而保證淺表腫瘤獲得足夠的治療劑量[8]。本文主要研究了胸壁市售補償膜和個體化3D打印膜在靶區劑量與OAR劑量上的優劣勢,為今后臨床實踐選擇合適的放射治療技術提供參考。
乳腺癌根治術的放射治療中,等效組織補償膜的臨床應用對皮膚表面劑量有較大影響,它能增加皮膚劑量,如添加有效的等效組織補償膜,可以將6 MV-X射線皮膚劑量由10%~40%提高到接近100%[9]。臨床上最常應用的組織補償膜為市售的20 cm×20 cm大小,具有一定厚度和軟硬度的方形等效組織補償膜,但人體體表往往是不平坦的甚至不規則的曲面,因此兩者之間必然存在空氣間隙,空氣間隙的存在可降低表面劑量[10-11]。5 mm空氣間隙時表面劑量就下降10%,空氣間隙為5~30 mm時表面劑量變化較小,之后隨空氣間隙進一步增大,表面劑量又有較明顯下降。為了盡可能減小不同空氣間隙對測量和計算劑量的影響,保持測量和計算條件的一致,需盡可能將等效組織補償膜貼合于皮膚表面[12-13]。本研究所使用的個體化3D打印膜新技術和市售胸壁補償膜相比,具有保證乳腺癌根治術放療劑量的準確性及穩定性的優點[14-15],主要表現在以下3個方面。(1)組織均勻性好。采用聚乳酸(polylactic acid,PLA)打印出個體化模型,PLA是一種新型的生物基及可再生生物降解材料,由可再生的植物資源(如谷類秕殼、稻草、麥稈)所提出的淀粉原料制成,具有環保性、打印流動性好、無毒、不易翹邊、打印的體膜收縮率低等優點。(2)個體化程度高。根據患者自身設計出來的,可以緊密貼合在乳腺癌患者的胸壁上,二者之間存在的空氣間隙較小,劑量分布及計劃系統劑量計算準確性高。(3)重復性好。根據個體自身設計的3D打印膜使臨床治療時靶區實際所受劑量與計劃系統中的受量更為接近,更為精確[16],可以保證分次治療間的精確度,確保放療劑量,從而提高乳腺癌的治療效果。
3D打印技術因其特有的優勢已經被越來越多地應用于醫療領域中,在臨床的一些科室,如口腔科、骨科、眼科已被廣泛使用,腫瘤放療中的3D打印技術可以在CT掃描后根據腫瘤位置形態制作出更適合的補償物,劑量分布會更理想,有待于進一步開展[17-18]。本研究結果顯示,在靶區的劑量均勻性和適形度上,3D打印膜優于市售組織補償膜,這與3D打印膜是根據個體設計而成,皮膚包裹效果較好,減少了與胸壁之間的空氣間隙有關[19-21]。3D打印膜的重復性好,保證分次治療的劑量,從而保證乳腺癌根治術后放射治療的總劑量及療效。在OAR上,相比于市售組織補償膜,3D打印補償膜使肺的受照體積及平均劑量減少,且心臟的受照射體積也減少,使OAR肺和心臟得到保護,減少了放療后的不良反應。乳腺癌根治術后放射治療中應用個性化、材質舒適、擺位重復性和貼合性好的3D打印補償膜,可有望解決補償膜與胸壁之間的空氣間隙問題,使胸壁放療時劑量更加精確。
綜上,從精確放射治療上來講,等效組織膜是乳腺癌患者所需要的,因個體不同而設計的3D打印補償膜在靶區照射劑量及重要OAR劑量的效果優于市售胸壁補償膜,建議有條件的醫療機構可利用3D打印技術開展乳腺癌的放射治療。

