黃菖蒲對阿特拉津脅迫的生理響應
夏凡,李翠,陳傳勝,王慶海,*
1. 北京市農林科學院北京草業與環境研究發展中心,北京 100097 2. 中南林業科技大學環境科學與工程學院,長沙 410004
阿特拉津是一種內吸傳導型除草劑,常用于一年生禾本科雜草和闊葉雜草的防除。阿特拉津殘留期及應用歷史長和使用范圍廣,導致的環境問題日益突出[1]。我國長江流域、黃河流域和松花江流域等重點流域地表水中阿特拉津的檢出率為100%[2],曾為北京重要飲用水水源地的官廳水庫,水體阿特拉津的檢出量為206 ng·L-1,含量明顯高于其他有機氯農藥[3]。即使在阿特拉津已禁用的德國,降雨、飲用水、地表水和地下水中仍能檢出[4]。阿特拉津通過阻止光系統Ⅱ(PSⅡ)的電子傳遞,抑制植物的光合作用[5]。因此,水體阿特拉津污染會對水生植物造成脅迫,甚至可能導致敏感植物種類消亡。地表水除草劑污染被認為是繼富營養化之后,又一個致使植物種群下降的重要因素[6]。關于除草劑對植物生長和生理特性的影響已有大量研究報道。研究表明,阿特拉津對沉水植物菹草(Potamogetoncrispus)和穗花狐尾藻(Myriophyllumspicatum)的生長具有顯著抑制作用[7];阿特拉津顯著增加植物葉片中的活性氧(ROS)和丙二醛(MDA)含量,導致植物氧化損傷[8];水蔥(Scirpustabernaemontani)在阿特拉津脅迫下,過氧化物酶(POD)活性升高以清除ROS,減輕膜脂過氧化程度;但隨著脅迫強度增加,POD不斷消耗最終導致其活性下降[9];即使對阿特拉津具有一定耐受性的黃菖蒲(Irispseudacorus),長時間脅迫也會使其光合效率顯著下降[10]。長期暴露于阿特拉津的大葉藻(Zosteramarina),即使濃度較低(10 μg·L-1),仍會導致其能量供應減少,碳氮代謝改變[11]。
水生植物暴露于阿特拉津,會調控一系列生理生化過程應對脅迫,其中,防御酶和光合系統的響應尤為重要。植物在逆境條件下光合電子傳遞過程中光能轉化和利用與ROS代謝之間有著密切聯系[12]。雖然,目前關于除草劑對植物生理特性的影響已大量研究報道,但較少涉及阿特拉津脅迫下不同防御酶間的協調作用,以及植物光合效率與防御酶活性間的關系。黃菖蒲是多年生挺水植物,在水體污染物去除和生態景觀建設中經常用到,且對阿特拉津有較強的耐受性[13]。本試驗以黃菖蒲為材料,研究抑菌和無抑菌條件下阿特拉津脅迫對植物光合特性和防御酶活性的影響,分析光合特性與防御酶活性間的相關性,以期闡明植物防御酶在應對脅迫過程中的調控作用,為揭示挺水植物對阿特拉津的耐受機理提供一定的理論依據。
1 材料與方法(Materials and methods)
1.1 試驗材料
供試植物黃菖蒲為北京市農林科學院溫室育苗盤培養。挑選長勢一致的幼苗(單株平均鮮重(4.5±0.8) g),進行水培試驗前清洗植物根部泥土,添加1 L 10% Hoagland營養液緩苗1周。將植物移入培養桶(直徑30 cm,高26 cm)中,每個桶中放置3株植物,并添加1 L 10% Hoagland營養液。
1.2 試驗設計
設置阿特拉津濃度和抑菌2個因素。有關文獻報道,阿特拉津在環境中的最大檢出量為100~200 μg·L-1[14],為保證本試驗各濃度阿特拉津對黃菖蒲保持較高的逆境脅迫,以便快速得到阿特拉津對植物生理毒性的相關數據,按倍數設置相關濃度梯度,依次為0.1、0.5、1、2、4和8 mg·L-1,空白對照組不添加阿特拉津。微生物,特別是細菌,可以通過降解阿特拉津、改善植物根際環境提高植物在逆境條件下的抵御能力,促進植物生長[15-16]。為分析細菌對植物應對阿特拉津脅迫的影響,添加氨芐青霉素(10 mg·L-1)作為抑菌處理,該濃度的氨芐青霉素可有效抑制細菌生長,但對植物生長無明顯影響[17];不添加氨芐青霉素作為無抑菌處理。共14個處理,每個處理3次重復,每個重復3株幼苗。所有處理均置于日光溫室培養,培養溫度21~35 ℃,光強約為自然光強的60%,培養21 d后取樣。
1.3 生理指標的測定
脅迫處理21 d后,原位測定葉綠素熒光參數。用便攜式光合測定分析儀(LI-6400,Li-COR公司,美國)測定黃菖蒲由外向里第2葉的熒光參數,測定前先將葉片暗適應20 min,照射檢測光后測得初始熒光(Fo),照射飽和激發光后測得最大光能轉化效率(Fv/Fm)、光化學淬滅系數(qP)、非光化學淬滅系數(qN)和電子傳遞速率(ETR),每個處理測定9個點。再將植物從營養液中取出,洗凈擦干,帶回實驗室測定生理指標。葉片葉綠素含量的測定采用丙酮浸泡過夜法[18]。防御酶選擇植物在應對阿特拉津脅迫過程具有重要作用的超氧化物歧化酶(SOD)、POD和多酚氧化酶(PPO)[19-20],SOD采用氮藍四唑法,POD采用愈創木酚比色法,PPO用鄰苯二酚法,MDA含量采用硫代巴比妥酸法[21]。
1.4 數據統計與分析
采用軟件SPSS 22.0統計分析數據,通過多因素方差分析比較各項測試指標差異顯著性,顯著性水平設置為P<0.05、P<0.01;采用Origin 8.5作圖。
2 結果與分析(Results and analysis)
2.1 阿特拉津脅迫對黃菖蒲葉綠素含量的影響
隨著阿特拉津脅迫濃度的增加,植物葉綠素含量(圖1(a))和葉綠素a/b值(圖1(b))均呈現下降趨勢,葉綠素含量的降幅大于葉綠素a/b值下降幅度。抑菌條件下,當脅迫濃度≥2 mg·L-1時,葉綠素含量顯著下降,降幅超過30%,8 mg·L-1處理組降幅達到68%。與此同時,黃菖蒲表現出長勢低矮、葉片枯黃等癥狀。無抑菌條件下,僅8 mg·L-1處理組葉綠素含量顯著下降,各濃度處理組葉綠素a/b值與對照組均無顯著差異;而抑菌條件下,最高劑量處理組(8 mg·L-1)顯著降低,降幅為37%。
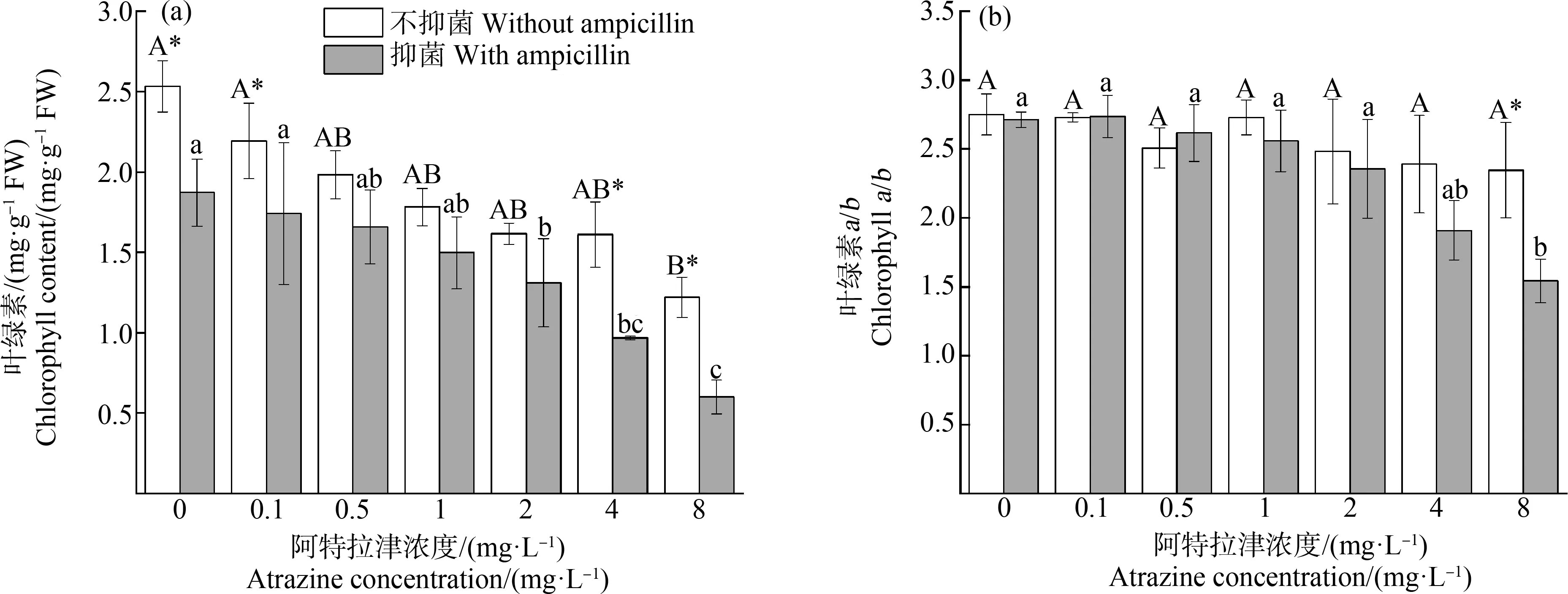
圖1 阿特拉津脅迫對黃菖蒲葉綠素含量(a)及葉綠素a/b值(b)的影響注:不同大寫字母表示不抑菌條件下各濃度之間差異顯著,不同小寫字母表示抑菌條件下各濃度之間差異顯著(P<0.05);*和**分別表示同一濃度抑菌和無抑菌之間差異顯著水平在P<0.05和P<0.01;下同。Fig. 1 Effects of atrazine on chlorophyll content (a) and chlorophyll a/b (b) in Iris pseudacorusNote:Different uppercase and lowercase letters indicate significant differences among treatments with different concentrations under nature and sterile conditions (P<0.05), respectively; * and ** indicate significant differences between nature and sterile conditions at the same treatment concentration at 0.05 and 0.01 levels, respectively; the same below.
2.2 阿特拉津脅迫對黃菖蒲葉綠素熒光參數的影響
不同濃度阿特拉津脅迫下黃菖蒲Fo變化如圖2(a)所示。無抑菌條件下,低濃度處理組(≤4 mg·L-1)與對照組無顯著性差異,當脅迫濃度達到8 mg·L-1時顯著降低,降幅為17%。抑菌條件下,Fo隨脅迫濃度的升高呈現先降后升趨勢,2 mg·L-1處理組Fo最低,4 mg·L-1和8 mg·L-1處理組又上升。
隨著阿特拉津脅迫濃度增大,黃菖蒲的Fv/Fm呈漸降趨勢(圖2(b)),表現出明顯的劑量-效應關系。無抑菌條件下,除最大濃度8 mg·L-1處理組顯著降低,其余均與對照組相比無顯著性差異。抑菌條件下,0.1 mg·L-1處理組Fv/Fm無顯著影響;但當濃度≥0.5 mg·L-1時,Fv/Fm呈現顯著下降。
無抑菌條件下各濃度處理組qP差異不顯著(圖2(c))。抑菌條件下0.1 mg·L-1和0.5 mg·L-1處理組較對照組略上升,但差異不顯著;4 mg·L-1和8 mg·L-1處理組qP較對照組分別下降了34%和57%,呈顯著性差異。這表明,抑菌和高濃度共同作用對qP影響顯著。
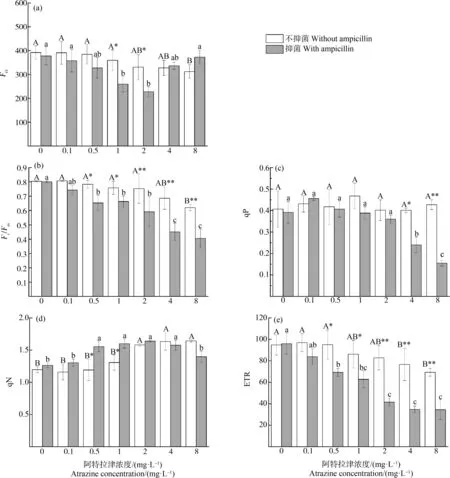
圖2 阿特拉津脅迫對黃菖蒲葉綠素熒光參數的影響注:Fo、Fv/Fm、qP、qN和ETR分別表示初始熒光、最大光能轉化效率、光化學淬滅系數、非光化學淬滅系數和電子傳遞速率。Fig. 2 Effects of atrazine on chlorophyll fluorescence parameters of Iris pseudacorusNote: Fo stands for minimal fluorescence; Fv/Fm stands for maximal quantum yield of PSⅡ; qP stands for photochemical quenching; qN stands for non-photochemical quenching; ETR stands for photosynthetic electron transport rate.
阿特拉津對黃菖蒲qN的影響如圖2(d)所示。無抑菌條件下qN隨阿特拉津濃度的增加而升高,0.1~1 mg·L-1處理組與對照組相比無顯著性差異,2~8 mg·L-1處理組較對照組顯著增加。抑菌條件下隨著阿特拉津濃度的升高,qN呈現先升后降趨勢,在2 mg·L-1處理組達到最大值,而4~8 mg·L-1處理組又降低,表明此時植物PSⅡ反應中心結構可能已經受到了破壞。
阿特拉津對黃菖蒲ETR的影響如圖2(e)所示。無抑菌條件下,0.1~2 mg·L-1處理組黃菖蒲ETR所受影響不明顯,ETR保持在74~94之間;阿特拉津濃度增加至4 mg·L-1,ETR呈現顯著降低,4 mg·L-1和8 mg·L-1處理組降幅分別達17%和25%,說明高濃度阿特拉津對黃菖蒲存在一定的抑制作用。抑菌條件下隨著阿特拉津濃度的升高,ETR急劇下降。除0.1 mg·L-1處理組與對照組無顯著差異外,其余各濃度處理組與對照組均差異顯著。
2.3 阿特拉津脅迫對黃菖蒲葉片MDA含量的影響
隨著阿特拉津濃度的升高,葉片MDA含量表現出明顯的先升再降趨勢(圖3(a))。無抑菌條件下,脅迫濃度≥0.5 mg·L-1時顯著增加,在4 mg·L-1處理組達到最大值,8 mg·L-1處理組略微下降。抑菌條件下各脅迫濃度均顯著增加,在2 mg·L-1處理組達到最大值,4 mg·L-1和8 mg·L-1處理組又降低。
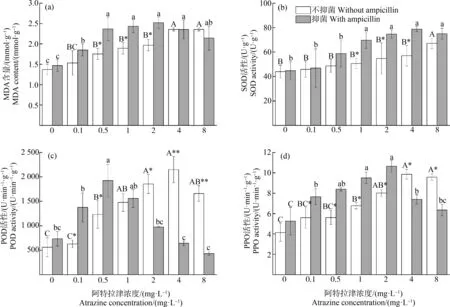
圖3 阿特拉津脅迫對黃菖蒲丙二醛(MDA)含量和抗氧化酶活性的影響注:SOD表示超氧化物歧化酶,POD表示過氧化物酶,PPO表示多酚氧化酶。Fig. 3 Effects of atrazine on malondialdehyde (MDA) content and antioxidant enzyme activities of Iris pseudacorusNote: SOD stands for superoxide dismutase; POD stands for peroxidase; PPO stands for polyphenol oxidase.
2.4 阿特拉津脅迫對黃菖蒲抗氧化酶活性的影響
無抑菌條件下,黃菖蒲葉片SOD活性隨著阿特拉津濃度的增加呈現上升趨勢,8 mg·L-1處理組與對照組相比差異顯著,其余濃度處理組無顯著差異(圖3(b))。抑菌條件下SOD活性呈現先升后降趨勢,4 mg·L-1處理組SOD活性達最大,是對照組的1.6倍;8 mg·L-1處理組SOD活性略降,但仍與4 mg·L-1處理組處于同一水平。
阿特拉津脅迫下,黃菖蒲葉片POD活性顯著增加,隨阿特拉津濃度的增加呈現先升后降趨勢(圖3(c))。無抑菌條件下,0.1 mg·L-1處理組與對照組無顯著差異,4 mg·L-1處理組達到最大,是對照組的3.84倍;當阿特拉津濃度為8 mg·L-1時下降,但仍顯著高于對照組。抑菌條件下,POD活性在阿特拉津濃度為0.5 mg·L-1時達到峰值,是對照組的2.62倍;隨著脅迫濃度進一步增加急劇下降,4 mg·L-1和8 mg·L-1處理組與對照組相比無顯著差異,抑菌處理條件下POD活性在脅迫濃度達到4 mg·L-1時已被抑制。
植物葉片PPO活性變化與POD類似,隨阿特拉津的濃度的增加先升后降(圖3(d))。無抑菌條件下,當濃度達到1 mg·L-1時,PPO活性與對照組開始呈現顯著性差異,濃度為4 mg·L-1時最大,8 mg·L-1時下降,但仍顯著高于對照組。抑菌條件下阿特拉津濃度為0.1 mg·L-1時,PPO活性已顯著高于對照組;當濃度為2 mg·L-1時達到峰值,是對照組的2.03倍,其后PPO活性下降;當濃度為8 mg·L-1時,PPO活性雖高于對照組,但二者差異不顯著。
2.5 相關性分析
為了進一步研究抑菌和無抑菌條件下各因素之間的關系,進行相關性分析。由表1可知,無抑菌條件下,MDA含量與葉綠素a/b值、Fv/Fm和ETR呈顯著負相關,與qN呈顯著正相關。SOD活性與Fv/Fm呈現顯著負相關,POD活性與ETR呈顯著負相關,PPO活性與葉綠素a/b值、Fv/Fm、qN和ETR呈顯著負相關,與MDA含量呈現顯著正相關。抑菌條件下,MDA含量與葉綠素含量、葉綠素a/b值、Fv/Fm、qP和ETR呈顯著負相關。SOD活性與qN呈現顯著正相關,PPO活性與Fo呈顯著負相關,與qN呈正相關關系。
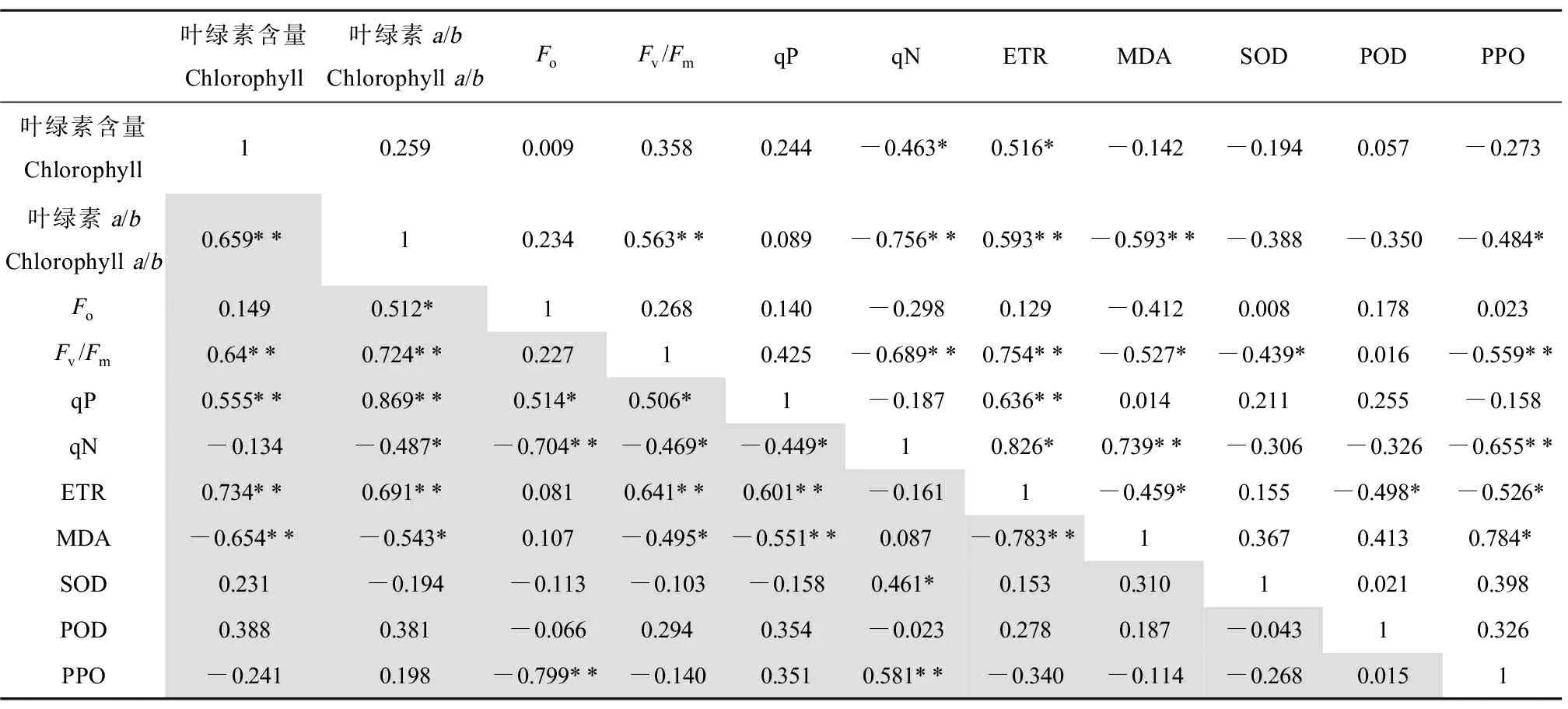
表1 抑菌和無抑菌條件下各指標之間的皮爾森相關系數Table 1 Pearson correlation coefficients for these indicators under nature and sterile conditions
3 討論(Discussion)
3.1 阿特拉津脅迫對黃菖蒲的毒性效應
隨著阿特拉津濃度的增加,葉綠素含量下降,但葉綠素a/b值維持在正常水平。MDA含量升高。王慶海等[22]研究蘆葦對阿特拉津的抗逆性時發現,脅迫1周后,0.5、1、2和4 mg·L-1處理組葉綠素a/b值顯著降低,而脅迫2周后,各處理組與對照組差異不顯著,這表明,在阿特拉津脅迫后期,葉綠素含量降低,植物通過調整葉綠素a/b值提高葉片光合能力,是植物對阿特拉津脅迫的一種適應性保護機制。MDA是脅迫下膜脂過氧化物的最終產物,其含量可以間接反映植物遭受脅迫毒害的程度。植物葉片中MDA積累越多,細胞膜受到的損傷越大[23]。本試驗中,MDA含量在無抑菌條件下低濃度(0.1 mg·L-1)處理組與對照組處于同一水平;隨著阿特拉津濃度的增加逐漸升高,這表明,阿特拉津對黃菖蒲具有明顯的劑量毒性效應,但不同的是,抑菌處理組植物在高濃度脅迫下MDA含量下降,可能此時植物遭受除草劑脅迫已超過其耐受限度,植物衰敗死亡。這說明,微生物可以在一定程度上減輕阿特拉津的植物毒性,這可能與微生物能夠促進阿特拉津降解有關。
3.2 阿特拉津脅迫對植物光合特性的影響
葉綠素熒光常用于評價光合系統的效能和環境脅迫對光合系統的影響,具有反映植物“最真實內在”的特點[24]。Fo反映PSⅡ天線色素內的最初激子密度、天線色素之間以及天線色素到PSⅡ反應中心的激發能傳遞機率的結構狀態[25]。Fo增加量越多,類囊體膜受損程度越嚴重[26]。Fv/Fm代表PSⅡ的最大光能轉化效率和最大量子產量,非脅迫條件下變化極小,可作為反映受脅迫程度的主要指標[27]。本試驗低濃度條件下植物受到的脅迫損傷較小;高濃度脅迫時,無抑菌處理組Fo顯著降低,Fv/Fm變化并不明顯,植物只是發生了光抑制;而抑菌條件下,Fo亦顯著升高,Fv/Fm明顯降低,表明阿特拉津誘發了氧化脅迫,此時植物的PSⅡ反應中心結構可能已經受到了損害或失活,也可能是葉片類囊體膜受到損傷。這也進一步表明,微生物可以在一定程度上減輕阿特拉津的植物毒性,植物能維持較高的光化學轉化效率。
qP和qN這2個參數可以綜合反映葉片對激發能利用的情況[28]。ETR是PSⅡ反應中心在進行光合作用時電子傳遞的速率,它直接影響光合速率的大小。本試驗條件下,阿特拉津脅迫濃度達到4 mg·L-1時,qP變小,qN顯著增大,ETR顯著下降,表明黃菖蒲PSⅡ反應中心開放部分的比例降低,電子傳遞能力減弱,用于光合作用的能量減少,光能中用于非光化學反應的能量增加。qN增大表明植物將不能用于光化學電子傳遞的能量通過熱量的形式耗散掉,這也是植物的一種自我保護機制[29]。
3.3 阿特拉津脅迫對防御酶活性的影響
植物暴露于阿特拉津時,會激發SOD、POD和PPO等防御酶活性。本試驗濃度范圍內,POD和PPO活性隨著脅迫濃度的增加先升后降,SOD活性則呈現持續增加趨勢,表明POD和PPO對細胞的保護作用存在一個劑量閾值,當脅迫強度大于該閾值時,酶的保護作用減弱。此外,劑量閾值在無抑菌條件下高于抑菌條件,表明微生物可以減輕阿特拉津對黃菖蒲的脅迫,擴大了黃菖蒲對阿特拉津脅迫的耐受范圍。當脅迫強度加大至8 mg·L-1時,POD和PPO活性下降,SOD活性顯著升高,體現了植物防御酶間的協調作用。
3.4 阿特拉津脅迫下防御酶系統與光合參數的關系
植物暴露于低濃度阿特拉津時,植物體內抗氧化系統啟動應對脅迫,POD活性顯著增加,可有效清除活性氧和維持植物體內活性氧的正常水平。本研究表明,阿特拉津濃度≤1 mg·L-1時,植物在無抑菌條件下可通過自身的抗氧化系統清除活性氧,調節機體維持正常的光合作用。當脅迫濃度增至2 mg·L-1,PPO活性也顯著增加,參與應對脅迫,但qN顯著增加,植物的光能利用率下降。當脅迫濃度達到4 mg·L-1時,植物ETR也明顯降低,POD和PPO活性達到最大,但Fo和Fv/Fm仍與對照組無顯著差異,表明植物仍可維持正常水平的葉綠素濃度和PSⅡ初始光能轉化效率。當脅迫濃度達到8 mg·L-1時,SOD活性顯著增強,但POD和PPO活性顯著下降,植物Fo升高,Fv/Fm、qP和ETR顯著降低,表明脅迫已超過植物可承受范圍,PSⅡ光化學中心受損或失活。0.1~1 mg·L-1范圍內,植物葉綠素熒光參數與對照組無顯著差異,而POD活性隨脅迫濃度的增加顯著升高,SOD和PPO活性變化卻并不明顯,表明POD活性可作為植物在低強度脅迫下的典型氧化應激指標。由于POD活性在試驗濃度范圍內先升后降,其與多數葉綠素熒光參數的相關性并不顯著。PPO活性與Fo、葉綠素a/b值顯著相關,表明其對保護植物葉綠體具有重要作用。PPO活性與Fv/Fm、MDA含量均呈顯著負相關,其活性可以表征阿特拉津的脅迫強度。這些相關性體現了植物防御酶在應對阿特拉津脅迫過程中的分工與協作,也反映了植物的調控能力。
逆境脅迫下,植物根據損傷部位及程度,啟動調節各抗氧化酶同時或不同時地發揮作用,以緩解氧化傷害[30]。本文僅選取了3種酶,并不能全面反映植物防御酶系統對阿特拉津脅迫的響應特征。為進一步揭示植物防御酶系統對阿特拉津脅迫的響應機制,今后應對典型防御酶活性變化規律進行系統研究。特別是基因敲除技術的應用,為比較評價單一酶參與應對脅迫的作用提供了可能。
綜上所述,本研究結果表明,阿特拉津通過與葉綠體類囊體膜上的蛋白質結合阻斷電子傳遞,多余的電子形成活性氧而使葉綠體受毒害,抑制植物光合作用。POD、SOD和PPO活性在不同阿特拉津脅迫強度下的變化,體現了植物防御酶在活性氧清除過程中的協調作用。PPO活性與多個葉綠素熒光參數、MDA含量呈現良好的線性關系,可以作為表征植物光合作用受抑制程度及受氧化損傷程度的指標。阿特拉津濃度≤4 mg·L-1時,黃菖蒲仍能維持正常水平的葉綠素含量和葉綠體光合作用的光化學效率。微生物可能通過降解阿特拉津降低脅迫濃度來緩解阿特拉津對植物的毒害作用。

