CDKN2A基因在非小細胞肺癌中表達及生物學功能生物信息分析
方紅
肺癌(lung cancer)根據病理類型分為小細胞肺癌和非小細胞肺癌,其中非小細胞肺癌約占全部肺癌患者的80%左右[1-2]。新近的流行病學數據顯示,肺癌在男性發病率和死亡率均占到了第一位,在女性死亡率占到第一位而發病率僅次于乳腺癌占第二位[3]。肺癌患者預后不良,容易早期發生遠處轉移。然而肺癌的確切發病機制仍不十分清楚,目前的研究結果認為其發病與吸煙、環境和遺傳等因素有關。隨著分子生物學技術、基因表達譜芯片及二代測序技術的發展,大規模、高通量在基因分子水平上探討肺癌發病機制成為可能[4]。同時也為肺癌的治療提供了新的方向[5]。在本研究中,我們采用生物技術方法探討細胞周期蛋白依賴激酶抑制劑2A在NSCLC中的差異表達、可能生物學功能及與患者的預后關系。
資料與方法
一、相關數據庫選擇
選擇癌癥基因組圖譜數據庫(TCGA)比較NSCLC患者癌組織、正常肺組織的差異表達水平及其與患者預后關系;采用蛋白-蛋白相互作用數據庫STRING進行PPI網絡分析。David數據庫進行功能富集和KEGG信號通路分析。
二、CDKN2A差異表達、功能富集和信號通路分析
TCGA數據庫中檢索“非小細胞肺癌”和“CDKN2A基因”檢索物種為人類,分析比較CDKN2A基因表達水平在NSCLC患者癌組織和正常肺組織中是否存在差異。同時分析了TRIM26基因在多種人體腫瘤中的表達水平,存在差異的條件為基因|Log2FC|>1,P<0.05。CDKN2A基因及相互作用蛋白進行功能富集和信號通路分析。功能包括,細胞定位、分子功能和生物學過程。
三、 蛋白網絡構建
CDKN2A基因編碼蛋白進行相互作用網絡構建,STRING (http://string-db.org/cgi/input.pl)[6],相互作用蛋白網絡構建條件為置信度大于0.7。
四、預后分析
CDKN2A基因高低表達按NSCLC患者腫瘤組織中位數進行劃分,并繪制高低表達組Kaplan-Meier生存曲線進行log-rank檢驗,對比總生存和無疾病進展生存有無差異。
五、免疫組化檢測CDKN2A表達
回顧性分析我院近5年收治并手術治療的非小細胞肺癌(NSCLC)患者62例為研究對象。62例患者中男性41例,女性21例,平均年齡68.8±11.2歲,其中腺癌34例,鱗癌28例。采用免疫組化SP法檢測患者腫瘤組織和對應的癌旁組織中CDKN2A的表達水平。比較癌組織和癌旁組織中CDKN2A表達水平是否存在差異。同時采用log-ran檢驗比較CDKN2A陽性和陰性表達組患者生存期是否存在差異。
六、統計學處理
相關聚類、差異表達、蛋白網路等采用在線軟件分析,生存數據采用log-rank檢驗,P<0.05為有統計學差異。
結 果
一、CDKN2A在非小細胞肺癌中的表達
CDKN2A基因在多種實體腫瘤包括乳腺癌、食管癌、腸癌等中表達水平明顯上調(圖1A)。在NSCLC患者(包括腺癌和鱗癌)癌組織中CDKN2A表達水平均明顯高于對應的正常肺組織(pall<0.05),圖1B。而CDKN2A表達水平與腫瘤分期無明顯相關性,P>0.05(圖1C)。
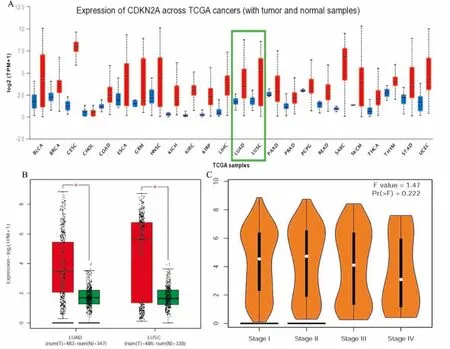
圖1 細胞周期蛋白依賴激酶抑制劑2a(CDKN2A)在腫瘤組織與正常組織中的表達比較
A: CDKN2A在多種腫瘤中的表達比較,紅色為腫瘤組織,藍色為癌旁組織; B:NSCLC患者(包括鱗癌和腺癌)癌組織與對應的癌旁組織中CDKN2A表達比較,紅色為腫瘤組織,綠色為癌旁組織;C: CDKN2A與NSCLC患者分期關系
二、CDKN2A相關蛋白PPI網絡構建
CDKN2A相關蛋白PPI網絡中(圖2),蛋白之間的相互作用關系指數為24.8,區域聚類指數為0.74,相互作用蛋白呈現明顯的聚類表達,P<0.05(見圖3)。
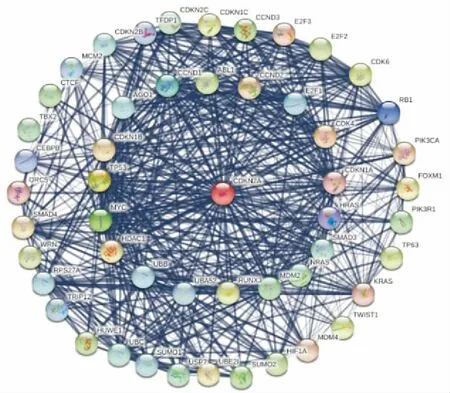
圖2 CDKN2A相關蛋白PPI網絡
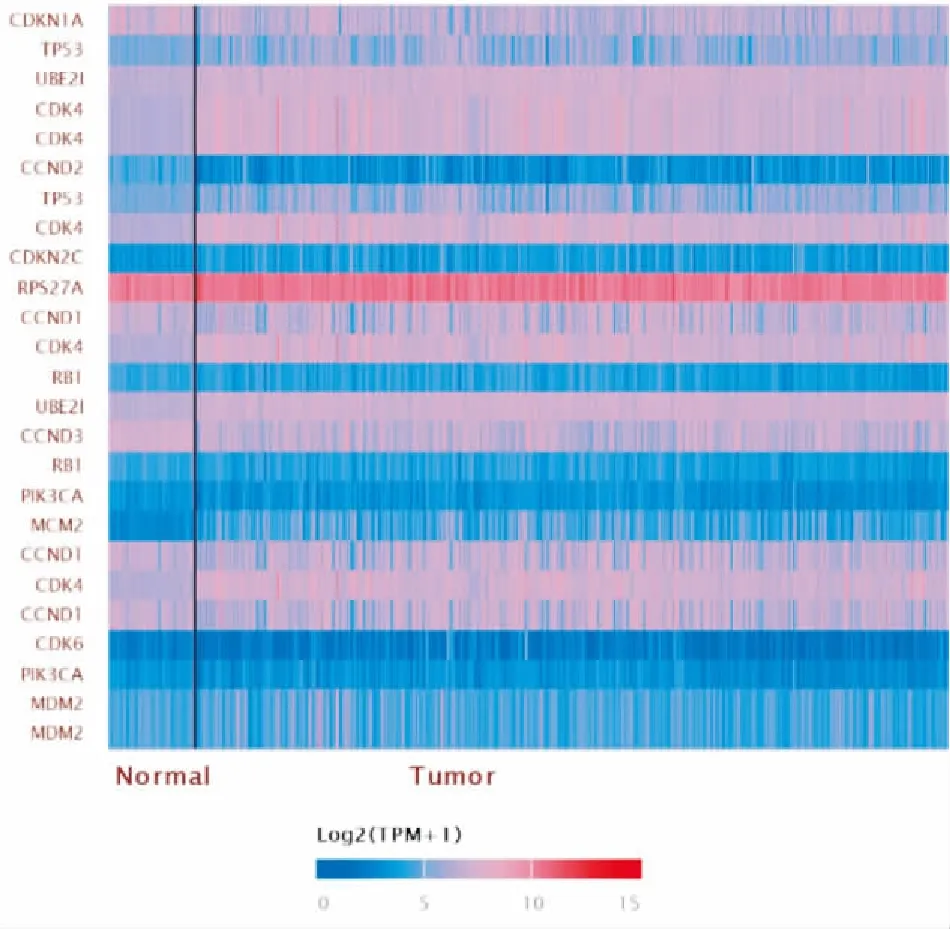
圖3 CDKN2A相關蛋白聚類分析熱圖
三、GO和KEGG功能富集和信號通路分析
CDKN2A編碼蛋白主要定位在細胞核、細胞膜和囊泡,分子功能主要為蛋白結合、核蛋白結合和鐵結合。而生物學過程主要集中于代謝、細胞增殖及對刺激的反應(圖4)。KEGG信號通路主要為細胞周期調控、DNA蛋白結合以及Wnt信號通路。
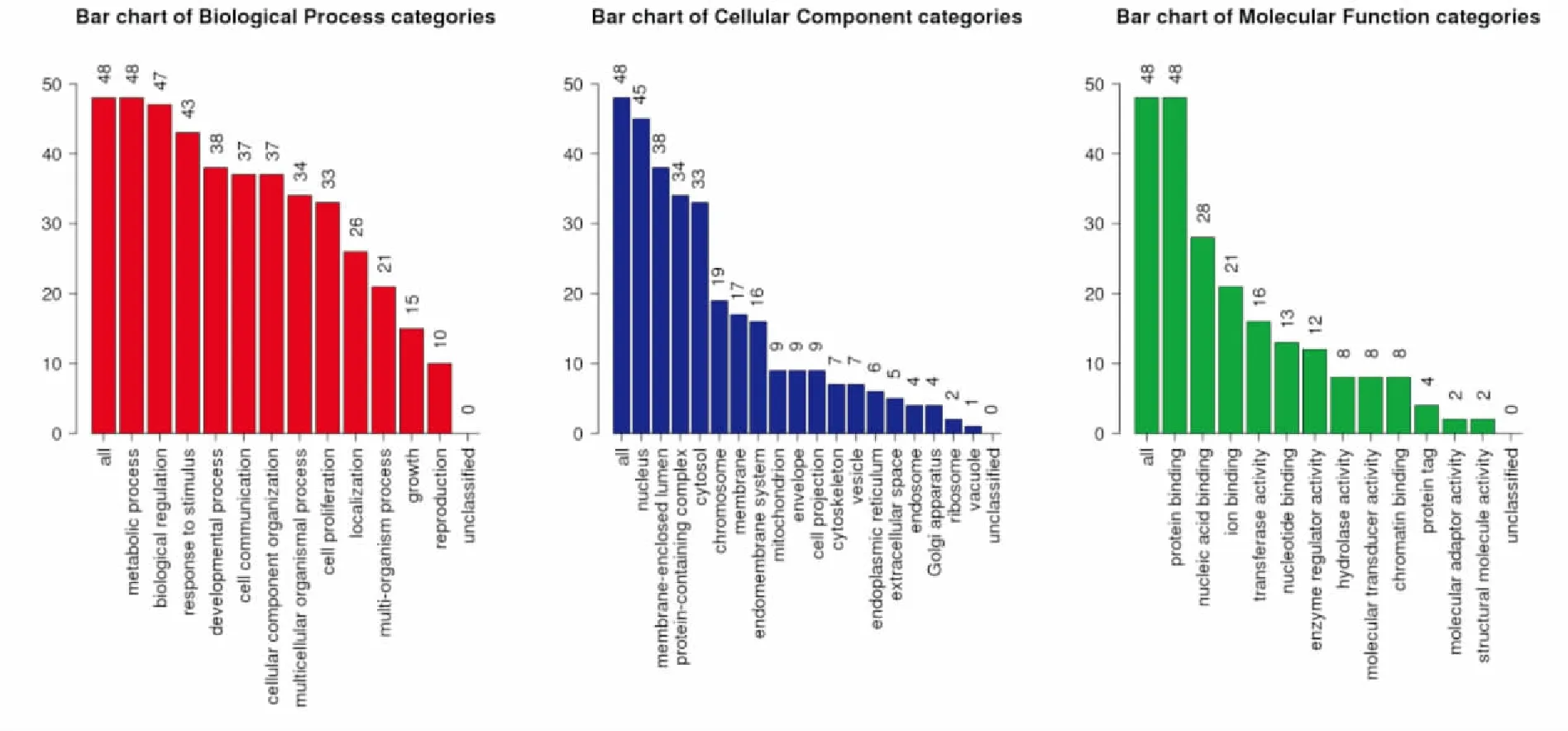
圖4 CDKN2A基因功能富集
四、 生存分析
CDKN2A高表達NSCLC患者總生存期明顯低于低表達組,且差異有統計學意義(HR=1.3,P=0.02),而CDKN2A高低表達組間,NSCLC患者無疾病進展生存無統計學差異(HR=0.94,P=0.59)(圖5)。
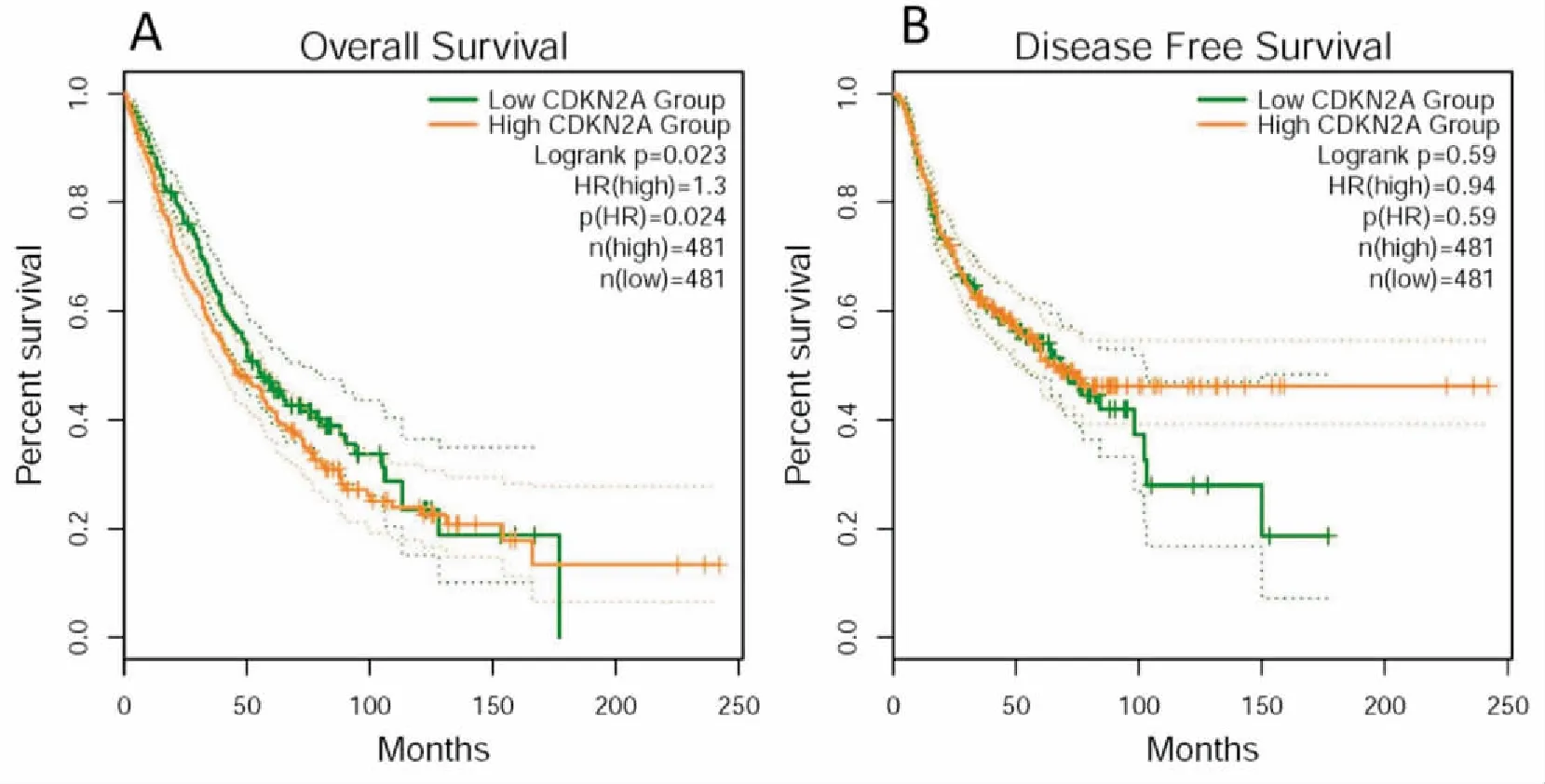
圖5 CDKN2A高低表達組與NSCLC患者預后關系的生存曲線(A:NSCLC患者總生存比較;B:NSCLC患者無疾進展生存比較)
五、免疫組化CDKN2A表達及其與患者預后
62例NSCLC患者癌組織中CDKN2A陽性表達11例(17.7)而對應癌旁組織中陽性表達49例(79.0%),癌組織中CDKN2A陽性標的率顯著高于癌旁組織,且差異有統計學意義(P<0.05)。而CDKN2A陽性組與陰性組患者生存期差異無統計學意義(HR=0.99,P>0.05)(圖6)。
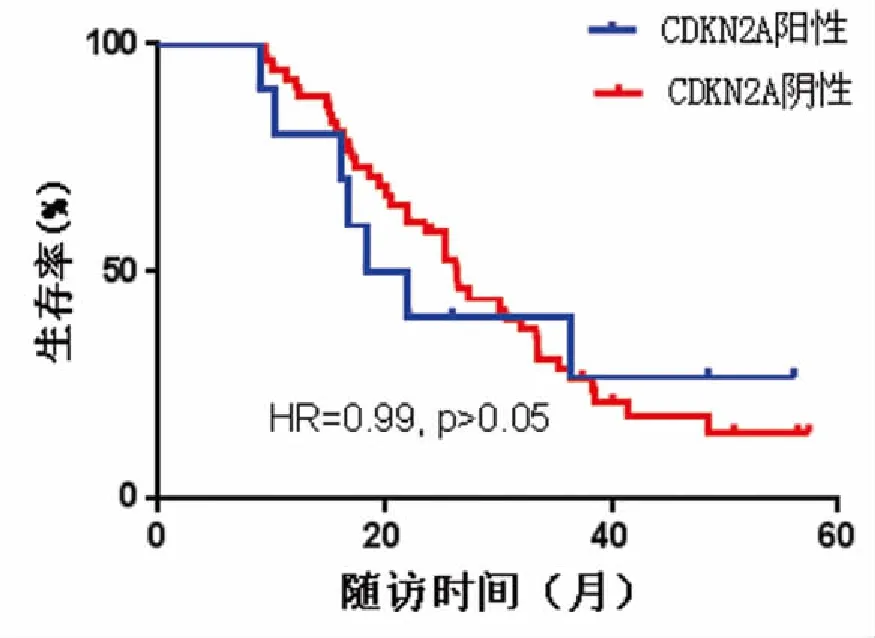
圖6 CDKN2A陽性組與陰性組患者生存曲線
討 論
細胞周期蛋白依賴激酶抑制劑2A(CDKN2A)或P16INK4A,在人類定位于9號染色體,21區[7-8]。該基因全場8500bp,包括3個外顯子,編碼一個由148個氨基酸組成的蛋白。該基因首先在上世紀90年代初由Serrano發現,后續研究中認為其可與CDK4、CDK6結合,抑制周期素與CDK4形成具激酶活性的復合物,從而阻斷該復合物對RB蛋白磷酸化,導致細胞停止于G,從而抑制了細胞的增殖,是一個細胞周期依賴的蛋白。1994年(美國冷泉港實室)新發現CDKN2A是一種細胞周期中的基本基因,直接參與細胞周期的調控,負有調節細胞增殖及分裂,在人類50%腫瘤細胞株中發現有純合子缺失,認為p16是比p53更重要的一種新型抗癌基因有人把它比作細胞周期中的剎車裝置,一旦失靈則會導致細胞惡性增殖,導致惡性腫瘤。
后續研究逐漸發現,CNKN2A基因在多種腫瘤組織中呈現差異表達,在腫瘤患者癌組織中表達水平往往上調,并與患者的臨床病理特征和預后存在一定的相關性。如楊軍[9]等人研究發現CDKN2A在膀胱癌患者癌組織中異常表達并膀胱癌的發生發展密切相關。王勇文等人[10]研究顯示CDKN2A基因的變異及其編碼蛋白質的失活與小細胞肺癌發生、發展有關。而CDKN2A在非小細胞肺癌(NSCLC)中的研究及其功能相對報道較少,CDKN2A高低表達與NSCLC患者的預后關系也并不明確。因此。我們采用生物技術方法探討細胞周期蛋白依賴激酶抑制劑2A在NSCLC中的差異表達、可能生物學功能及與患者的預后關系,以期待為臨床治療NSCLC提供新的思路和靶向藥物研發方向。
在本研究中,我們發現CDKN2A基因在多種實體腫瘤包括乳腺癌、食管癌、腸癌等中表達水平明顯上調。CDKN2A的常高表達可能與多種人體腫瘤的發生發展有關,包括NSCLC。而CDKN2A相關的信號通路也大多集中于細胞周期分裂和細胞增殖,再次證明CDKN2A參與了細胞的周期調控,可能成為抑制腫瘤分裂癥狀的重要靶點。同時我們研究證明,CDKN2A的高表達與NSCLC患者的預后不良有關,有望成為NSCLC預后的分子標志物。但研究僅從生物信息層面進行了證實,后續仍需要相關分子生物學實驗進行驗證。

