納米金標記液相色譜-電感耦合等離子體質譜法測定人血清中轉鐵蛋白
韓亞琛 馮流星 李紅梅 熊金平

摘?要?建立了基于納米金(AuNPs)標記并結合高效液相色譜(HPLC)-電感耦合等離子質譜(ICP-MS)的聯用技術,通過測量轉鐵蛋白(Tf)上標記的AuNPs的量,實現了標準Tf及人血清中Tf的準確定量分析。在本研究中,將Tf與過量的AuNPs在磷酸鹽緩沖液(pH 6.8)中孵育, 形成AuNPs-Tf標記物,之后通過HPLC分離AuNPs-Tf,標記后Tf分子上附著的AuNPs上的Au原子可起到增強信號的作用,通過ICP-MS在線檢測AuNPs-Tf上Au的信號,實現復雜血清樣品中Tf的準確定量分析。本方法中Tf濃度與AuNPs-Tf上的Au信號強度之間線性關系良好(R2=0.9959),線性范圍寬(3個數量級),方法檢出限低至6 ng/mL。本方法經標準Tf驗證后,用于人血清標準物質(ERM-DA470/IFCC)中Tf的檢測,測量結果在標準物質不確定度范圍內,回收率在95.2%~102.6%之間。由于AuNPs的信號增強效應和ICP-MS的靈敏檢測,相比于傳統的以吸光度為檢測方式的酶聯免疫法,本方法在檢出限和靈敏度方面均有明顯提升。
關鍵詞?高效液相色譜-電感耦合等離子質譜;納米金;轉鐵蛋白
1?引 言
血清中轉鐵蛋白(Tf)是一種重要的β球蛋白,通過將鐵從血漿中結合并轉運至細胞, 調節生物體內鐵離子平衡[1],具有增強機體免疫力、促進人體對鐵及其它營養物質的吸收等作用。此外,Tf還是一種重要的急性期蛋白,在急性期反應時會逐漸減少,并且在慢性肝病和營養不良時也會下降,因此可以作為營養狀況的指標,診斷和監測許多疾病, 如貧血、炎癥和冠心病[2]等。
在臨床檢驗中,血清中Tf的常規檢測方法主要包括酶聯免疫吸附測定(ELISA)、放射免疫測定(RIA)、免疫比濁法、免疫擴散法[3,4]等,但這些方法在免疫反應中易受所用抗體的影響而導致不同的結果,且檢出限較高,通常在0.5 μg/mL以上。為了保證臨床檢驗結果的準確性和有效性,歐盟體外診斷器械指令(IVD 指令)[5]及ISO17511[6]等法規要求, 所有體外診斷產品的校準物、控制物及相關測量程序具有計量溯源性,計量學溯源性的理想終點是國際單位制系統(SI)。因此,迫切需要建立準確、可直接溯源到SI單位的更高等級的人血清中Tf測量方法,從而為Tf臨床檢測及相關校準物提供溯源基礎。
電感耦合等離子體質譜法(ICP-MS)由于其高靈敏度、高穩定性、寬響應范圍、低檢出限和可同時檢測多元素的優點,在生命科學領域得到越來越廣泛的應用[7,8]。近年來,基于ICP-MS的蛋白質分析技術已成為蛋白質組學研究中的一種強有力的工具[9]。在本技術中,所有肽或蛋白質等待測物經分離后,可以通過ICP-MS測量其中的元素,如硫、磷、硒和金屬元素(如銅、鋅和鐵)[10,11],從而實現目標蛋白的絕對定量分析。然而,通過ICP-MS檢測天然蛋白質中的元素來定量分析蛋白質的應用有限,只有當目標蛋白已被鑒定或已知其結構時,才可用于定量分析,而許多蛋白質并不含有ICP-MS可檢測的元素,且在實際的生物樣品中,目標蛋白的濃度通常較低,難以檢測。近年來,ICP-MS結合元素標簽特別是外源標簽,已廣泛應用于各種樣品中蛋白質的定量分析,如谷物、果樹、血清和細胞質等[12~16]。與傳統的蛋白質定量分析方法相比,此方法具有以下優點:(1)可通過ICP-MS直接檢測標記在蛋白質上的元素,實現絕對定量分析; (2)通常選擇樣品中濃度較低的元素作為標簽,背景干擾小; (3)ICP-MS的線性檢測范圍寬,適用于不同含量水平蛋白質的分析; (4)與放射免疫分析或化學發光相比,ICP-MS的靈敏度更高[17],且這種方法具有溯源性。許多元素標簽可適用于標記蛋白質,包括金屬納米顆粒、同位素編碼親和標簽(ICAT)和載有不同鑭系元素的金屬螯合標簽(MECT)等[18]。其中,納米金(AuNPs)由于具有良好的生物相容性,表面區域可以固定如氨基酸[19]、蛋白質、酶和DNA[20]等生物分子[21~23]而在生物學領域引起廣泛關注。Zhang等[24]通過ICP-MS對AuNPs標記的抗體進行了定量分析,與酶聯免疫吸附試驗(ELISA)的結果一致;Liu等[25]基于AuNPs標記通過毛細管電泳和ICP-MS聯用實現了人尿液中白蛋白的定量分析; Li等[26]采用基于AuNPs標記,并通過ICP-MS法對大腸桿菌O157∶H7實現定量分析。由于AuNPs在生物標記中的諸多優勢,已被廣泛應用于生物樣品檢測[27]。
本研究建立了一種基于AuNPs標記,并通過HPLC-ICP-MS聯用定量分析人血清中Tf的方法。首先優化了包括緩沖液、pH值等AuNPs和Tf的標記條件,然后將AuNPs標記不同濃度的Tf標準品形成AuNPs-Tf標記物,經HPLC分離后,通過ICP-MS檢測標記物上Au的信號強度,Au信號峰面積與Tf濃度之間線性關系良好。將本方法應用于人血清標準物質(ERM-DA470/IFCC)中Tf的定量分析,結果與標準值吻合。由于AuNPs的標記起到了增強信號的作用,并結合ICP-MS的優勢,本方法與傳統的基于免疫分析的Tf檢測方式相比,檢出限和靈敏度均有較大提升,具有實現復雜生物基體中低含量蛋白準確定量分析的潛在優勢。此外,Tf的定量分析可通過AuNPs最終溯源到SI單位,為臨床診斷中Tf的日常檢測及相關校準物提供溯源基礎,保證臨床檢驗結果的準確性和有效性。
2?實驗部分
2.1?儀器與試劑
TU-1810紫外分光光度計(北京Purkinje公司); 全自動多功能酶標儀(美國POLARstar Omega公司): 以Milli-Q水作為空白,光譜掃描區間為400~700 nm,光譜分辨率為1 nm。JEM-3010 透射電子顯微鏡(TEM,荷蘭Philips公司),電壓200 kV。
LC-30A液相色譜系統(日本Shimadzu公司)包括LC-30AD泵、SIL-20A自動進樣器和SPD-20A UV檢測器,質量范圍為10~500 kDa的SEC尺寸排阻柱TSK-gel G3000SWx1(7.8 mm×300 mm)和陰離子色譜柱Shodex QA-825(8.0 mm × 75 mm)用于蛋白質的分離。
Agilent 7700x電感耦合等離子質譜儀(美國Agilent公司),以Ar為載氣,1 ng/mL的7Li、59Co、89Y、140Ce、205Tl作為調諧溶液,測試前將儀器調試至最佳狀態。HPLC和ICP-MS的最佳測量參數見表1。
金標準溶液(100 μg/g,10% HCl)和銦標準溶液(100 μg/g,10% HCl)由中國計量科學研究院提供; 氯金酸(HAuCl4·4H2O)、甘氨酸(阿拉丁公司); 甲酸銨、Tris(北京化工廠); 磷酸鹽緩沖液由色譜純的NaH2PO4和Na2HPO4配制而成; 標準Tf、IgG、IgA(Sigma公司); 人血標準物質(ERM-DA470/IFCC,歐洲標準物質和測量研究所)。實驗用水為超純水(Milli-Q純凈水系統,美國Millipore公司)。
2.2?納米金的制備與表征
取50 mL 0.01% (m/V) HAuCl4于三口燒瓶中,回流加熱至沸騰,將1.75 mL 1% (m/V)檸檬酸鈉快速加入燒瓶中,加熱攪拌30 min,溶液由淺黃色過渡到紫色最終變為鮮紅色。反應結束后,繼續攪拌20 min,冷卻至室溫,經0.45 μm濾膜過濾后,于4℃避光保存[28]。通過TEM觀察AUNPS粒徑大小。AuNPs的濃度由ICP-MS測定,Au單元素系列標準溶液由以1% HNO3配制,標準溶液和樣品中加入1 ng/mL In作為內標。
2.3?納米金與轉鐵蛋白的標記
在3種緩沖溶液中進行Tf與AuNPs的標記:10 mmol/L Tris-HCl緩沖溶液(pH 6.8和7.8); 50 mmol/L硼酸鹽緩沖溶液(pH 6.8和7.8); 10 mmol/L磷酸鹽緩沖溶液(Na2HPO4-NaH2PO4,pH 5.8、6.8和7.8)。
取1 mL AuNP, s在9000 r/min下離心20 min,棄去上清液,沉淀重懸于1 mL以上緩沖溶液中,加入96孔板中,200 μL/孔[29],分別加入0.1 mg/mL Tf標準品1、2、4、6和8 μL。 于室溫下輕微搖動30 min。 之后向每孔中加入10 μL 12% NaCl溶液,通過多孔板中溶液顏色的變化及吸收峰值大小,考察AuNPs在不同緩沖液中的穩定性及穩定AuNPs所需的最小Tf濃度。
2.4?樣品前處理及HPLC-ICP-MS測量
分別取濃度為1、10、25、50、100和200 μg/mL的Tf標準品5 μL, 與200 μL重懸在標記緩沖液的AuNPs混合,37℃避光搖振孵育2 h,以確保反應完全。
對于人血清標準物質ERM-DA470/IFCC樣品,根據產品說明提供的方法對樣品進行復溶,復溶后的血清樣品中Tf濃度為(2.45±0.08) mg/mL,4℃儲存,備用。與AuNPs的標記過程同上。
通過雙向閥將HPLC的出液管和ICP-MS的進樣管相接, 實現HPLC-ICP-MS的聯用。樣品在進樣之前經0.45 μm濾膜過濾,在測量之前對ICP-MS各參數均進行調諧,使儀器靈敏度等參數達到最佳狀態,主要干擾(如氧化物)干擾降至1.5%以下,雙電荷干擾在3%以下。樣品經過HPLC分離后,以最大0.8 mL/min的速度通過進樣管進入ICP-MS的霧化器,選擇采樣速度在1.0 mL/min的霧化器以保證樣品進入ICP-MS不會出現積液現象。選擇197Au為ICP-MS待檢測同位素,匹配與HPLC相同的測試時間, 以實時持續捕捉Au信號,得到整個液相色譜分析過程中的Au信號譜圖,信號峰面積通過Origin 8.0積分得到。每個樣品重復測試3次。
分別采用尺寸排阻色譜柱(SEC)和陰離子色譜柱(IEC)對血清中的AuNPs-Tf進行分離,并采用ICP-MS在線測量Au的信號。采用SEC-ICP-MS方法時,首先采用ProteoExtractTM白蛋白去除試劑盒去除等電點和Tf相近的高豐度白蛋白Alb(pI= 4.7),然后進行AuNPs標記。
3?結果與討論
3.1?納米金與轉鐵蛋白的標記條件優化
AuNPs與蛋白質的標記效率主要取決于標記緩沖液的種類和pH值,由于蛋白質是兩性電解質,每種蛋白質都具有特定的等電點,當標記環境的pH值略高于Tf的等電點5.3時,Tf與AuNPs顆粒間的靜電作用較小,表面張力最大,Tf處于微弱的水化狀態,而且保留著親水作用,從而促使Tf和AuNPs結合[30]。
AuNPs溶液中納米金顆粒間由于存在靜電斥力而保持穩定狀態,當向其中加入NaCl溶液后,其作為電解質溶液能屏蔽AuNPs顆粒間的靜電斥力,導致AuNPs聚集,溶液顏色變藍,因此對AuNPs的穩定性具有破壞作用。Tf可以吸附在AuNPs表面作為保護層,但吸附的Tf分子數不足時, AuNPs的穩定性仍會被NaCl破壞,因此在AuNPs穩定的前提下所需Tf越少,表明AuNPs所處緩沖液越適合標記。
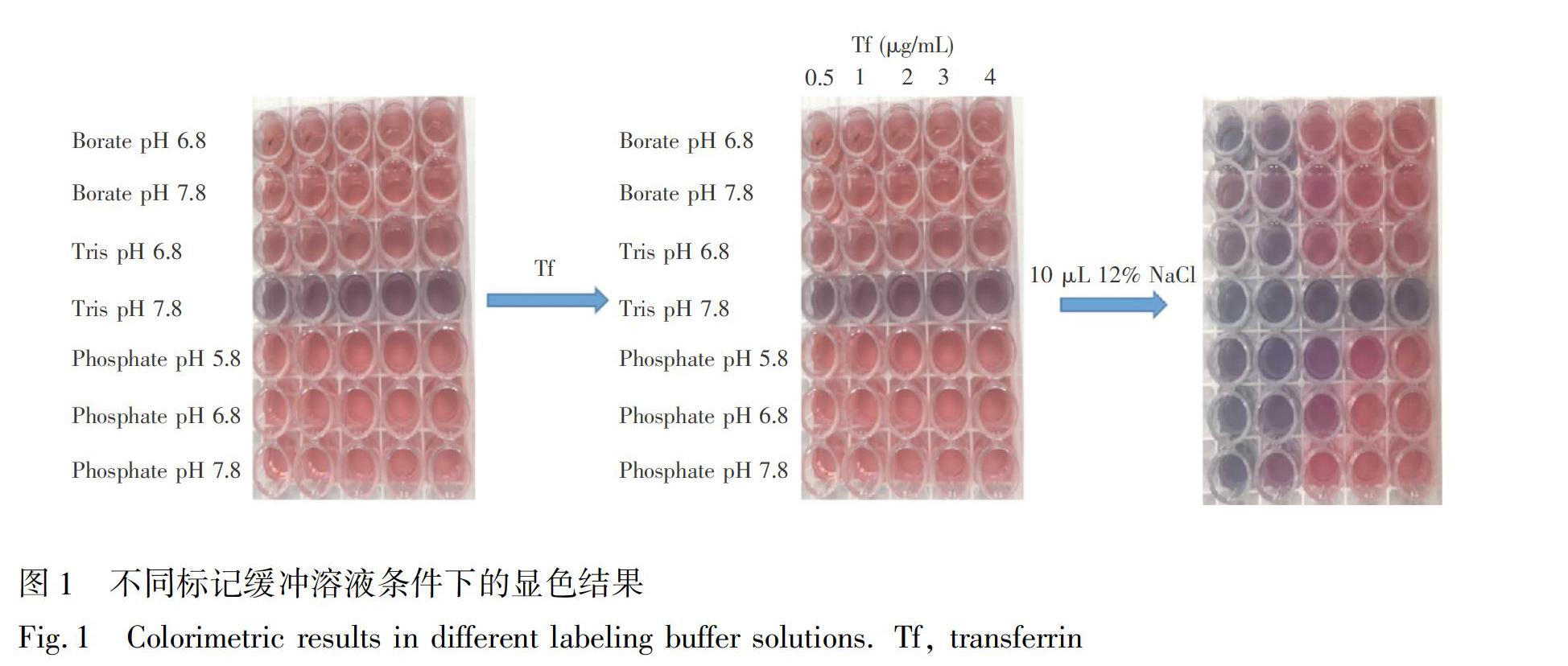
不同緩沖溶液中AuNPs與Tf的標記顯色如圖1所示。在Tris-HCl緩沖溶液中,NaCl加入之前AuNPs就已開始聚集顯藍色,因此不適合。向多孔板中加入不同濃度的Tf,30 min后再加入10 μL 12% NaCl溶液,此時硼酸和磷酸鹽緩沖液中均不同程度變藍,采用酶標儀在400~700 nm波長范圍對各孔進行掃描,由于分散態和聚集態AuNPs顆粒的光吸收不同,因此可通過吸收峰值大小來選擇最佳標記緩沖溶液條件。
AuNPs溶液中Tf濃度對溶液吸收峰的影響見圖2,橫坐標為各孔中Tf的濃度,縱坐標為測得的各孔吸收值(400~700 nm),分散態和聚集態納米顆粒的光吸收不同,吸收值越小,表示AuNPs越穩定。圖2表明,同一緩沖液中Tf濃度越大,溶液的吸收峰值越小,即AuNPs-Tf粒徑越小,
AuNPs與Tf結合的更緊密,溶液的吸收峰達到最小值表示AuNPs和Tf結合穩定,粒徑不再發生變化,此時Tf濃度即為穩定AuNPs所需的最小濃度。在本研究中, pH 6.8的磷酸緩沖液中AuNPs的吸收峰與其它標記緩沖相比,在不同Tf濃度下均最小,因此選擇此溶液為標記緩沖液,且穩定AuNPs所需的最小Tf濃度為3 μg/mL。
3.2?納米金及其標記物(AuNPs-Tf)的表征
所制備的用于標記Tf的AuNPs,其粒徑大小及均勻性對標記效果有重要影響。粒徑小的AuNPs不易聚集,穩定性通常更好,粒徑均勻則可降低Tf在AuNPs上結合數量的差異。采用高分辨率透射電子顯微鏡(TEM)對制備的AuNPs顆粒及AuNPs-Tf進行表征。
如圖3A所示,制備的AuNPs呈較為規則的球形,分散均勻。隨機選擇至少200個AuNPs顆粒觀察其粒徑大小及分布,由圖3B可知,AuNPs平均粒徑為15 nm,且粒徑分布均應。由于AuNPs具有面心立方結構,可以通過公式(1)計算每個AuNPs平均所含的金原子數目[31]:
NAu=NAπρD3/(6M)(1)
其中, NAu為每個AuNPs顆粒的平均金原子數,Na為阿伏加德羅常數, ρ為AuNPs的密度(1.93×1020 g/nm3), M為金元素原子質量, D為AuNPs的直徑(15 nm)。
經計算,每個AuNPs顆粒含有1.04×105個金原子,單個AuNPs顆粒的重量MAuNPs=NAuM/NA=1.04×105×197/(6.02×1023)=3.41×1017 g。圖3C為標記后AuNPs-Tf的TEM圖,與圖3A相比,AuNPs周邊出現了一層由于Tf吸附而形成的光暈,與標記前的AuNPs顆粒有明顯區別,證明Tf分子標記在AuNPs顆粒表面。
由于AuNPs顆粒表面具有等離子體共振特性,可在460~560 nm之間觀察到強吸收峰,峰值大小取決于AuNPs的大小。圖4為AuNPs及其與Tf標記后的400~700 nm的吸收譜圖,AuNPs吸收峰位于519 nm,標記后AuNPs-Tf的吸收峰紅移5 nm,這是由于AuNPs被Tf吸附而導致吸收峰紅移,并且吸收強度比標記前高,證明Tf已標記在AuNPs顆粒上。
本研究制備的AuNPs顆粒中,由ICP-MS測得Au濃度為31.54 μg/mL。結合單個AuNPs的質量(3.41×1017g), 得到每毫升AuNPs溶液中AuNPs個數為9.25×1011個。
3.3?納米金與轉鐵蛋白標記物的HPLC-ICP-MS分析
圖5A為不同濃度Tf標準品(1、10、25、50、100和200 μg/mL)的液相色譜圖,Tf的保留時間為16 min。 Tf經AuNPs標記后的液相色譜圖如圖5B所示,在11 min出現了新的AuNPs-Tf吸收峰,這是由于Tf與AuNPs結合后,分子量增大,保留時間減小。當溶液中Tf濃度在25~2500 ng/mL范圍內時,由于AuNPs過量,隨著Tf濃度增加,AuNPs-Tf不斷增多,但當Tf濃度達到5 μg/mL時,AuNPs-Tf不再增多,且16 min處出現未標記的Tf,此時未與AuNPs結合的過量Tf被洗脫出來,圖5B右側的峰是Tf相對于AuNPs, 過量Tf產生的。
在圖5C的HPLC-MS圖中,在11 min的AuNPs-Tf保留時間處檢測到了Au信號,且信號峰面積隨著Tf濃度的增加而增大,二者之間存在線性關系,可通過HPLC-ICP-?MS測定樣品中的Au實現Tf的定量分析。圖5D顯示了Tf濃度與AuNPs-Tf中Au信號峰面積之間的關系,AuNPs濃度一定時,當Tf濃度增加到3 μg/mL時,Au信號峰面積最大,AuNPs標記Tf達到飽和。因此,可以在達到飽和以前,建立Tf濃度和AuNPs-Tf上Au信號峰面積的標準曲線。
每個AuNPs上結合的Tf 分子數可由公式(2)計算[18]:
n=NTf SfAuNPs/(NAuNPsSbAuNPs)(2)
其中, NAuNPs為溶液中AuNPs顆粒個數,NTf 為溶液中Tf的分子數,SfAuNPs為AuNPs完全標記時的Au信號峰面積,SbAuNPs 為AuNPs-Tf的Au信號峰面積,結合Tf的摩爾質量(75.2 kDa), 可計算得到每個AuNPs顆粒上標記了26個Tf分子。
在20~2500 ng/mL濃度范圍內,Tf濃度與Au信號呈良好的線性關系(y=0.019969x),線性相關系數R2=0.9959。以純水為空白,計算標準偏差SD,1 μg/mL Tf標準品標記后單獨進樣作為標準溶液計算靈敏度S,以3倍的SD計算得方法的檢出限為6 ng/mL,7次重復進樣的相對標準偏差為4.8%。
3.4?HPLC-ICP-MS定量分析人血清中的轉鐵蛋白
為了驗證本方法對復雜生物基體樣品中Tf定量分析的適用性,采用人血清標準物質(ERM-DA470/IFCC)對方法進行驗證。將血清樣品進行AuNPs標記后,分別采用尺寸排阻色譜柱(SEC)和陰離子色譜柱(IEC)對血清中Tf進行分離,并采用ICP-MS在線測量Au的信號,從而實現對Tf的定量分析。
3.4.1?SEC-ICP-MS測量人血清中的轉鐵蛋白?血清中有很多種蛋白, 在采用AuNPs標記時,如有其它蛋白也與AuNPs結合,將會對目標蛋白的測量結果產生影響。為避免這一點,首先通過ProteoExtractTM白蛋白去除試劑盒去除血清中等電點與Tf相近的白蛋白(Alb)。圖6A為血清樣品的液相色譜圖,Alb和Tf由于分子量接近而重疊,圖6B為去除Alb后的液相色譜圖。進一步考察了AuNPs標記Tf的特異性,選擇了人血清中含量較高的IgG、IgA、α-1-抗胰蛋白和甘氨酸作為干擾物,經過相同的標記處理后進行分析,這些干擾物與AuNPs孵育后,在液相色譜圖上并未產生新峰(圖7A),各干擾物的峰形和峰高在標記前后未發生明顯變化,在相應的質譜圖上也未出現Au的信號峰(圖7B)。因此,在本條件(10 mmol/L磷酸鹽緩沖溶液,pH 6.8)下,AuNPs標記Tf未受到血清中其它蛋白的影響。
正常人血清中Tf的濃度約為2.2~4.0 mg/mL,為了保證血清樣品中Tf的濃度水平在建立的標準曲線范圍之內,將去除白蛋白后的血清標準物質分別稀釋30、50和100倍,標記之后經SEC-ICP-MS進行測量。另取樣品,加入與樣品中濃度大致相同的Tf標準品,測定回收率,結果如表2所示。不同稀釋倍數的樣品的測定值分別為2.53、2.58和2.64 mg/mL,回收率在95.2%~102.6%之間,測量結果在標準值不確定度范圍之內。
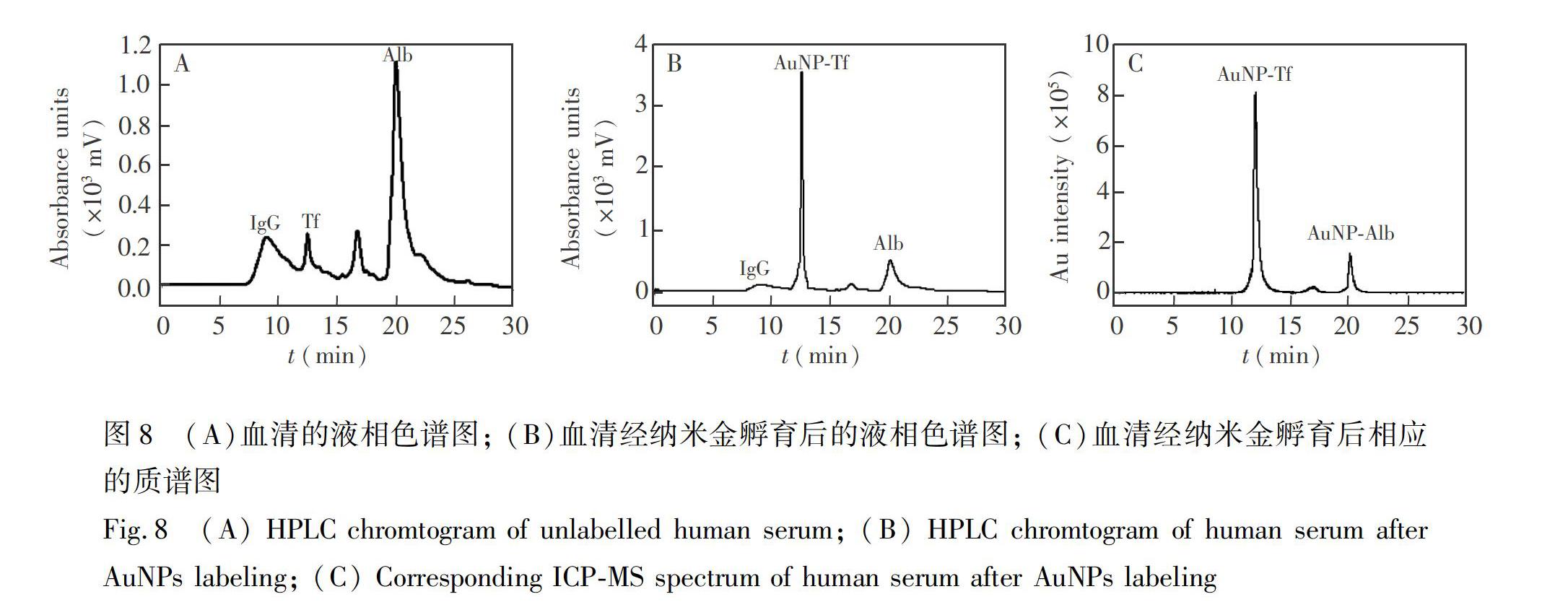
3.4.2?IEC-ICP-MS測量人血清中的轉鐵蛋白?采用另外一種方式考察血清中其它蛋白對Tf測量結果的影響。血清經AuNPs標記后,采用Shodex QA-825陰離子色譜柱分離出血清中AuNPs-Tf的色譜峰,如圖8B所示,與未標記血清樣品中的Tf保留時間一致(圖8A),即在Tf保留時間處出現AuNPs-Tf特征峰,而白蛋白和IgG峰形未受AuNPs標記的影響。在相應的質譜圖(圖8C)中,在AuNPs-Tf保留時間處檢測到了Au信號,IgG處并未檢測到Au的信號,而在Alb處有較小的Au信號峰,表明AuNPs也會與Alb有少量標記。此外,質譜圖上仍檢測到了其它微量Au信號峰,可能是AuNPs和其它未知蛋白標記的結果,但由于Tf已從血清中分離出來,其它蛋白與AuNPs標記后產生的Au信號峰未對AuNPs-Tf上Au信號峰的測定造成干擾。
測量結果如表2所示,不同稀釋倍數樣品的測定值分別為2.39、2.48和2.52 mg/mL,在標準物質標準值的不確定度范圍之內,回收率在94.3%~98.7%之間。
在SEC-ICP-MS方法中,首先需要對血清進行去除白蛋白處理,然后再進行標記定量分析。而IEC-ICP-MS方法可分離出血清中AuNPs-Tf的色譜峰,避免了白蛋白對測定造成的干擾,省去了去除白蛋白處理過程,定量分析結果也更加準確,這兩種方法的主要優勢體現在檢出限、靈敏度和溯源性方面。本方法雖操作較復雜,但其準確性和溯源性更好,可作為溯源鏈頂端的參考方法,為臨床診斷中Tf的日常檢測方法及相關校準物提供溯源基礎。此外,本方法具有優良的靈敏度和檢出限,可用于復雜基體樣品中低含量蛋白的檢測。
4?結 論
建立了基于AuNPs標記,HPLC-ICP-MS定量分析人血清中的Tf的方法。制備了具有良好分散性和穩定性的粒徑為15 nm的AuNPs,優化了AuNPs與Tf的最佳標記條件,建立的方法的檢測范圍寬(3個數量級),方法檢出限顯著降低。將本方法應用到復雜人血清樣品(ERM-DA470/IFCC)中Tf的定量分析,測定結果與標準值等效一致,證明了本方法對實際樣品檢測的適用性。本方法在檢出限、靈敏度上均有提升,且可通過AuNPs最終溯源到SI單位,為臨床診斷中Tf的日常檢測及相關校準物提供溯源基礎,同時為定量分析復雜樣品中低含量蛋白提供了新的方法。
References
1?Ogawa C, Tsuchiya K, Tomosugi N, Kanda F, Maeda K. Maeda T. Plos One, 2017, 12(6): 1-14
2?Zhang R, Shp S, Feng G, Zhang C J, Tang B Z, Liu B. Anal. Chem.,2017,90(2): 1154-1160
3?JIN Li-Chun, ZHANG Hao-Yi, CAO Wei-Li. Journal of Radioimmanology,2002,15(2): 75-77
金禮春, 張豪一, 曹偉麗. 放射免疫學, 2002,15(2): 75-77
4?LIU Cheng-Xia, CAO Xuan, LEI Cun-Xi, SHEN Guo-Li. Chinese J. Anal. Chem.,2004,32(9): 1135-1138
劉成霞, 曹 軒, 雷存喜, 沈國勵.分析化學,2004,32(9): 1135-1138
5?Directive 98/79/EC of the European Parliament and of the Council of 27 October 1998 on in Vitro Diagnostic Medical Devices. Off J Eur Communities. L331: 1-37
6?International Organization for Standardization. ISO 17511: In Vitro Diagnostic Medical Devices-Measurement of Quantities in Biological Samples-Metrological Traceability of Values Assigned to Calibrators and Control Materials, Geneva: International Organization for Standardization,2003
7?Calderón C F, Encinar J R, Sanz M A. Mass Spectrom. Rev.,2017,37(6): 715-737
8?Feng L X, Zhang D, Wang J, Shen D R, Li H M. Anal. Chim Acta,2015,884: 19-25
9?Feng L X, Zhang D, Wang J, Li H M. Anal. Methods,2014,6: 7655-7662
10?Patil U S, Adireddy S, Jaiswal A, Mandava S, Lee B R. Int. J. Mol. Sci.,2015,16(10): 24417-24450
11?HUO Zhong-Zhong, FENG Liu-Xing, LI Hong-Mei, Xiong Jin-Ping. Chinese J. Anal. Chem., 2019, 47(12): 1931-1937
霍中中, 馮流星, 李紅梅, 熊金平. 分析化學, 2019, 47(12): 1931-1937
12?Shiang Y C, Huang C C, Chen W Y, Chen P C, Chang H T. J. Mater. Chem.,2012,22(26): 12972-12982
13?Careri M, ElviriL, Maffifini M, Mangia A, Mucchino C, Terenghi M. Rapid Commun. Mass Spectrom.,2008,22: 807-811
14?Crotti S, Granzotto C, Cairns W R L, Cescon P. Barbante C. J. Mass Spectrom.,2011,46: 1297-1303
15?Liu R, Liu X, Tang Y R, Wu L, Hou X D, Lv Y. Anal. Chem.,2011,83: 2330-2336
16?Liang Y, Jiang X, Tang N, Yang L, Chen H, Wang Q. Anal. Bioanal. Chem.,2015,407: 2373-2381
17?Markiewicz B, Komorowicz I, Sajnóg A, Belter M, Barakiewicz D. Talanta,2015,132(15): 814-828
18?Sanzmedel A. Anal. Bioanal. Chem.,2016,408(20): 1-3
19?Song G, Zhou F, Xu C, Li B. Analyst,2016,141(4): 1257-1265
20?Keighron J D, Keating C D. Nano Biotechnol. Protoc.,2013,1026: 163-174
21?Fojnica A, Osmanovic' A, Tarakcˇija D, Demirovi' S. CMBEBIH,2017,62: 142-146
22?Bell N C, Minelli C, Shard A G. Anal. Methods,2013,5(18): 4591-4601
23?António M, Nogueira J, Rui V. Nanomaterials,2018,8(4): 200
24?Zhang C, Zhang Z, Yu B, Shi J, Zhang X. Anal. Chem.,2002,74(1): 96-99
25?Liu J M, Li Y, Jiang Y, Yan X P. J. Proteome Res.,2010,9: 3545-3550
26?Li F, Zhao Q, Wang C, Lu X, Li X F, Le X C. Anal. Chem.,2010,82(8): 3399-3403
27?Timoszyk A A. Bull. Mater. Sci.,2018,41(6): 154
28?Frens G. Nat. Phys. Sci.,1973,241: 20-22
29?Balasubramanian S K, Yang L, Yung L Y L, Ong C N, Ong W Y, Yu L E. Biomaterials,2010,31(34): 9023-9030
30?WANG Wen-Xing, CHEN Qi-Fan, ZHANG Li, XU Shu-Kun. Journal of Northeastern University,2007,28(2): 301-304
王文星, 陳啟凡, 張 麗, 徐淑坤. 東北大學學報,2007,28(2): 301-304
31?Allabashi R, Stach W. J. Nanoparticle Res.,2008,11(8): 2003-2011
Quantification of Human Serum Transferrin Based on High Performance
Liquid Chromatography-Inductively Coupled Plasma-Mass
Spectrometry with Gold Nanoparticles Labeling
HAN Ya-Chen1,2, FENG Liu-Xing*2, LI Hong-Mei2, XIONG Jin-Ping1
1(College of Material Science and Technology,Beijing University of Chemical Technology, Beijing 100029, China)
2(National Institute of Metrology, Beijing 100029, China)
Abstract?A simple and sensitive method for quantification of transferrin (Tf) in human serum by high performance liquid chromatography (HPLC) coupled with inductively coupled plasma mass spectrometer (ICP-MS) with gold nanoparticles (AuNPs) labeling was established. Accurate quantification of standard Tf and Tf in human serum were achieved by measuring the concentration of AuNPs labeled on Tf. Tf could be incubated with most amount of AuNPs to form AuNPs-Tf in phosphate buffer (pH 6.8). Since gold atoms labeled to the Tf molecule could enhance the signals, accurate quantification of Tf in human serum could be achieved by gold signal measurement with ICP-MS after AuNPs-Tf was separated by HPLC. Good linear correlation coefficient (R2=0.9959) was obtained between Au peak area on AuNPs-Tf and concentration of Tf with a wide linear response over 3 orders of magnitude, and the limit of detection was 6 ng/mL. The developed method was successfully applied for detection of Tf in human serum certified reference material (ERM-DA470/IFCC) after being verified by standard Tf. Good agreement was achieved and the quantitative recovery was in the range of 95.2%-102.6%. Due to signal amplification of AuNPs and ultra-sensitive detection of ICP-MS, the sensitivity and accuracy were improved significantly compared to traditional enzyme-linked immunosorbent assay. Moreover, the measurement results could be directly traced to SI unit.
Keywords?High performance liquid chromatography-inductively coupled plasma-mass spectrometry;Gold nanoparticles;Transferrin
(Received 8 July 2019;accepted 24 October 2019)
This work was supported by the National Key Research and Development Program (No. 2017YFF0205402) and the National Natural Science Foundation of China (No.11475163).

