γ-分泌酶抑制劑阻斷LPA誘導的胃癌細胞SGC-7901侵襲遷移
任志恒,張晨麗,張 曉,史淑霞,徐金宇,張 煦,胡 燕,王斌生
胃癌是消化道常見的惡性腫瘤[1-2],治療以手術和放、化療為主,但對已發生遠處轉移的胃癌患者療效不佳[3]。因此,尋找新的胃癌靶向藥物成為亟待解決的問題。溶血磷脂酸(lysophosphatidic acid, LPA)屬于小分子甘油磷脂,可調控肝細胞癌、卵巢癌等多種惡性腫瘤的侵襲遷移[4-5]。LPA受體分為6個亞型:LPA1~6[6],其中LPA2研究較為廣泛,與多種惡性腫瘤的病理學分期、分級及患者的不良預后相關[7-9]。Notch信號通路在多種腫瘤的發生、發展中起重要作用,該通路由Nocth1~4受體組成,與其配體結合后經γ-分泌酶酶切,釋放其胞外域及胞內域ICN,并與CSL蛋白結合使之活化,進一步激活下游靶基因(如Hes-1)的轉錄[10]。γ-分泌酶抑制劑可阻斷Notch通路的活化,文獻報道[11-12]γ-分泌酶抑制劑聯合其他天然化合物,對治療HER-2陽性乳腺癌患者具有良好的前景。本文著重探討γ-分泌酶抑制劑是否能阻斷LPA誘導的胃癌細胞SGC-7901侵襲遷移,為胃癌臨床治療提供新的理論依據。
1 材料與方法
1.1 細胞培養人胃癌細胞株SGC-7901由本實驗室長期保存。細胞培養于含1%的青霉素/鏈霉素混合液(Sigma)和10%的胎牛血清(BI)的RPMI 1640培養基(Hyclon)中,置于37 ℃、5% CO2的培養箱中培養。每2~3天使用胰蛋白酶-EDTA(0.25%)(Hyclon)消化并傳代。
1.2 主要試劑及材料MTS試劑盒(Promega),Transwell小室(Corning),Matrigel膠(BD),一抗稀釋液、DAPI、FITC標記的鬼筆環肽(Solarbio),人源LPA2(EDG4)抗體(Abcam),Notch1、Hes-1、E-cadherin、vimentin抗體(CST),β-actin抗體(Thermo),二抗(Santa Cruz),LPA(Sigma),MK-0752(Selleck)。
1.3 Western blot 檢測取對數生長期的SGC-7901細胞,接種于6孔板中,待細胞生長至70%~80%融合度時,實驗組細胞使用5 μmol/L MK-0752預處理24 h,然后在刺激組細胞中加入15 μmol/L LPA刺激細胞24 h,處理樣品,加入1×SDS蛋白上樣緩沖液進行SDS-PAGE,并轉移至NC膜,用5%脫脂奶粉封閉2 h,以LPA2(1 ∶1 000)、Notch1(1 ∶1 000)、Hes-1(1 ∶1 000)、E-cadherin(1 ∶1 000)、vimentin(1 ∶1 000)、F-actin(1 ∶1 000)和β-actin(1 ∶5 000)一抗4 ℃孵育過夜,二抗(1 ∶5 000)孵育2 h,最后用ECL化學發光工作液曝光、拍照。
1.4 Transwell侵襲遷移實驗
1.4.1Transwell遷移實驗 實驗組細胞使用MK-0752預處理24 h后,將孔徑為0.8 μm的Transwell小室置入24孔板中,收集各組細胞,用PBS洗滌并用無血清培養基重懸細胞,將細胞濃度調整每孔為2×105個細胞,然后在小室上腔加入200 μL的細胞懸液,小室下腔加入700 μL的含15 μmol/L LPA或完全培養基,培養箱培養24 h后取出小室,經4%多聚甲醛固定,0.1%結晶紫染色,在顯微鏡下計數細胞。
1.4.2Transwell侵襲實驗 實驗組細胞使用MK-0752預處理24 h后,稀釋Matrigel基質膠(Matrigel基質膠 ∶預冷的無血清培養基=1 ∶8),并充分混勻。在Transwell小室上腔中加入100 μL以覆蓋整個碳酸酯膜。后續操作同遷移實驗。
1.5 細胞活力檢測使用MTS測定5 μmol/L MK-0752、15 μmol/L LPA是否對細胞活力造成影響。實驗前將MTS Cell Titer96 AQueous One Solution Reagent 37 ℃水浴10 min,直接加入96孔板,37 ℃、5% CO2環境中孵育2.5 h,然后酶標儀讀取490 nm處的吸光度值(OD值),記錄結果,用以下公式計算細胞活力:細胞活力(%)=(A實驗-A空白)/(A對照-A空白)×100%。
1.6 間接免疫熒光共聚焦檢測實驗組細胞預先用5 μmol/L MK-0752預處理,待其生長至70%~80%融合度后,以每孔2×104個細胞接種于Nunc玻璃小皿中,加入15 μmol/L LPA或完全培養基,24 h后收樣,PBS洗滌細胞,經4%多聚甲醛固定,使用FITC標記的鬼筆環肽染細胞骨架,4 ℃避光過夜;使用DAPI染細胞核,最后使用激光共聚焦顯微鏡觀察,并拍照保存圖片。
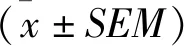
2 結果
2.1 MK-0752對LPA誘導LPA2、Notch1、Hes-1表達的影響實驗組細胞預先使用5 μmol/L MK-0752處理24 h;在刺激組中加入15 μmol/L LPA培養 24 h,Western blot結果顯示:在使用MK-0752預處理的細胞中,LPA2、Notch1、Hes-1的表達比空白對照組低,且預處理組在使用LPA刺激后目的分子表達比空白刺激組低。MTS實驗檢測在5 μmol/L MK-0752和15 μmol/L LPA作用下的細胞活力,結果表明:所用藥物濃度并未對細胞活力造成影響,因此選擇該濃度為后續實驗中的藥物濃度(圖1)。
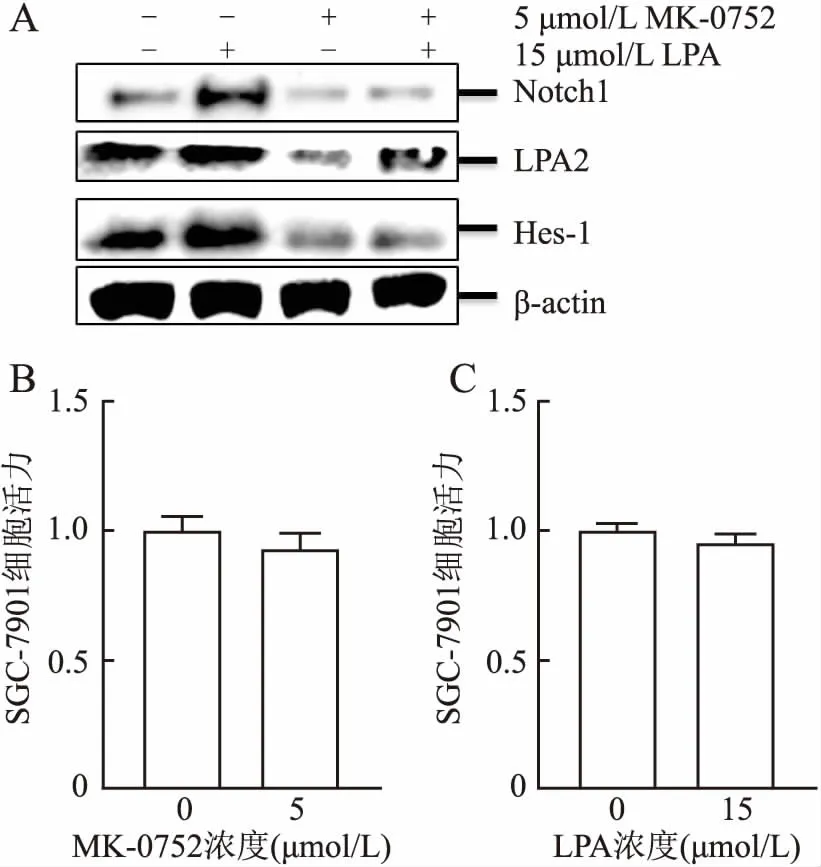
圖1 A.Western blot檢測四組細胞中LPA2、Notch1、Hes-1的表達;B.MTS檢測MK-0752濃度對細胞活力的影響;C.MTS檢測LPA濃度對細胞活力的影響
2.2 MK-0752對LPA誘導SGC-7901細胞侵襲遷移的影響Transwell侵襲遷移實驗表明:使用MK-0752預處理的SGC-7901細胞中穿膜細胞數比空白對照組低(P<0.01);在下室加入15 μmol/L的LPA后,空白刺激組的穿膜細胞數比實驗組增多(P<0.01)。實驗結果顯示:MK-0752可抑制由LPA誘導的胃癌細胞SGC-7901侵襲遷移(圖2)。

圖2 A.Transwell遷移實驗檢測四組細胞的遷移能力;B.Transwell侵襲實驗檢測四組細胞的侵襲能力;P均<0.01,LPA(-):空白對照組;LPA(+):空白刺激組;MK-0752(-):實驗組;MK-0752(+):實驗刺激組
2.3 MK-0752對LPA誘導SGC-7901細胞EMT的影響采用Western blot檢測MK-0752預處理細胞后,使用LPA刺激細胞中E-cadherin、vimentin的表達。實驗組細胞中E-cadherin表達比處理后刺激組明顯增多;vimentin的表達趨勢則與之相反。以上結果提示:MK-0752是通過抑制由LPA誘導的SGC-7901細胞發生EMT過程,進而抑制細胞發生侵襲遷移(圖3)。

圖3 Western blot檢測四組細胞中E-cadherin、vimentin的表達
2.4 MK-0752對LPA誘導SGC-7901細胞形態學的影響采用間接免疫熒光共聚焦觀察四組細胞的細胞骨架:空白刺激組的細胞細胞形態由橢圓形變為不規則形,細胞表面絲狀物增多(細胞骨架蛋白增多),細胞周圍凸起增多(偽足形成);實驗組細胞中加入LPA后,細胞形態未見明顯改變。結果顯示:MK-0752可抑制由LPA引起的SGC-7901細胞形態學改變,阻止細胞形成偽足,進而抑制細胞運動(圖4)。
3 討論
胃癌是常見的消化道腫瘤,因缺乏早期診斷及侵襲遷移能力較強,其預后較差[13]。因此,尋求胃癌治療的新思路一直備受專家、學者們的關注。
LPA和LPA2結合后可在人體的正常生理及病理中發揮不同作用,正常時兩者結合后,通過G蛋白偶聯信號通路可促進細胞有絲分裂、加速傷口愈合[14];異常時兩者結合可加速乳腺癌、肝癌、卵巢癌細胞侵襲遷移,且在卵巢惡性上皮性腫瘤中,LPA2的高表達與患者組織學分級、臨床分期、淋巴結轉移及腹水形成量呈正相關;LPA可刺激胃癌細胞增殖并使其惡性程度增高。我們前期研究發現LPA2可促進胃腺癌細胞SGC-7901的抗凋亡、促侵襲和遷移能力[15],且在SGC-7901細胞中有兩種跨膜蛋白LPA2和Notch1的協同作用,在LPA的刺激下該作用被放大,以增強胃癌細胞惡性程度[16]。

圖4A.間接免疫熒光共聚焦觀察空白組、實驗組細胞的形態學變化;B.間接免疫熒光共聚焦觀察空白刺激組、實驗刺激組細胞的形態學變化
Notch1作為Notch通路中的關鍵分子,與非小細胞肺癌、直腸癌患者的病理學分期及預后密切相關[17-18]。Notch1高表達可增強腎透明細胞癌、結腸細胞的侵襲遷移能力[19-20]。本實驗使用Notch通路阻斷劑—— γ-分泌酶抑制劑,首次發現MK-0752可抑制由LPA誘導的胃癌細胞SGC-7901中LPA2和Notch信號通路相關分子的表達。
腫瘤從原位癌發展呈浸潤癌需要EMT過程,這是惡性腫瘤細胞發生侵襲遷移的前提。在此過程中,癌細胞失去上皮標志物E-cadherin的表達,使細胞連接松散易于運動,而間葉標志物vimentin表達增加,有利于細胞維持形態及運動[21]。本實驗結果表明:在LPA刺激下胃癌細胞SGC-7901中E-cadherin表達降低,vimentin表達增加;該作用可在使用MK-0752處理的細胞中逆轉,提示γ-分泌酶抑制劑可阻斷由LPA誘導的SGC-7901細胞EMT過程。
EMT過程中伴細胞形態學改變,細胞由原來的規則形態變為利于其運動遷移的不規則形態,在此過程中細胞骨架蛋白發生重構,細胞偽足形成[22-23]。本組發現,在LPA刺激下SGC-7901細胞形態明顯發生改變,但在MK-0752處理的細胞中未見明顯改變;提示γ-分泌酶抑制劑可以抑制由LPA誘導的SGC-7901細胞形態學改變。
近年γ-分泌酶抑制劑在惡性腫瘤治療的研究中較為廣泛,可通過阻斷Notch通路抑制人卵巢癌細胞SKOV3增殖并促進其凋亡;盧余莉等[24-25]研究發現,在腫瘤的藥物治療中γ-分泌酶抑制劑與其他傳統化療藥物有明顯不同。本組結果提示γ-分泌酶抑制可抑制由致瘤因子LPA引起的胃癌細胞惡性生物學行為,將Notch信號通路與LPA、LPA2軸聯系在一起。
綜上所述,本實驗僅從體外細胞學實驗中初步探討γ-分泌酶抑制劑對胃癌細胞的抑制作用,可作為分析胃癌新治療方法的實驗與理論提供基礎;其具體作用機制還需進行動物學實驗及相關分子生物學實驗分析,以期為胃癌耐藥患者提供更好的藥物治療方案。

