ω-3不飽和脂肪酸DHA改善β淀粉樣蛋白沉積致AD的小鼠模型記憶功能的機制研究
陸 冰,劉 洲,鄭錫峰,劉廣雁,林智君,陳秋萍
阿爾茨海默病(Alzheimer diseasa,AD)即老年性癡呆,是一種最為常見的神經系統退行性疾病,臨床主要特征表現為失認、失語、記憶障礙、執行功能障礙、視空間技能損害和行為改變等。目前,β-淀粉樣蛋白(amyloid-β,Aβ)假說是廣泛認可的AD發病機制[1],Aβ1-42是一種常用的Aβ亞型,具有毒性強、易聚集等特點,可使Aβ斑塊沉積引起神經毒性,造成突觸損傷和神經元死亡,進而引發AD,多用于AD小鼠模型的建立。目前,臨床上仍無治療AD的特效藥物。隨著我國老齡化的加劇,AD越來越受到科學研究領域的關注和重視,尋找和研發改善AD患者認知功能、延緩疾病進展的新藥物對AD患者的治療具有重要意義。
二十二碳六烯酸(Docosahexaenoic acid,DHA)是深海魚油和微藻油的主要成分,隸屬ω-3不飽和脂肪酸(ω-3 polyunsaturated fatty acid,ω-3PUFA)。DHA作為一種天然的長鏈多不飽和脂肪酸,具有保護視網膜、促進生長發育、防治心血管疾病、抗癌、抗炎、延緩衰老、預防老年癡呆等重要作用[2],在機體代謝合成和生理病理過程中發揮著重要作用[3]。有研究指出,在老年人群腦內ω-3多不飽和脂肪酸丟失嚴重,攝入DHA有降低AD風險和改善大腦記憶障礙的作用[4~7]。然而,目前DHA改善AD記憶功能的機制并不明確,研究DHA改善AD記憶功能的作用機制對DHA延緩和治療AD的臨床應用具有重要意義。因此,本研究通過建立AD小鼠模型的方式,以DHA灌胃后觀察其對神經炎癥因子及相關蛋白的影響。
1 材料與方法
1.1 材料、試劑與儀器 SD健康雄性小鼠36只,體重21~27 g,月齡6 m,購于廣東省實驗動物中心;Aβ1-42和DHA購于美國Sigma公司;辣根酶HRP標記抗鼠或抗兔IgG(IgG-HRP)、腦源性神經營養因子(BDNF)抗體、干擾素-γ(IFN-γ)抗體、核轉錄因子-κB(NF-κB)抗體購于美國Santa Cruz公司;RIPA裂解液和BCA蛋白質定量測定試劑盒購于上海碧云天公司;ELISA試劑盒購于美國R&D公司;Morris水迷宮測試系統購于深圳瑞沃德公司;腦立體定位儀購于成都儀器廠。
1.2 Aβ致AD小鼠模型的建立及分組 采用Aβ-intrahippocampal injection方法:首先,將Aβ1-42溶于NH4OH(濃度1%)和無菌三蒸水,使其工作濃度為2 μg/μl,制備寡態Aβ1-42;將小鼠麻醉后,使用固定儀將頭顱固定,去毛后沿正中切口,剝皮暴露前囟;選擇前囟后2.2 mm,中線左右旁開1.7 mm,硬腦膜下2.0 mm,采用體積為25 μl微量進樣器,向小鼠左側側腦室中注射2 μl寡態 Aβ1-42生理鹽水;待注射完畢后留針2 min;緩慢拔針后,縫合切口;于切口處涂青霉素粉末;待小鼠清醒,將其放回籠內。將注射Aβ1-42的小鼠分為Aβ模型組和Aβ+DHA組,注射生理鹽水的小鼠記為假手術組。每組小鼠均12只,于次日,采用灌胃方式給藥,Aβ+DHA組小鼠每天以DHA按照300 mg/kg劑量灌胃,而Aβ模型組和假手術組給予等量的羧甲基纖維素鈉灌胃,連續3 w后,開展后續實驗。
1.3 Morris水迷宮實驗 在上述各組小鼠給藥15 d后,于次日開始進行定位航行實驗和空間探索實驗:定義小鼠從放入水中(面壁腹部朝下)到找到平臺所需時間為潛伏期,如果小鼠未能在規定時間內(60 s)找到平臺,則應給以引導。所有小鼠在平臺的停留時間為15 s,實驗重復3次,連續訓練5 d。在實驗結束1 d后,撤掉平臺。按照原位置投放小鼠,觀察并記錄小鼠在60 s內的游泳路徑,以及穿越原平臺所在地點的次數。
1.4 尼氏染色 上述實驗結束1 d后,進行尼氏染色:每組小鼠隨機選取5只,先以生理鹽水進行心臟灌流;麻醉處死后,分離大腦,并用4%多聚甲醛進行固定;經液氮冷凍后,采用冷凍切片機切取海馬部位,作海馬結構冠狀面連續切片(厚度5 μm,每50 μm取片);沖洗后,經梯度酒精(50%、70%、80%、90%)脫水、透明、浸蠟、包埋和切片后制成石蠟切片;將切片置于載玻片上,滴加焦油紫染液,常溫下反應15 min后,以95%酒精進行分色,顯微鏡下觀察并控制染色;再經酒精梯度脫水和二甲苯透明后,以中性樹膠封片;觀察各組小鼠海馬神經元的尼氏染色情況,200倍顯微鏡下統計單位面積的陽性細胞個數。
1.5 ELISA檢測海馬炎癥因子TNF-α、IL-16檢測 各組隨機選取5只小鼠,斷頭取海馬組織,按照ELISA試劑盒說明書檢測海馬炎性因子TNF-α和IL-16的含量。
1.6 Western blot檢測海馬BDNF、IFN-γ、NF-κB蛋白檢測 取上述實驗中的海馬組織,以RIPA裂解液提取總蛋白,以BCA試劑盒定量:取蛋白樣品50 μg,加5 μl 5×loading buffer混勻,沸水浴變性5 min,離心,上樣至12% SDS-PAGE凝膠中電泳,其中,濃縮膠和分離膠的電壓分別為80 V和120 V恒壓;終止電泳后,取蛋白轉印至PVDF膜;經TBST漂洗后,以脫脂奶粉-TBST封閉液處理2 h;37 ℃下,與用TBST 500倍稀釋的BDNF、IFN-γ、NF-κB和β-actin抗體4 ℃反應過夜;次日洗膜后,加入TBST 1000倍稀釋HRP-IgG二抗,常溫下孵育1.5 h;洗膜后,滴加ECL試劑顯色;采用Gel-Pro Analyzer 6.0凝膠定量軟件分析BDNF、IFN-γ、NF-κB蛋白條帶灰度,以目的蛋白與β-actin蛋白的灰度值表示相對表達量。
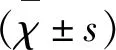
2 結 果
2.1 DHA對Aβ致AD小鼠記憶功能的影響 記錄5 d內的小鼠航行,定位小鼠的潛伏期和穿越平臺的次數,結果(見表1)。與假手術組相比,Aβ模型組和Aβ+DHA組小鼠的潛伏期顯著延長(P<0.05),而Aβ+DHA組潛伏期較Aβ模型組小鼠有所降低(P<0.05);同時,注射Aβ后小鼠穿越平臺的次數較假手術組顯著減少(P<0.05),而在注射Aβ基礎上給予DHA后,穿越次數又有所增加(P<0.05)。可見,DHA能夠改善Aβ所致AD小鼠的記憶功能障礙。
2.2 DHA對小鼠海馬神經元的影響 注射Aβ的小鼠海馬神經元有大量缺失,尼氏染色陽性細胞數所減少,與假手術組相比,差異有統計學意義(P<0.05);在注射Aβ基礎上給予DHA灌胃后,尼氏染色陽性細胞數較Aβ模型組顯著增多(P<0.05)。結果反映了DHA可以改善Aβ注射后引起的神經元損傷(見表2)。
2.3 DHA對Aβ致AD小鼠海馬TNF-α、IL-16含量 與假手術組比較,Aβ模型組和Aβ+DHA組小鼠海馬組織中TNF-α和IL-16含量顯著升高,統計學分析差異有顯著性(P<0.05);給予DHA灌胃后,海馬組織中TNF-α和IL-16含量較Aβ模型組顯著降低,差異有統計學意義(P<0.05)。結果顯示,DHA對Aβ致AD小鼠功能障礙的改善作用與下調TNF-α和IL-16含量有關(見表3)。
2.4 DHA對Aβ致AD小鼠海馬BDNF、IFN-γ、NF-κB蛋白的表達 不同小組中小鼠海馬組織中BDNF、IFN-γ、NF-κB蛋白的表達存在差異,注射Aβ后,BDNF蛋白表達水平降低,而IFN-γ和NF-κB蛋白表達水平升高,與假手術組比較,差異均有統計學意義(P<0.05);在注射Aβ并給予DHA干預后,由Aβ引起的BDNF蛋白表達降低、IFN-γ和NF-κB蛋白表達升高的結果受到減弱。表明,DHA可促進BDNF蛋白表達,抑制IFN-γ和NF-κB蛋白表達(見圖1、表4)。

表1 DHA對Aβ致AD小鼠潛伏期及穿越平臺次數的影響
與假手術組相比*P<0.05;與Aβ模型組相比#P<0.05

表2 各組小鼠神經元的尼氏染色陽性細胞數比較
與假手術組相比*P<0.05;與Aβ模型組相比#P<0.05

表3 各組小鼠海馬組織中TNF-α和IL-16含量的比較
與假手術組相比*P<0.05;與Aβ模型組相比#P<0.05

表4 各組小鼠海馬組織中BDNF、IFN-γ、NF-κB蛋白的相對表達量
與假手術組相比*P<0.05;與Aβ模型組相比#P<0.05

圖1 Western blot檢測各組小鼠海馬組織中BDNF、IFN-γ、NF-κB蛋白的表達結果
3 討 論
AD是一種隱匿性慢性疾病,其發病前在臨床前期表現為輕度認知障礙。調查數據顯示,每年在有輕度認知障礙的65歲以上老年人中AD的發病率占到95‰[8]。已步入老齡化的我國,到2053年之前老年人口規模將不斷攀升,AD的發病率也有上升的趨勢,這將為家庭和社會帶來巨大的負擔,嚴重影響著我國人們的生活質量[9,10]。因此,改善AD患者認知障礙藥物的研究一直是醫學研究領域的熱點。DHA廣泛存在于多種海洋生物中,在延緩和改善AD記憶功能方面具有很好的作用,是一種很有潛力的治療和改善AD的藥物[5]。本研究通過注射寡聚態Aβ1-42建立AD小鼠模型,探討DHA對小鼠記憶功能的影響。結果發現,DHA可改善Aβ1-42所致AD小鼠的記憶功能障礙和神經元損傷。此結果進一步驗證了王佳等[11]關于DHA改善AD學習記憶實驗結果。
近年來,越來越多的證據表明,炎癥反應是Aβ造成神經毒性引發AD的主要致病原因之一[12~14]。處在AD腦內神經元損傷部位的小膠質細胞可以不斷被激活,產生大量如IL-1β、IL-6、TNF-α和IFN-γ等炎癥因子,進而引發腦內的炎癥反應[15]。本研究通過檢測DHA干預后AD小鼠模型中TNF-α和IL-16的含量變化,BDNF、IFN-γ、NF-κB聯蛋白表達來探討和評估DHA對改善AD記憶功能障礙的分子機制。結果顯示,DHA可抑制Aβ1-42所引起的TNF-α和IL-16含量上升;進一步檢測炎性因子IFN-γ蛋白的表達發現,Aβ1-42所引起IFN-γ蛋白升高也受到抑制。此結果與陳祥榮等[16]得出DHA能夠降低小膠質細胞介導的中樞性炎癥反應中TNF-α、IL-6和IL-1β等炎性因子的表達結果相吻合。提示,DHA可能通過抑制小膠質細胞分泌炎癥因子TNF-α、IL-16和IFN-γ等改善AD功能障礙。BDNF是神經營養家族中的重要成員,在維持神經元生長和損傷后修復方面發揮著重要作用,低水平的BDNF與AD的發生發展關系密切[17]。NF-κB聯是一種重要的轉錄調節因子,在膠質細胞介導的神經炎癥中發揮著重要作用[18]。研究結果顯示,DHA還可以促進BDNF和抑制NF-κB聯蛋白表達,提示,DHA可能通過上調BDNF表達改善神經元的損傷,抑制NF-κB聯信號通路激活介導AD的炎癥反應。
綜上所述,DHA可以改善Aβ1-42致AD小鼠模型記憶功能障礙,其作用機制可能與降低海馬組織中TNF-α和IL-16含量,抑制IFN-γ和NF-κB聯蛋白表達,促進BDNF蛋白表達有關。這一結果為DHA治療AD記憶功能障礙的臨床應用提供了新的理論依據。

